5月27日,依据国家食品药品监督管理总局《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)要求,国家食品药品监督管理总局医疗器械技术审评中心公示了30个IVD类创新医疗器械特殊审批结果:

其中有一项是芯片式数字聚合酶链式反应(DPCR)分析系统,这就意味着,该数字PCR相关产品将进入“绿色通道”,或将成为中国乃至全球的第一款基于数字PCR的检测设备!
2014年2月7日,国家食品药品监督管理总局为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定了创新医疗器械特别审批程序,迄今,这一特别审批的通过率仅14.7%!
如此残酷的通过率,得益于国家对于创新医疗器械严苛的审批标准:
审批申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
先来看看国家食品药品监督管理总局对其工作原理的描述:对目标核酸序列定量和定性检测,用聚合酶链式反应分析法,将具有荧光定量PCR的反应物(TaqMan探针法或SYBR绿色引物法)加载到芯片上,然后用dPCR扩增仪进行热循环反应。芯片反应完成后放到dPCR分析仪上进行成像和分析,输出原始数据,将原始数据放到云端的dPCR软件上分析,并得到最终结果。仪器每处理一个芯片,只要一分钟仪器就能读完芯片。
数字PCR是一种新的核酸检测和定量方法,与传统PCR技术不同,数字PCR采用绝对定量的方式,采用的策略概括起来非常简单,就是“分而治之”,类似于计算机科学中的“分治算法”,将一个标准PCR反应分配到大量微小的反应器中,在每个反应器中包含或不包含一个或多个拷贝的目标分子(
DNA模板) ,实现“单分子模板PCR扩增”,扩增结束后,通过阳性反应器的数目“数出”目标序列的拷贝数,特别适合在复杂背景中检测稀有突变。
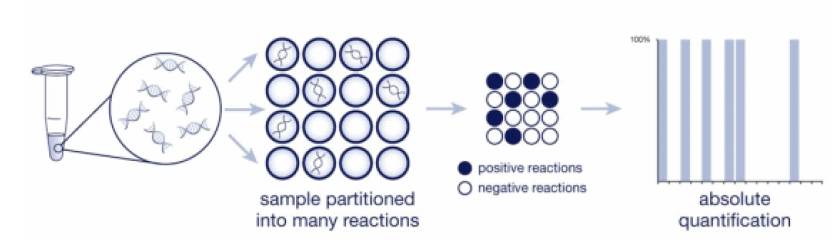
数字PCR的原理
这款芯片式聚合酶链式反应分析系统引进美国技术,加上科维思自主知识产权,快速本地化,将成为中国乃至全球的第一款数字PCR技术平台,服务于肿瘤液体活检(和现有产品相比)以更高的灵敏度和特异性。让患者治疗费用能带来预期的效果,避免耽误治疗的时间。
今年3月份,
阿斯利康新上市第三代靶向药泰瑞沙。AZ在比较了NGS,qPCR和数字PCR的检测结果后认为,数字pcr是AZ9291伴随诊断的首选。检测灵敏度更高,操作更加方便快捷,结果更加明确。科维思作为预期第一个拿到医疗器械注册证的企业,前期已经和阿斯利康进行了数次沟通,可以帮助AZ解决样本检测统一标准、数据全流程可追溯,以及设备快速进院的问题。
液体活检因其可以实现微创、实时、快速的癌症诊断,被《麻省理工大学科技评论》评选为“2015年十大突破技术”。其优势在于能通过非侵入性取样降低活检的危害,有效延长患者生存期,性价比高。目前液体活检的主要检测物包括检测血液中游离的循环肿瘤细胞(CTCs),循环肿瘤DNA(ctDNA)碎片,循环RNA(Circulating
RNA)和外泌体(携带有细胞来源相关的多种蛋白质,脂类,DNA,RNA等)。其中,ctDNA,RNA和外泌体是肿瘤细胞自身分泌或死亡时释放的物质。
芯片式聚合酶链式反应(DPCR)分析系统的创新就在于,以患者外周血为媒介取代组织活检,检测肿瘤相关的基因突变的存在,并动态监控其随病程进展及治疗过程发生的演变,结合生物信息分析技术,实现对肿瘤早期诊断、个性化治疗、治疗效及预后评估和监控等工作,从而为癌症病人的临床伴随诊断和个性化治疗提供有力的依据。特别是针对正在接受靶向药治疗的癌症患者,帮助临床医生及时发现患者体内癌症细胞的抗药性,调整诊疗方案,实现治疗效果的最大化,以最小化的医源性损害、最低化的医疗资源耗费去获得最大化的病患的效益。
2015年11月,科维思和美国生物企业Thermo Fisher
Scientific(赛默飞)署合作协议,在中国本地化芯片式数字PCR系统,成为中国第一家在这一技术平台上的合作企业。
2016年4月,科维思在Thermo Fisher产品的基础上,申请了核心耗材的发明专利,成为创新医疗器械的主要支撑。
作为一家新兴的基因技术企业,南京科维思生物科技有限公司以高通量测序(NGS)和数字
PCR相结合,实现两种技术平台的优势互补,其竞争优势体现在持续的技术创新和产品开发能力,国际水平的临床研究能力和基于对临床需求的深入了解形成的产品设计。于是科维思可以成为大量提供测序服务企业的技术和产品的供应商,并能不断为科研市场提供有前瞻性的产品,而其正在申报的IVD诊断试剂有望成为高通量测序在肿瘤无创分子标志物检测的第一个获得FDA批准的产品。
科维思芯片式数字PCR系统将以一个全新的技术平台出现在公众的视野,下一个目标是自主研发适合临床应用的简单快捷、高自动化、高灵敏度的高通量测序仪,与前期相关技术积累相整合,形成与数字PCR互补的另一技术平台,全面覆盖肿瘤液体活检的检验产品需求,这两条产品线都有核心知识产权保护,期望在液体活检这一高成长的市场成为技术的领跑者。同时,科维思期待和更多IVD厂商合作,在这个新的技术平台共同研发新产品,共同向医院终端进行推广,为肿瘤患者延长生命。
投稿及报料请发邮件到[email protected]
商务及内容合作可联系QQ:412539092














