双抗未来很美,但要先跨过这些难点
周鹏飞
双抗显然是个热点话题。写意君分别就双特性抗体的未来、开发关键、重点治疗领域等问题采访了一些业内专家,并陆续将他们的观点整理分享。
双特异性抗体(BsAb,双抗)将是抗体类药物发展的一个重要方向,具有广阔的临床应用前景与巨大的市场价值,这点是毋庸置疑的。
抗体类药物是目前市场上最成功的药物,我们认为治疗性抗体的发展方向主要包括新靶点、抗体工程化改造、抗体偶联药物和双特异抗体等,其中双特异抗体是最重要的方向之一。
与单一靶点的抗体药物(单抗)相比,BsAb不仅具有可比拟的靶点结合、抑制、中和、携带毒素、ADCC和CDC的功能,此外因它可设计同时结合“肿瘤靶点 + 免疫细胞靶点”、“肿瘤靶点 + 肿瘤靶点”、“免疫靶点 + 免疫靶点”、“炎性靶点 + 炎性靶点”、“血管生长因子 + 络氨酸激酶受体”、“病毒靶点 + 病毒靶点”等组合,所以具有细胞间或蛋白间连接桥梁的特殊作用,可招募更多的免疫细胞靶向于肿瘤细胞或对疾病靶点的多重交联抑制作用,从而获得比单抗更好的治疗效果,或对单一靶点抗体药物没有足够反应的疾病提供额外的治疗选择,能达到单抗或单抗组合疗法无法达到的治疗效果。
举个例子,同时靶向肿瘤靶点和免疫细胞靶点的作用机制类双特异抗体——已上市的Removab和Blincyto均是此类靶点设计,通过双抗作为连接子将免疫细胞聚集至肿瘤细胞附近,从而极大的加强免疫细胞对于肿瘤细胞的杀伤作用。
同时,随着抗PD1/PD-L1等免疫检查点抑制剂的发展,其与T细胞招募作用的双抗联合使用有望获得更好的治疗效果,罗氏的CEA TCB在I期联合抗PD-L1单抗临床研究中已获得积极数据。
又如另外一种双抗药物,其特殊作用方式就是强制蛋白结合功能,代表药物是罗氏的emicizumab,通过双抗的两个臂将IX因子与X因子结合在一起,起到VIII因子的作用,这种作用机制也是双抗才能做到的。
从以上两种特殊的作用方式可以看出,双抗依靠自身结构优势,具备独特的桥梁作用,这种桥梁作用不依赖靶点本身的功能,使得双抗对于靶点的选择更加多样化,极大的拓宽了药物开发的空间与领域,必定会成为未来药物开发的重要方向。
目前上市的双抗有Catumaxomab(EpCAM x CD3),Blinatumomab(CD19 x CD3)和Emicizumab(FIXa x FX)。其中Catumaxomab和Blinatumomab是用于肿瘤治疗,此类双抗设计具有广泛性,可针对不同肿瘤开发更多的同类机制双抗。Emicizumab是应用双抗特殊的结构,将针对FIXa和FX抗体表达在一个双抗体分子上,从而模拟FVIIIa的功能,是双抗应用的特例,不具备广泛性。
又如前所述,单抗在肿瘤和免疫性疾病已经取得了良好的效果,但在病人有效响应率、治疗效果、耐药性、药物用量方面依然存在未被满足的临床需求,双抗则有很大的潜力解决这些问题,因此肿瘤和免疫性疾病将是双抗的重点治疗领域。
在双抗的制备方面,关键是拥有自己的结构和制备技术平台。常说“单抗比靶点,双抗比平台”。
抗体在细胞内的表达组装方式决定了双特异抗体必须采用特殊的结构才能保证其生产工艺的稳定,最重要的就是解决“错配”和“理化和体内稳定性”问题。此外基因工程技术发展已经非常成熟,还需规避平台技术的专利风险。
国内外有很多双抗平台技术,比如BiTE、Duobody、DVD-Ig、DART等,国内也有岸迈生物的FIT-Ig、健能隆的iTab、友芝友生物制药的YBODY®等多个双抗技术平台,各个平台开发的双抗各有其特点。
在双抗的设计和临床前评价方面,关键和难点是靶点的设计和评价模型的建立。
虽然在靶点设计上有许多非常充分的理论依据,但因为双靶点会引起更复杂的作用机制,体外模型通常无法完全模拟体内的环境,不能充分评价双抗体的作用机制和药理作用。
此外,常规动物模型因无与人相当的靶点结合特性,如靶点的表达情况与人不相同,结合能力不同,药理作用有差异,人源化动物模型上下游信号与人有差异,导致临床前评价模型很难正确评价靶点设计的合理性、药理作用以及毒理作用,增加了对评价靶点设计合理性的难度。
在双抗的临床研究方面,关键和难点是临床I期剂量的设计和不良反应的预防和控制。其主要原因是临床前评价的模型不能进行临床试验的转化。
临床前目前通常采用替代分子、人源化动物和MABEL方法,这些模型一定程度上反应了双抗体的作用机制、药理作用、毒性靶点和毒性现象,但因种属靶点表达、结合能力、药理作用、药物PK和种属的差异,临床前评价获得的有效剂量、毒性剂量和毒副反应,一般不能直接进行临床剂量的转换,甚至或产生一定程度的误导,增加临床研究的风险。
因此还需开发更合适的双抗体临床前评价模型和方法,或者放开对高等级灵长类动物,如黑猩猩等动物的试验限制,从而更好的进行双抗的临床前评价。
打赢“双抗之战”关键要有这两个“武器”
顾津明
展望未来,继续寻找一种完美的双特异性抗体format也许并不现实。怎样充分利用现有(专利已经或将要过期)的formats开发出满足自己需要的双特异性抗体药物或许是各大药企面临的最大挑战。
上世纪70年代随着杂交瘤技术的出现,人们立即想到能否用同一个抗体来靶向两个不同靶点,也就是双特异性抗体(Bispecific Antibody,bsAb)。
最早的双特异性抗体大多使用化学偶联的方法,虽然方法简单,但是所得产物复杂不均一,很难用于工业化生产。直到上世纪80年代,随着重组DNA技术的推广,以scFv为基础的重组双特异性抗体出现并逐渐成为研究重点。
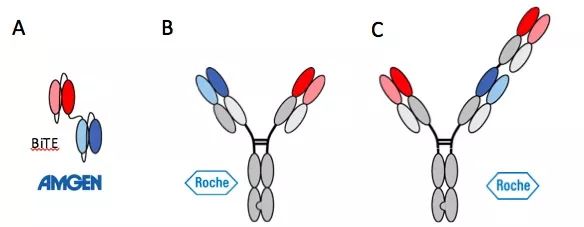
第一代双特异性抗体的典型代表就是Amgen/Micromet的BiTE(Bispecific T-cell Engager),它结构简单,由两个scFv连接而成(图1A),但缺点也很明显,就是半衰期短(仅2个小时),表达量低。因为半衰期短,所以在临床上不得不使用一个泵持续给药。好在BiTE的临床给药量低,不到普通抗体用量的十分之一,无形中解决了大量生产的难题。在克服各种困难后,第一个重组双特异性抗体Blinatumomab(CD3-CD19 BiTE)终于在2014年12月获FDA批准在美国上市。
上世纪90年代Genentech的Paul Carter团队发明了knob-into-hole结构的双特异性抗体,成为第二代双特异性抗体的典型代表(图1B)。第二代双特异性抗体有近似天然IgG的结构及稳定性,在表达及下游工艺方面也有了很大提高。Roche/Chugai使用knob-into-hole技术的Emicizumab (factor IX and factor X bsAb)于2017年11月获FDA批准成为第二个在美国上市的双特异性抗体。
目前全球有大约120种双特异性抗体在不同临床开发阶段,其中不乏所谓的第三代双特异性抗体。究竟哪些可以称得上第三代双特异性抗体,恐怕是仁者见仁智者见智了。笔者认为如果以T细胞靶向治疗为例,Roche的CEA-TCB (CD3-CEA双特异性抗体) (图1C)是第三代双特异性抗体的典型代表。因为它不仅利用了第二代双特异性抗体的knob-into-hole技术,并且Roche工程师在并购Genentech后不久发明了CrossMab技术而成功地解决了knob-into-hole技术在common light chain方面的技术瓶颈。此外,CEA-TCB实现了肿瘤抗原的双价结合(bivalent binding)和CD3的单价结合(monovalent binding),使得该双特异性抗体能够在结合肿瘤抗原时产生avidity效果而同时减小CD3抗体带来的毒性。目前CEA-TCB已经完成1期临床并取得令人满意的结果。
图1. 双特异性抗体的几种不同formats
从1986年首个抗体药物Muromonab(OKT3)获批上市,截至2017年底,FDA累计批准上市了73个抗体类药物。其中只有以上列举的2个双特异性抗体。可以看出,双特异性抗体的发展明显滞后于治疗性单克隆抗体。究其原因,不外乎以下几个方面:
1、早期双特异性抗体表达困难,稳定性差,生产工艺复杂;
2、双特异性抗体早期研发成本明显高于单克隆抗体。以Emicizumab为例,Chugai的科学家们是在筛选了4万个不同双特异性抗体分子后才确定了成药分子,这当中的付出与坚持恐怕不是一般企业能做得到的;
3、双特异性抗体项目立项牵涉到靶点生物学、结构生物学、抗体工程、筛选策略,因此只有具备相当实力的公司才敢涉足也才有可能取得成功。
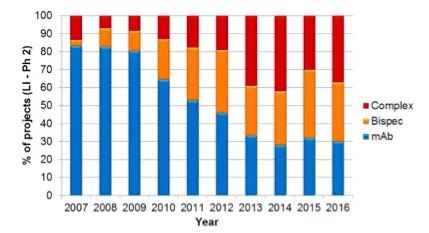
2017年抗体药物市场容量首次突破千亿美元大关。抗体药物已成为整个制药行业中发展最快的领域之一。而处于抗体药物发展最前沿的双特异性抗体也早已成为全球各大制药企业重点布局的发展方向。以Roche为例,双特异性抗体已占其大分子药物研发管线的30%以上(图2)。随着癌症免疫治疗的持续升温以及CAR-T治疗的异军突起,相信双特异性抗体在实体瘤治疗领域将占有相当大的市场份额。相较CAR-T而言,双特异性抗体药物具有剂量可控、用药周期灵活的优点。同时,双特异性抗体药物还可以针对其它免疫细胞,如NK、Macrophage等等。
图2. Roche大分子药物研发管线布局
针对双特异性抗体项目立项,笔者认为研发双特异性抗体必须要达到两个单克隆抗体联用无法达到的效果。总结目前双特异性抗体项目的主要研究方向大体可以分为五类:
1、免疫细胞(尤其是T细胞)肿瘤靶向治疗;
2、局部给药(穿透血脑屏障,关节炎症病灶,眼球);
3、信号通路协同效应(Synergy);
4、利用双靶点增强靶向特异性;
5、利用靶向同一靶点的不同表位(Epitope) 增强内吞(Internalization)或形成激动剂(Agonist)。
一旦确定靶点,接下来的问题就是选择bsAb formats。目前文献报道过的各种bsAb formats在100种以上,业内推崇的做法是根据专利保护、靶点特性、所要达到的治疗目标而选择2-3种不同的formats进行双特异性抗体的构建表达。
同时,一个成功的双特异性抗体项目离不开好的筛选策略。与单克隆抗体研发类似,能拿到什么样的双特异性抗体药物取决于采用什么样的筛选方法(Screening Funnel)。以CD3-CEA双特异性抗体为例,理想化的双特异性抗体药物应该是当且仅当CD3-CEA双特异性抗体在过表达CEA的细胞存在时才激活T细胞。这就需要设计相关的生物学实验来进行筛选。
此外,双特异性抗体还要经过一系列严格的成药性(Developability)实验筛选才能满足后期的工业化生产的要求。往往在筛选过程中很多双特异性抗体拥有生物学功能却不能达到成药性(特别是由于形成聚体aggregates)的要求。在这种情况下就需要进行抗体工程(Antibody Engineering)改造。目前常用的抗体工程工具有以下几种:
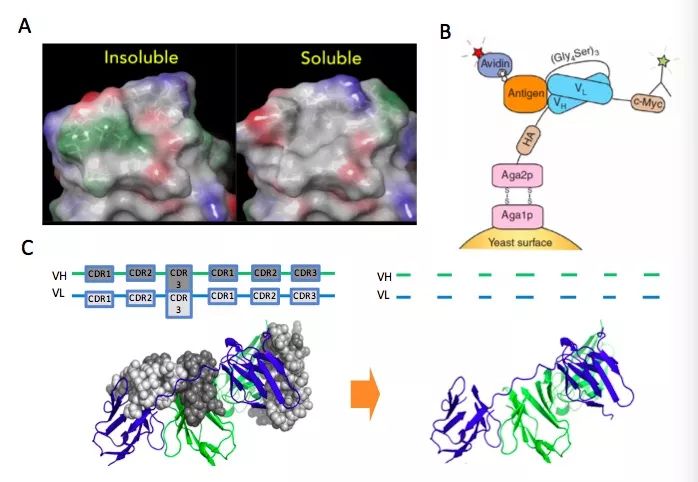
1、利用计算模型(Computational Modeling)对双特异性抗体的VH/VL(Fv)进行建模,找出并修改hydrophobic patch从而改善聚体的形成并提高溶解度(图3A);
2、目前大多数双特异性抗体formats都包含(sc)Fv作为其基本结构单元,而很多时候双特异性抗体的生物活性及成药性取决于(sc)Fv的活性及稳定性;因此可以将scFv在酵母表面进行展示(Yeast Display)(图3B)对其进行亲和力及热稳定性的优化;
3、有时候双特异性抗体成药性差是由于framework造成的,这种情况可以将双特异性抗体的CDRs嫁接(CDR grafting)到已知的成药性好的framework上(图3C)。在实际研发过程中,往往要将几种不同的抗体工程工具结合使用才能取得较好的结果。
图3. 常用的抗体工程工具
近年来,跨国药企纷纷投入巨资进行双特异性抗体的研发。表现为不仅在内部开发自己的formats及扩充研发管线,还积极通过技术引进(in license)买入其它不同formats(表1)。
表1. 近两年跨国药企在双特异性抗体技术引进方面的交易
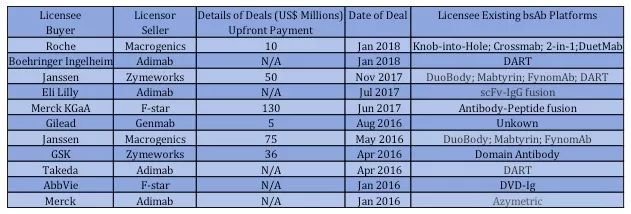
以Roche为例,在已有Knob-into-Hole、Crossmab、2-in-1的基础上又分别在2014年及2017年从Dutalys及Macrogenics引进不同的双特异性抗体formats。这是为什么呢?这是因为目前已有的100多种双特异性抗体formats中没有任何一个是完美的并且适合各种需要。在实际研发过程中,往往某个单克隆抗体在一种format上表现很好而在另一种format上完全无效。因此最好的策略就是同时使用几种不同的formats进行双特异性抗体的构建表达及筛选,从中选出最好的分子。这种研发策略已经逐渐在业内取得共识。
展望未来,继续寻找一种完美的双特异性抗体format也许并不现实。怎样充分利用现有(专利已经或将要过期)的formats开发出满足自己需要的双特异性抗体药物或许是各大药企面临的最大挑战。
未来双特异性抗体研发的竞争不会是format与format的比拼而将是筛选策略以及抗体工程改造方面的竞争。
谁掌握了全面的双特异性抗体筛选策略并且拥有完整的双特异性抗体工程改造工具包(tool box),谁就能在未来激烈的双特异性抗体研发竞争中取得领先地位。
最后,推荐两项有希望在未来双特异性抗体的研发中“独占鳌头”的技术。
一是Regeneron以及Merus这两家公司各自拥有的common light chain humantransgenic mice正成为双特异性抗体的生产工厂。单克隆抗体的研发经验告诉我们,从体内得到的抗体往往具有更好的亲和力及成药性。因此,他们拿到的双特异性抗体成功率可能更高而研发周期也随之缩短。值得一提的是,2016年12月美国Incyte公司支付了1.2亿美金首付款从Merus引进了这项技术。
另一项是Adimab的IgG酵母展示技术,这使得双特异性抗体建库及细胞筛选成为可能。正因为这项技术的独特性与前瞻性,已经有包括Eli Lilly及Merck在内的多家跨国药企出巨资购买了这项技术用于双特异性抗体的研发。这两项技术所产生的双特异性抗体最后能否在临床上取得成功,我们将拭目以待。
双特异抗体的研发:应用决定设计
刘跃
双特异性抗体的研发已有二十多年的历史。和单抗相比,双抗的应用具有单抗不具备的优点,但双抗研发也有比单抗研发更高的技术要求。如何拓宽双抗的应用并克服研发中遇到的技术瓶颈,是大家都关心的问题。这次应同写意程博邀约,写一篇有关双特异性抗体研发的小文,主要聚焦在以下三个问题:
1.你对双抗药物的开发未来是否看好?为什么?
2.你认为双抗开发的关键和难点是什么?为什么?
3.你认为未来双抗开发的重点治疗领域是什么?为什么?
于是写下这篇“命题作文”,抛砖引玉,和同行一起分享一下我个人对这三个问题的一些想法和心得。
靶向多靶点和同一靶点的不同表位会带来更好的疗效,这一点已得到业界公认。而达到这一目的的方法却可以有很多种。比较常用的方法有:
1)联合使用抗不同靶点或同一靶点不同表位的单抗。比如trastuzumab (Herceptin) 和 bevacizumab (Avastin) 就曾被联用于治疗“primary inflammatoryHer2 positive”乳腺癌
(
https://clinicaltrials.gov/ct2/show/NCT00717405
)
。
2)使用几种单抗的混合物,模拟多抗。比如Sym004, 两种抗EGF-R 单抗的混合物,就曾被应用于治疗对EGF-R 单抗疗法耐药的头颈癌病人
(
https://clinicaltrials.gov/ct2/show/results/NCT01417936
)
。
3)使用双特异性抗体。和前两种方法相比,双抗有两种优势:首先,“AB” 形式可以解决一些”A+B”形式无法解决的问题,比如T cell recruitment。其次,在好的设计和好的平台护航下,“AB”的生产成本应该低于”A+B”。
在过去的二十年间,双抗的构建和应用都有了长足的进步。FDA 迄今为止批准的三例双抗catumaxomab (anti-CD3 and anti-EpCAM) ,blinatumomab (anti-CD3 and anti-CD19)和emicizumab(anti-Factor IXa and Factor X) 分别使用不同的结构设计和应用不同的靶点生物学,它们作为双抗在临床应用的实证既预示了双抗应用的广泛前景,也暴露了不少现有双抗模式本身及研发过程中存在的问题。相信随着业界同仁们的共同努力,双抗药物设计和生产会越来越进步,在未来的应用也会更越来越广泛。
所以关于双抗开发的未来,我觉得可以总结成一句哲学名言:“前途是光明的,道路是曲折的”。
双特异性抗体的开发关键我认为在于如何根据相关的靶点生物学来选择合适的技术平台和克服与具体平台相关的技术难点。简单地说,就是要根据应用来设计。以FDA 已批准的三例双抗为例,它们现有的优点都来自于应用需要和设计统一的部分,而它们的缺点也是来自于应用需要和设计不统一的部分。下面是我的逐例分析:
1)catumaxomab (anti-CD3 and anti-EpCAM)
做为第一例被FDA批准的双抗,catumaxomab想要达到的应用目标是“一个三功能” 的双特异性抗体。如下图所示,左臂靶向EpCAM阳性的肿瘤细胞,右臂recruit T 细胞,Fc端结合NK, Macrophage等效应细胞,通过
Cited from:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2840231/figure/F1/
T cell mediated lysis, cytotoxicity by released cytokines (e.g., IL1β, IL-2, IL-6, IL-12 or DC-CK1), phagocytosis or ADCC等多重效应来杀伤肿瘤细胞。作为第一个被FDA批准的T cell recruiter 类双抗,catumaxomab具有里程碑式的意义。事实上,在对有腹水的卵巢癌和其它癌患者的治疗中,catumaxomab的确显示了良好的疗效。但在这一过程中,细胞因子风暴引起的发热,恶心,呕吐等副作用多有出现,同时,在第0, 3, 7 和10 天分别进行10, 20, 50 and 150 µg四次注射后,70%的患者出现了Human anti-mouse antibody/human anti-rat antibody (HAMA/HARA)。















