
哈喽啊,亲爱的小伙伴们,你们的科研小伙伴馆长又带着新鲜出炉的佳作强势登场啦!不知道大家有时候有没有这种想法?就是感觉别人发文又快又容易,怎么自己就这么难呢?想到这里不免有些要emo了,但是馆长希望大家包括馆长在内的我们在看到别人光鲜亮丽的一面时,也不要忽视了人家背后所付出的努力哦!付出总会有回报的!大家还是要继续努力,加油!
话不多说,馆长来给大家揭秘今天的重要嘉宾,是一篇由西北大学范代娣、朱晨辉和傅容湛团队在Journal of Advanced Research杂志上发表的题为Ginsenoside Rh4 inhibits colorectal cancer via the modulation of gut microbiota-mediated bile acid metabolism的论文,这项研究
首次证实了
人参皂苷Rh4能够通过调节肠道微生物群介导的胆汁酸代谢来抑制结直肠癌的发展
,创新性杠杠的!来和馆长一起学习一下吧!这篇文章的看点主要有以下几点:
1.建立
AOM/DSS结直肠癌模型
,准确研究了人参皂苷
Rh4的作用机制:
发现
Rh4主要以肠道微生物群依赖的方式来抑制结直肠癌(CRC)。
2.
运用转录组学、基因组学和代谢组学
多组学
技术探索Rh4对CRC的抑制作用
:
分析手段多种方式联合使结果更加准确可靠。
3.采用
抗生素处理和粪便微生物群移植(FMT)实验来研究肠道微生物群的作用
:
阐明Rh4在CRC中调控的关键功能细菌和代谢物,这项研究中的动物实验技术难度都还挺大的,可以为相关研究提供参考。
PS:插播一个小广告,如果大家最近遇到了瓶颈,找不到好的发文思路,可以扫码联系馆长,可以帮助大家寻找更多灵感,而且有问题的话也可以咨询馆长,这里有专业的老师为你答疑解惑!
定制生信分析
云服务器租赁
加好友
备注“99”
领取试用

l
题目:人参皂苷Rh4调节肠道菌介导的胆汁酸代谢抑制结直肠癌
l
杂志:Journal of Advanced Research
l
影响因子:IF=
11.4
l
发表时间:
2024年7月
研究背景
肠道菌群失调正成为结直肠癌(CRC)发病机制的关键因素。人参皂苷Rh4(Rh4)是一种从人参中分离出来的活性化合物,具有调节肠道炎症和肠道菌群失调的有益作用,但Rh4如何调节肠道菌群以缓解CRC仍未得到充分探索。这项研究
通过转录组学、基因组学和代谢组学技术来探讨Rh4对CRC的抑制作用
,并通过
涉及抗生素治疗和粪便微生物群移植(FMT)的实验来研究肠道微生物群的作用
,阐明了Rh4调节的关键功能细菌和代谢物在CRC中的关键作用。
研究思路
首先,
建立偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)结肠炎相关癌症模型
;其次采用
转录组学、基因组学和代谢组学技术研究
Rh4对结直肠癌的抑制作用;此外,通过
抗生素治疗和粪便微生物群移植(FMT)实验
系统地探讨了Rh4-肠道菌群串扰在治疗结直肠癌中的作用;最后,
阐明
结直肠癌中
关键细菌种类和由Rh4调控的代谢生命所起的关键作用
。
主要结果
1.Rh4逆转AOM/DSS处理小鼠的肠道菌群失调
通过相关动物实验证明了
Rh4可以抑制CRC的发展,以及
Rh4能够恢复经AOM/DSS处理的小鼠的肠道屏障功能的能力,接下来进一步研究Rh4对肠道菌群的影响。
聚类分析
结果
发现
Rh4组与正常组之间存在高度的相似性
(图1A-B)。
Alpha多样性分析
显示
Rh4处理组小鼠的肠道群落的丰富度和多样性显著变化,而Chao1指数没有显著差异
(图1C-E)。
Beta多样性分析
显示
模型组、Rh4组和正常组之间存在分离
(图1F-H)。在
门水平
上,
Rh4处理增加了拟杆菌门的丰度
(图1I)。在
属水平
上,
阿克曼菌和普雷沃菌在Rh4处理组中富集,而脱硫弧菌在模型组中最为丰富
(图1J)。
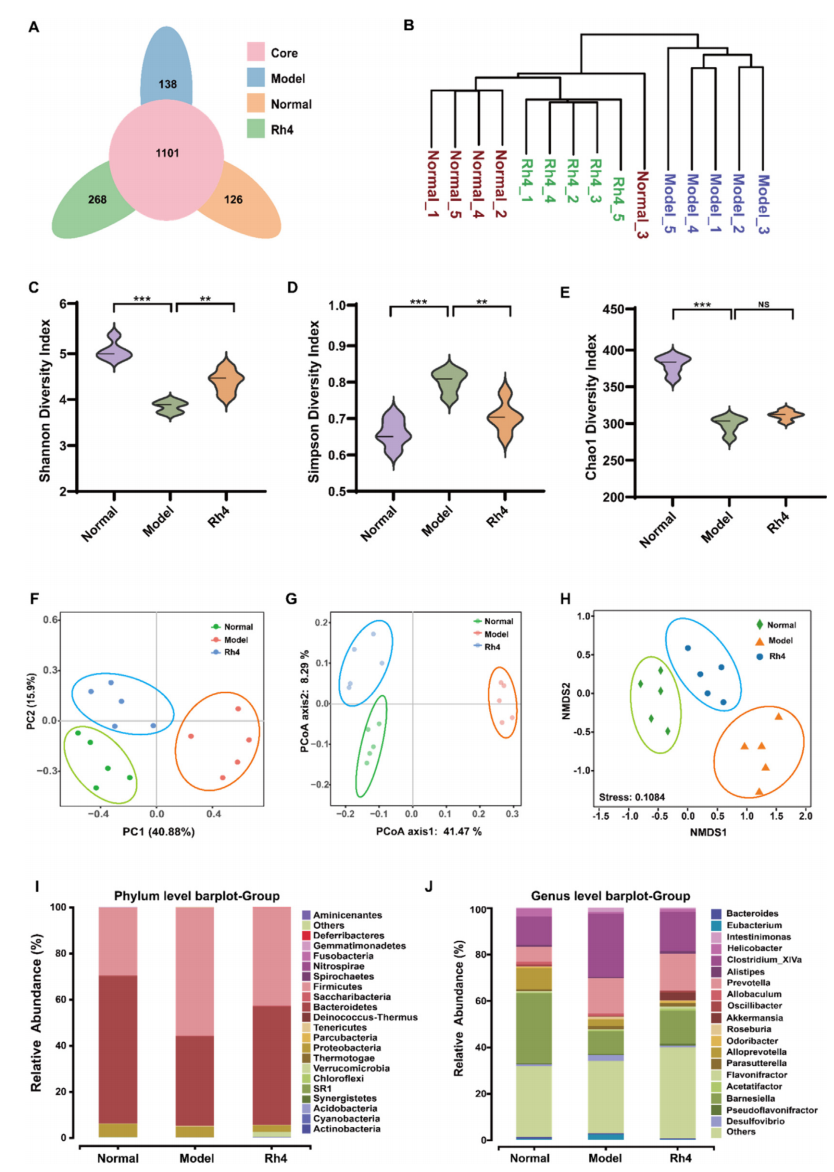
图1 Rh4逆转AOM/DSS处理小鼠的肠道菌群失调
2.Rh4抑制依赖于肠道菌群的CRC
通过抗生素治疗和FMT实验等系统分析Rh4对依赖于肠道菌群的CRC中的作用(图2A和图3A)。
16S rRNA分析
证明了本研究
无菌小鼠模型的成功建立
(图2B-C)。
进行抗生素干预的
AOM/DSS
模型组小鼠
与未进行抗生素干预的模型小鼠相比,
肿瘤恶性程度降低
(图2D-F)。口服抗生素处理的模型组小鼠的肠道菌群耗竭之后产生干扰素-γ的T细胞显著增加,而产生白细胞介素10的T细胞相应减少,因此
口服抗生素耗竭肠道菌群可显著降低肿瘤负担
。在抗生素干预的情况下,结合Rh4治疗并没有进一步改善抗生素干预模型组小鼠的结肠缩短和肿瘤恶性程度(图2D-F)。
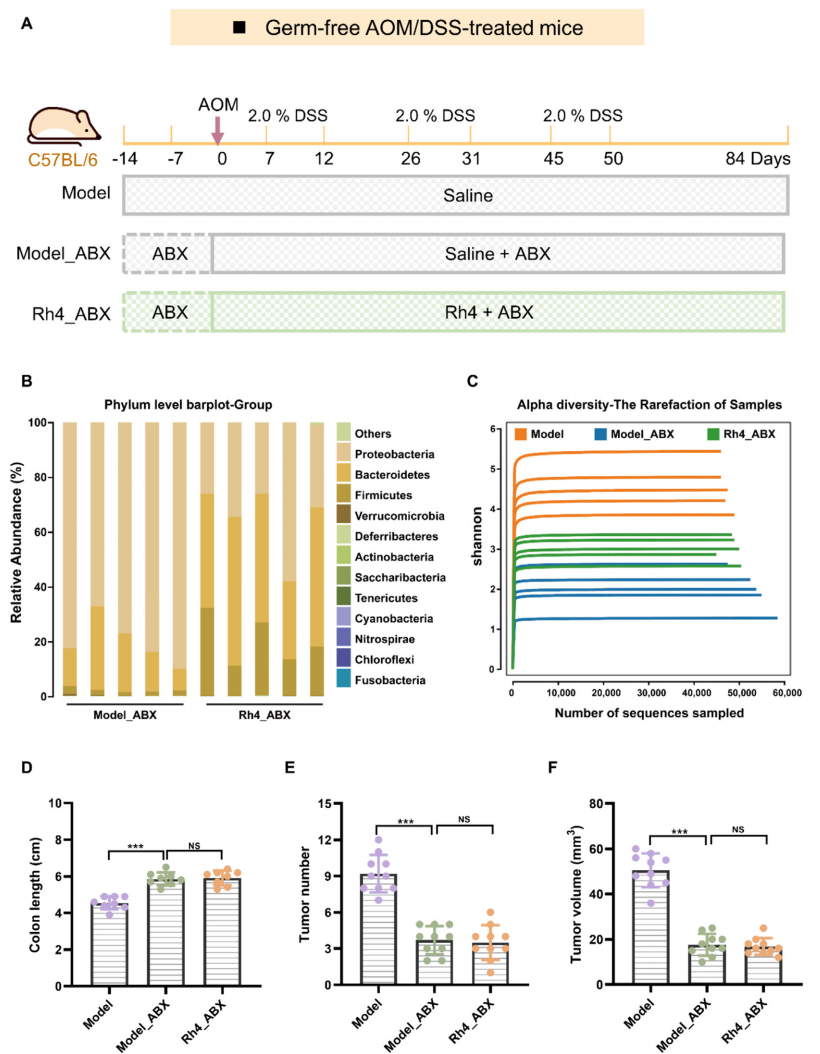
图2 Rh4抑制依赖于肠道菌群的CRC
3.肠道菌群在Rh4抑制CRC中的关键作用
在无菌小鼠中进行FMT,之后将从供体小鼠中收集的肠道菌群转移到受体小鼠体内(图3A)。
Rh4处理后的FMT小鼠的CRC所引起的体重减轻和结肠缩短有所减轻
(图3B-E),同时也
减少了小鼠结肠肿瘤得数量,直接抑制了CRC的发生
(图3F-G)。
WB
(图3H-J)的结果显示,
Rh4处理的FMT小鼠的肠道紧密连接蛋白的表达显著增加,能够发挥修复肠道屏障功能损伤的作用。
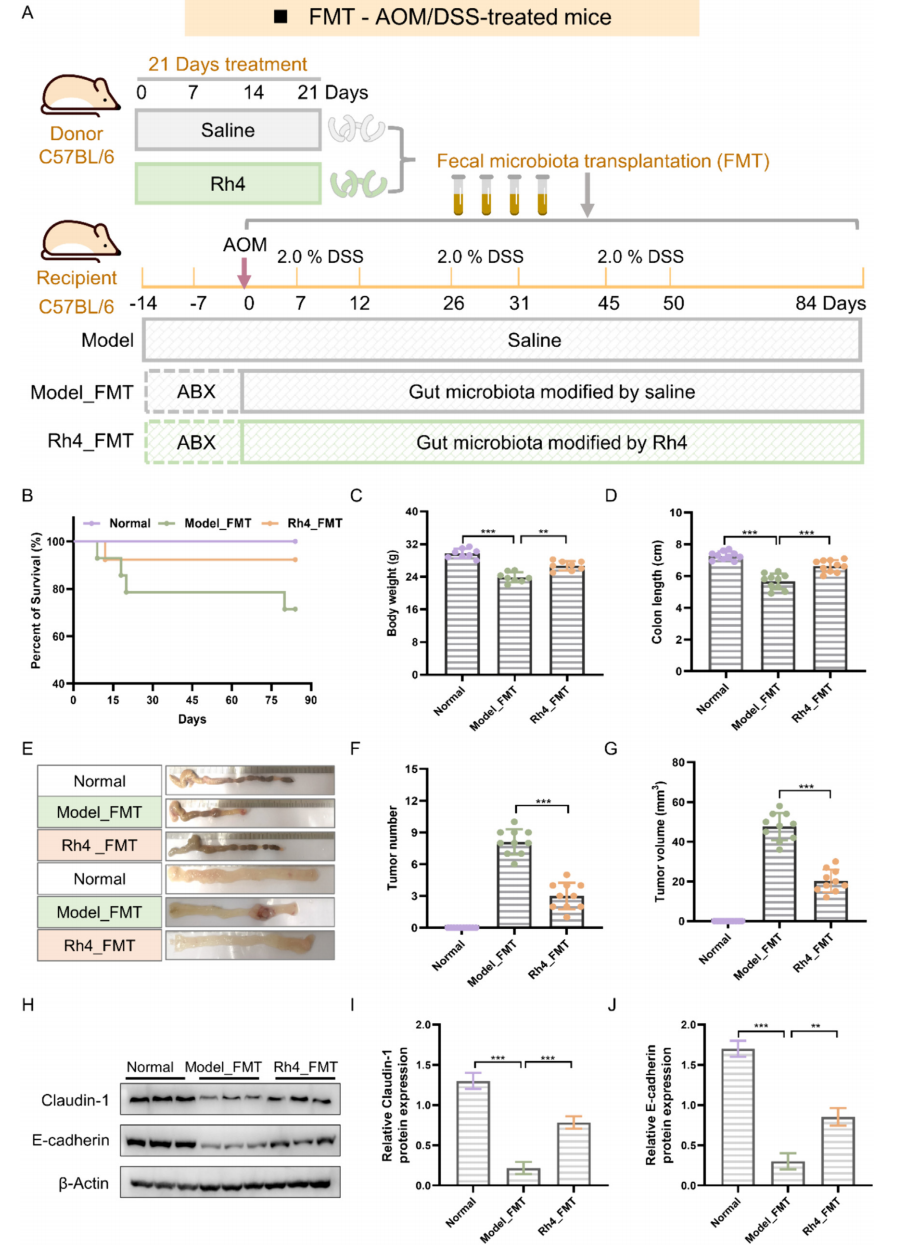
图3 肠道菌群在Rh4抑制CRC中的关键作用。
4.A. Muciniphila是Rh4修饰的肠道菌群中的关键功能菌株
在物种水平上研究Rh4治疗对小鼠肠道菌群的影响表明,
Rh4治疗能够显著促进有益菌A. muciniphila在肠道的聚集
(图4A-B)。
线性判别分析效应大小(LEfSe)
显示除了
A. muciniphila之外,Verrucomicrobiaceae也是Rh4治疗组的标志菌,并且Rh4和Rh4_FMT治疗组均表现出益生菌显著上调和Desulfovibrio_vietnamensis等有害细菌的消除的结果
(图4C-G)。
A. muciniphila在体外的活力的活力能被Rh4提高
(图4H)。A. muciniphila与CRC
细胞共培养实验
表明,
A. muciniphila可显著抑制HCT116和CT26细胞增殖,
A. muciniphila和Rh4
均不影响NCM460正常结肠上皮细胞中正常细胞的生长
(图4I-K)。
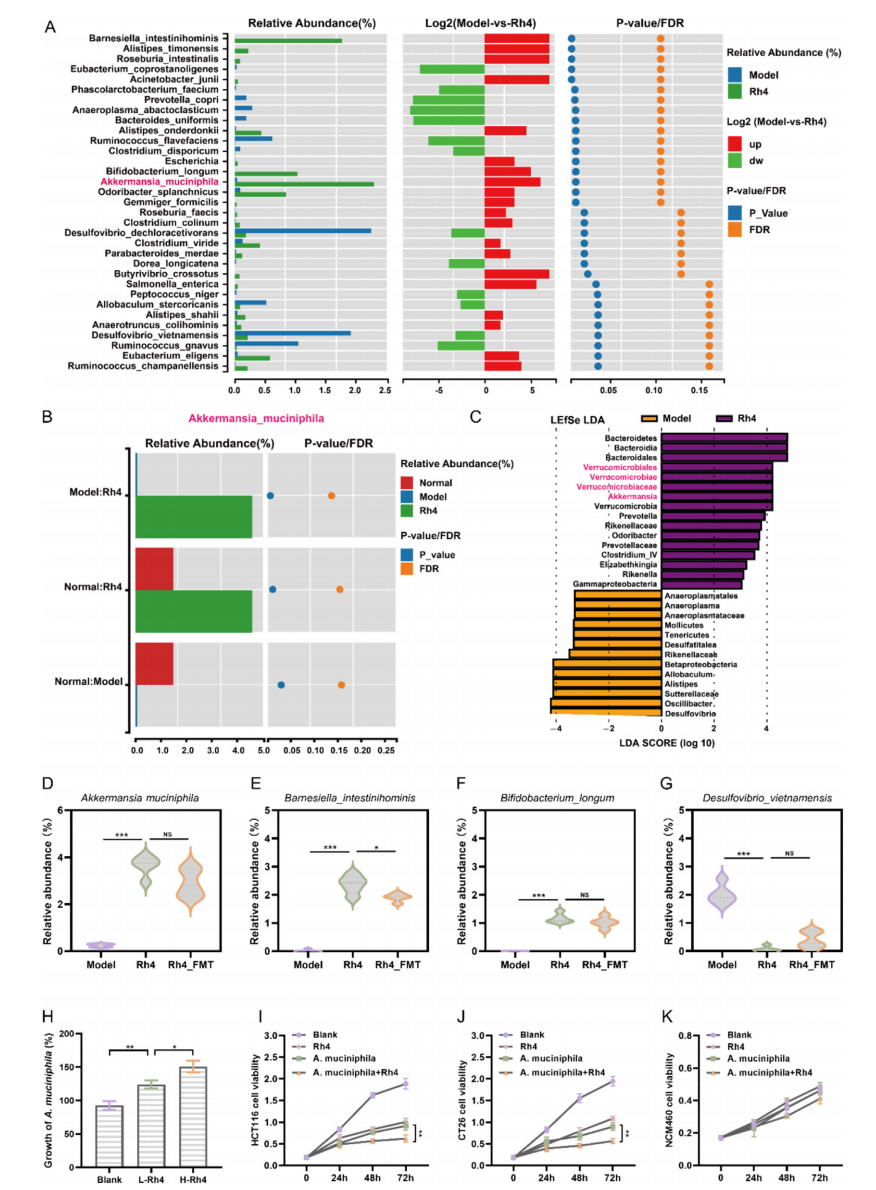
图4 A. Muciniphila是Rh4修饰的肠道菌群中的关键功能菌株。
5.UDCA通过调节A. Muciniphila充当Rh4抑制结肠肿瘤发生的主要介质
PLS-DA图的得分图
显示
正常组、模型组和Rh4组之间存在明显的分离
(图5A)。
Rh4和Rh4_FMT显著调节的代谢物主要与BA相关
(图5B-C)。
KEGG富集分析,表明
Rh4和Rh4_FMT调节的主要途径是胆汁酸生物合成途径
(图5D-E)。
Rh4和Rh4_FMT显著上调UDCA,同时下调有害的CA
(图5F-H)。
A. muciniphila与UDCA表现出很强的正相关性
(图5I)。















