在了解了卵母细胞3'末端核苷酸的修饰情况之后,为了研究TUT4/7介导的尿苷化在卵母细胞发育过程中的生理功能,研究人员构建了TUT4 fl和TUT7 fl小鼠,并通过与Zp3-cre工具鼠交配繁殖得到TUT4fl/fl;TUT7fl/fl;Zp3-creTg+,作为下文中的实验组TUT4/7cKO,其能够在次级卵泡阶段敲除目的基因4,而交配繁殖得到的TUT4fl/fl;TUT7fl/fl作为下文中的对照组TUT4/7CTL。这与一般大家研究母源因子在卵母细胞发育及早期胚胎发育过程中功能机制的思路是一致的。研究人员通过繁殖率检测发现TUT4/7cKO条件性敲除的小鼠不育(图4a),但是能排出正常数量的卵母细胞(图4b),只是SN型卵的比率下降(图4c)。为了研究突变的卵母细胞发生缺陷的原因,研究人员对TUT4/7 CTL和TUT4/7 cKO母鼠注射激素超排后与野生型公鼠合笼,输卵管冲出合子,体外培养观察附植前胚胎发育情况。TUT4/7 CTL能够发育到囊胚,TUT4/7 cKO发育不能超过2-细胞胚胎阶段(图4d)。这样的表型可能是卵母细胞第一次减数分裂异常,产生了异常的MII期卵母细,也可能是第一次减数分裂正常,但产生的MII期卵母细胞无法支撑受精的完成。为了确定缺陷发生的阶段,研究人员对TUT4/7 CTL和TUT4/7 cKO母鼠注射激素,从卵巢卵泡中分离GV期卵母细胞,体外培养后进行免疫荧光染色,观察表型。研究人员观察到卵母细胞不能正常完成第一次减数分裂,其异常表型包括纺锤体形态异常伴随着星状体形状的微管,第一次减数分裂末期阻滞,异常的MII期卵母细胞伴随着染色分散在纺锤体周边(图4e),如图4所示:
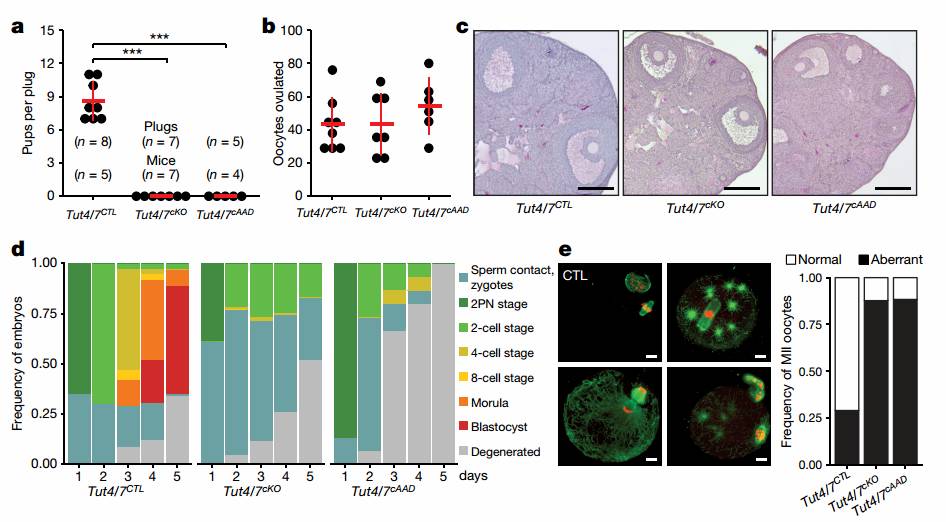
图4 TUT4/7 cKO不育及卵母细胞缺陷
因为作者目的是研究尿苷化这种修饰对卵母细胞发育的作用,所以下一步作者则想探究TUT4和 TUT7的尿苷化转移酶酶活性是否是出现上述表型的重要原因。研究人员利用了Tut4/7cAAD小鼠。本小鼠是基于TUT4催化三联体的突变(DDD to AAD ),这样可以使TUT4的催化活性失活,以此构建了一个TUT4AAD的转基因老鼠,然后交配得到TUT 4fl/AAD;Tut7 fl/fl;Zp3-cre Tg+ ,作为实验组Tut4/7cAAD 小鼠,这样的小鼠在卵母细胞发育过程中仅能表达单拷贝失活的TUT4 蛋白。因为具有单拷贝剂量正常TUT4蛋白的表达就能使卵母细胞发育正常,用这个小鼠就能来检验是否是尿苷化转移酶活性的消失导致的研究人员发现的表型。如图4所示,Tut4/7cAAD与TUT4/7 cKO表型一致。那么到这里我们可以说研究人员验证了TUT4/7的尿苷化转移酶活性对于卵母细胞完成第一次减数分裂,产生具有功能的MII起卵母细胞至关重要。
为了探究TUT4/7条件性敲除的表型与母源转录组缺陷之间的关系,组学分析必不可少。研究人员对TUT4/7CTL和TUT4/7cKO小鼠的GV期卵母细胞进行了转录组测序,分析了实验组和对照组差异表达的基因(图5a)。为了进一步研究差异表达的基因与卵子发生的关系,研究人员对得到在卵子发生过程中TUT4/7缺失导致的上调基因进行基因富集分析,找到在卵子发生过程中下调或上调表达的基因(图5b)。所以说,TUT4/7,特别是它们尿苷化活性参与到了卵母细胞发育过程转录本的降解过程中。本质上,他们促进了功能性母源转录组的形成。下一步研究人员想探究为什么一部分特定的转录本在卵母细胞发育过程中受到TUT4/7介导的尿苷化的调控。为了这一目的,研究对人员TUT4/7cKO 及TUT4/7CTL的GV期卵母细胞进行TAIL-seq,分析TUT4/7介导上调基因和未变化基因的末端poly(A)及3'末端核苷酸修饰情况。TUT4/7缺失后,上调的基因具有短的poly(A)尾巴的比例上升,表明降解转录本失败后导致短的poly(A)尾巴转录本的聚集(图5c)。相比于对照组,TUT4/7缺失后,表达上升的转录本没有发现寡聚尿苷化(图5d)。具有短的poly(A)尾巴的转录本寡聚尿苷化和单尿苷化的高比例也是完全依赖于TUT4/7的功能的,在(图5e)中TUT4/7cKO相比于TUT4/7CTL比例下降。所以在GV期卵母细胞中,敲除TUT4/7后,由其介导的寡聚尿苷化的消失导致了短poly(A)尾巴转录本的聚集。具体如图5所示。
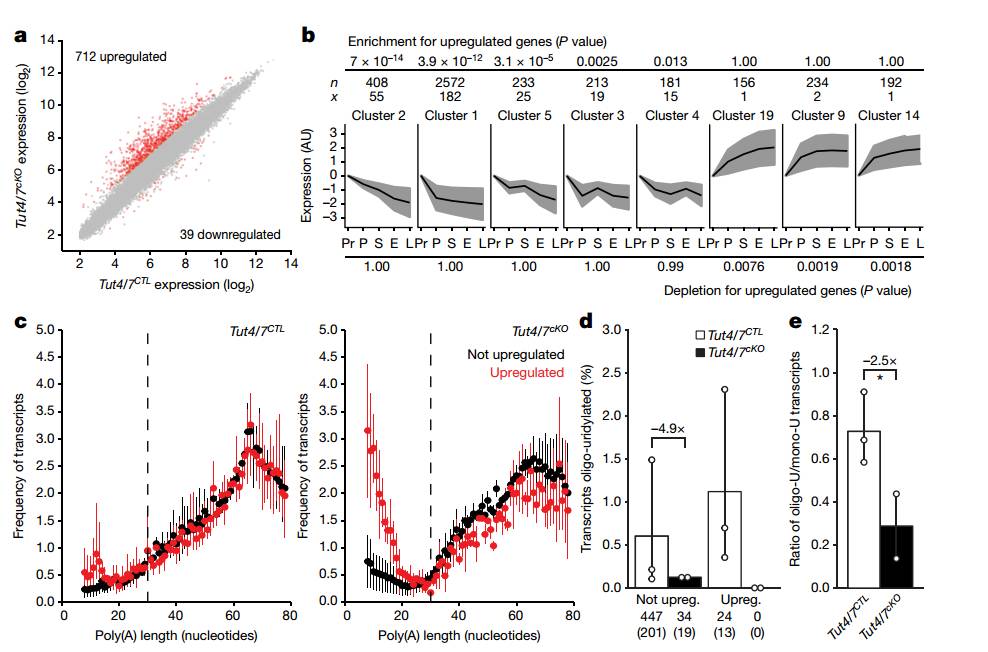
图5 poly(A)尾巴长度和TUT4/7介导的多聚尿苷化降解母源转录本














