circRNA自逆袭科研界后,又搞出了个大新闻,不仅傍上了蛋白质,更意欲与mRNA一争高下。其实,敏锐的科研者早就通过一些蛛丝马迹(体外实验和零星报道)知晓了circRNA的勃勃野心,只不过还没有在高等模式生物中找到circRNA跨界横扫蛋白质翻译的实质性证据。
但不甘平庸的circRNA为了怒刷存在感,大显身手后又一次搅乱了蛋白翻译的一池湖水,并成功地霸占了Cell Research & Molecular Cell杂志的头版头条。
3月10日,中科院上海计算生物学研究所王泽峰教授在Cell Research发表的一篇的研究文章
首次证明了circRNA存在m6A修饰(在RNA分子的A碱基的第六位N元素上加上一个甲基基团),且修饰后的circRNA可进行蛋白翻译。
而这篇里程碑式的论文不仅填补了circRNA化学修饰方式研究的空白,也拓展了circRNA的功能,为其后续研究提供了一种新的见解和思路。

通常线性mRNA翻译蛋白依赖于5’端帽状结构,但在应激情况下,有些mRNA也可不依赖帽结构而通过一个内部核糖体进入位点(internal ribosome entry site,IRES)顺势调控元件从mRNA的中间启动翻译。早期研究曾报道过circRNA存在IRES元件并具有翻译蛋白的功能。而王教授在验证该现象时,却又发现了另一奇怪的现象:对照序列(不含IRES元件)也能进行翻译!
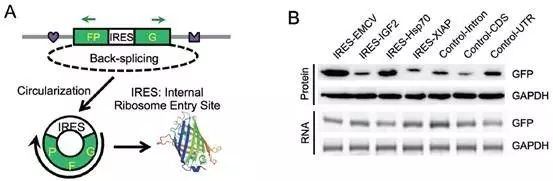
但在经过序列分析和MeRIP-seq后发现,对照序列的起始位点(AUG)附近存在着m6A修饰基序——RRACH序列(R=G or A;H=A,C or U),且相比于线性mRNA,circRNA携带了更多的m6A修饰识别序列;而一旦将这些基序的关键位点进行突变后,GFP翻译活动就会受到严重影响,甚至完全消失。另外,m6A修饰水平的高低也可影响着circRNA的翻译效率。
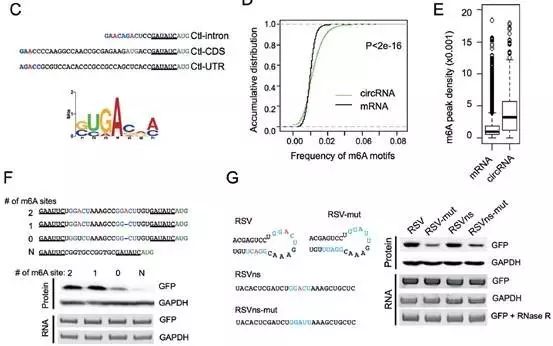
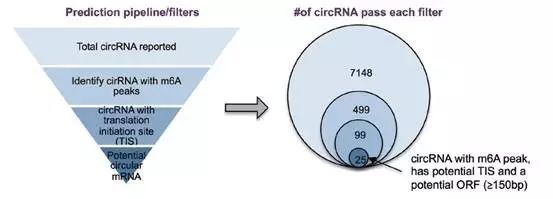
同时,基于二代测序实验(circRNA-m6A-seq),计算机预测和质谱数据库分析比对,研究者还发现细胞内13% circRNA的确存在m6A修饰且处于多核糖体结合状态,并推测内源性circRNA翻译蛋白可能普遍存在。此外,
基于数据库比对结果,该研究也鉴定出一些由circRNA编码的新肽段。
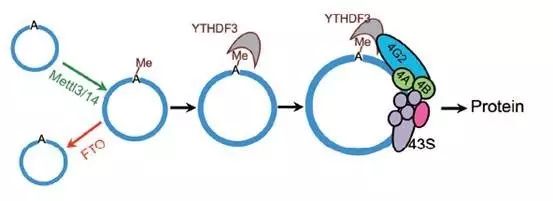
在深入研究其背后机制时发现,
circRNA可通过METTL3/METTL14复合物进行m6A修饰,并通过FTO进行m6A去修饰。
而含有m6A修饰位点的circRNA可通过募集YTHDF3蛋白来招募eIF4G2蛋白和其他翻译起始因子,进而启动蛋白翻译过程。
无独有偶,Molecular Cell杂志于3月15、16日连续发表了两篇有关circRNA研究的重磅文章,并为其蛋白翻译功能进行背书。其中一篇文章
主要介绍了参与肌肉发生过程中的circ-ZNF609,可直接翻译蛋白,其侧重点在于阐述功能性circRNA筛选模式和其翻译蛋白研究的技术思路,对其背后相关机制和理论并没有详细描述。

本文的出发点是分析肌肉发生有关的circRNA,因而从前期高通量筛选到敲降功能实验验证,都是很寻常的路线。研究者先对人和小鼠的成肌细胞(GM)以及分化为肌小管的细胞(DM)进行高通量测序及生物信息学分析,并对成肌分化过程以及疾病状态中circRNA的表达状态进行比较,进而筛选出一批具有显著性差异的circRNA。
而
后基于保守性(conservation)、表达丰度(expression level)、分化过程中有调控作用(modulation during differentiation)、环化/线性比值(cir-cular/linear ratio)四个原则,研究者们筛选出了31个候选circRNAs
,并通过后续RT-PCR实验、RNAi干扰实验、脱嗅氧尿苷(Brdu)标记实验等功能验证性实验确定了circ-ZNF609可调控成肌细胞的增殖。
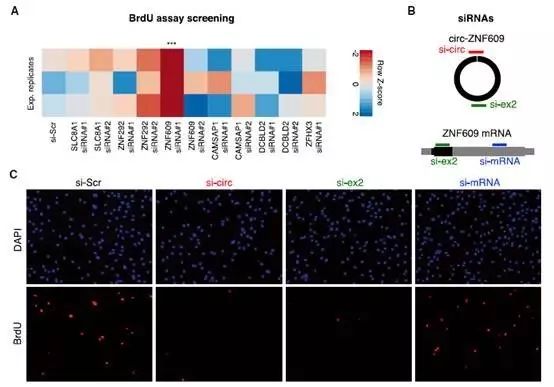
深入分析后发现,
circ-ZNF609是由 ZNF609基因的第二外显子独自环化形成。
而令人意外的是,该区域包含了753nt的开放阅读框(ORF),且核糖体结合的蔗糖密度梯度实验也表明circ-ZNF609上确有多聚核糖体结合,由此推断circ-ZNF609可编码蛋白。
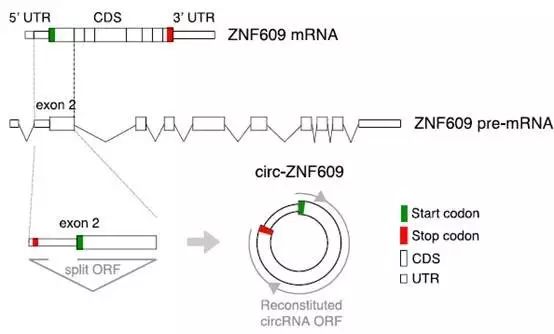
接下来为了验证circ-RNA的蛋白翻译功能时,研究者们主要考虑了以下四点:
1.预测阅读框,看阅读框与环化位点的关系,阅读框上游是否有调控性元件(IRES,m6A修饰保守位点等);
2.过表达和突变实验:充分论证各个调控序列和位点的功能;
3.通过转基因技术增加标签或直接制备特异性抗体验证内源性circRNA的翻译功能,并检测其翻译的蛋白产物;
4.分析目标circRNA募集和结合核糖体的能力:蔗糖密度梯度离心,嘌呤霉素处理等。
依据此,他们证明了内源性circ-ZNF609是在IRES驱动下以剪切依赖模式进行蛋白翻译活动,但其蛋白翻译效率比线性的RNA几乎低了两个数量级。
而另外一篇文章则
主要探讨了环状RNA直接翻译多肽的情况
,研究者为了寻找具有编码潜能的circRNA,一方面搜索横跨反向剪接位点的开放式阅读框(ORF),一方面搜索已经发表的核糖体印迹数据库(ribosome footprinting datasets,RFP) ,希望能发现与核糖体相关的circRNA。

文章作者先对果蝇的大脑组织进行核糖体印迹分析,寻找到了一些能结合到核糖体的circRNA(Ribo-circRNA),并认为其有可能具有翻译蛋白的功能;而后通过构建带V5标签的过表达circRNA载体来验证其能否表达相应蛋白。
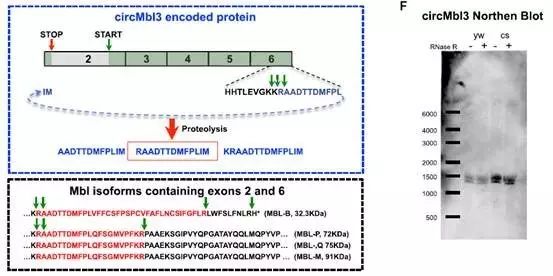
同时研究者也在分析了circRNA可能翻译的蛋白序列后,进行相应的肽段的体外合成并做出了质谱的标准图谱。最终在胞内产物的质谱数据中确定了circMbl3(由Mbl基因的外显子2-6环化形成)所翻译的肽段可在标准图谱中找到直接的质谱证据。
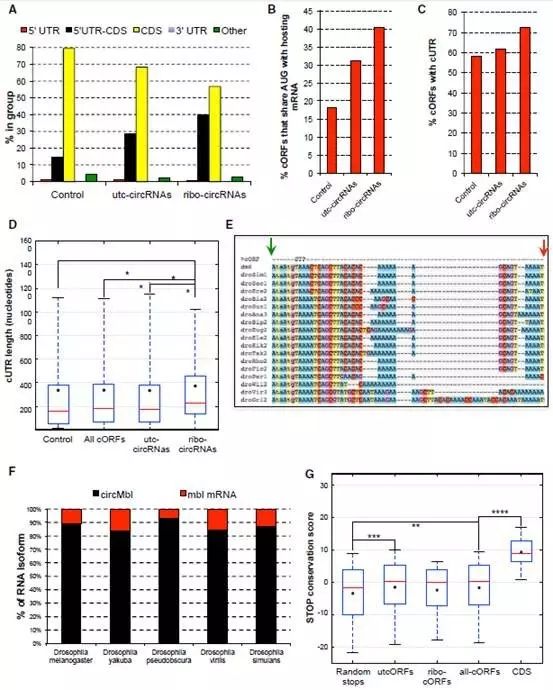
此外,研究者对具备编码多肽能力的circRNA的具体特征也进行了阐释。
他们分析了果蝇151个核糖体结合的circRNA的5’UTR区,发现约72%的可翻译circRNA具有预测阅读框上游序列,而约40%的可翻译circRNA与所对应的线性RNA共用相同的起始密码子。
而且相对于其他circRNA,可翻译circRNA进化上更保守,长度更长并以此来提供满足蛋白翻译调控序列的空间。
参考文献:1.Extensive translation of circular RNAs driven by N6-methyladenosine
2.Circ-ZNF609 Is a Circular RNA that Can Be Translated and Functions in Myogenesis
3.Translation of CircRNAs





