点击图片免费报名 2025 IBI EXPO
2024年11月29日
医麦客新闻 eMedClub News
近年来,随着越来越多的嵌合抗原受体T细胞(CAR-T)治疗药物在国内外获批上市,更多的企业和投资人都开始将目光聚焦到细胞治疗领域。尽管,CAR-T疗法已在一些如白血病、淋巴瘤等的非实体瘤中展现了显著的疗效,但是肿瘤复发始终是让CAR-T疗法有局限性的一个关键因素。受限于低抗原肿瘤的免疫逃逸和细胞持久性不足,如何提高CAR-T疗法的细胞免疫力成为了一个亟待解决的问题。
与T细胞受体(TCR)相比,CAR形成的免疫突触(Immunological synapse, IS)结构杂乱无章,膜近端信号传递效率低下,导致CAR对抗原的敏感性降低。这也使得CAR-T细胞无法清除抗原表达水平低的靶细胞,并且容易功能耗竭,难以维持长期的疗效。找到方法优化CAR的信号转导功能是突破当前CAR-T细胞治疗局限性的关键所在。
2024年11月27日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)许琛琦研究组联合上海科技大学王皞鹏研究组在Immunity杂志在线发表了题为Phase Separation of Chimeric Antigen Receptor Promotes Immunological Synapse Maturation and Persistent Cytotoxicity的研究论文。该研究在传统二代E28Z CAR-T细胞内段引入TCR中的CD3ε元件,同时对CD3ε进行了序列优化,提高E-CAR在细胞膜上的稳定性形成了EB6I28Z CAR-T细胞。与普通的CAR-T细胞相比,改良后的EB6I28Z CAR-T细胞具有更高的抗原敏感性,以及更好的持久性。并且在初发肿瘤和复发肿瘤的动物模型中,均展示出了更好的抗肿瘤功能。当前,E-CAR已进入临床试验阶段,展示了很好的应用前景。▲ 可相分离E-CAR促进T细胞免疫突触成熟,从而提高抗原敏感性和细胞长效性
尽管,仍没有研究可以解答为什么TCR在IS形成方面优于CAR。不过,TCR作为最复杂的膜受体之一,主要是由抗原识别亚基TCRαβ和信号传递亚基CD3εδ、CD3εγ、CD3ζζ组成。其中TCRαβ负责识别抗原,而其余CD3链则介导信号传递。然而,CAR仅利用CD3ζ的胞内域,因此错过了具有复杂功能的其他CD3元件。CD3ε作为TCR的关键调控亚基,包含碱性氨基酸富集区(BRS)、脯氨酸富集区(PRS)、免疫受体酪氨酸激活基序(ITAM)和RK基序,可与酸性磷脂、Lck、Csk、p85、Nck和Numb等多种分子相互作用。由此,许琛琦团队前期研究发现,T细胞静息时,BRS与酸性磷脂静电作用屏蔽CD3e胞内区,防止过强信号。抗原刺激后,钙离子大量内流,释放CD3e胞内区,与LCK静电作用促进TCR磷酸化及LCK活化。磷酸化CD3e招募CSK抑制LCK,使信号回归基线。

进而,许琛琦团队在二代E28Z CAR-T(E-CAR 1.0)细胞的基础上,增加了CD3e结构,形成了功能上更加模拟TCR的第一代28Z CAR-T细胞的EB6I28Z CAR-T(E-CAR 2.0)细胞。由于CD3e的碱性氨基酸和其它信号区上的酪氨酸所带的pi电子形成的cation-pi相互作用,所以28Z CAR-T的胞内信号区可以自行形成液液相分离。在细胞水平,E-CAR 1.0更易于在细胞表面聚集,然而E-CAR在膜上的表达水平比传统CAR低。因此,团队通过蛋白序列优化,保留了其相分离所需的碱性氨基酸,并有效地提高了膜表达水平。

▲ 28Z CAR, E-CAR 1.0, E-CAR 2.0模式图
团队进一步探究了EB6I28Z CAR-T细胞的功能特性,发现其对弱抗原肿瘤细胞的结合与杀伤能力均显著增强。为了更直观地评估EB6I28Z CAR-T细胞的实际效用,研究团队构建了一个肿瘤细胞反复刺激的模型。结果显示,EB6I28Z CAR-T细胞展现出更持久的杀伤效果,不仅能有效清除肿瘤细胞,同时还能维持自身的增殖能力。通过RNA测序分析,研究团队揭示了EB6I28Z CAR-T细胞利用CD2信号来缓解功能耗竭的机制,这与它们能诱导形成CD2花冠结构,招募PI3K这些信号分子来介导共刺激信号的观察结果相一致。在动物模型中,无论是初发肿瘤模型(包括血液瘤和实体瘤)还是血液瘤复发模型中,EB6I28Z CAR-T细胞相较于传统细胞,均展现出了更为优异的抗肿瘤效果。综上所述,许琛琦团队通过蛋白序列优化,成功构建了一种新型的可相分离的EB6I28Z CAR-T细胞。提升了CAR-T细胞形成的SI质量,进而提高了抗原敏感性和持久性,同时在动物模型中也展示出了良好的治疗效果。随着对CAR相分离机制的深入理解和工程技术的不断进步,未来有望开发出更高效、更持久的CAR-T细胞疗法,为癌症治疗带来革命性的突破。
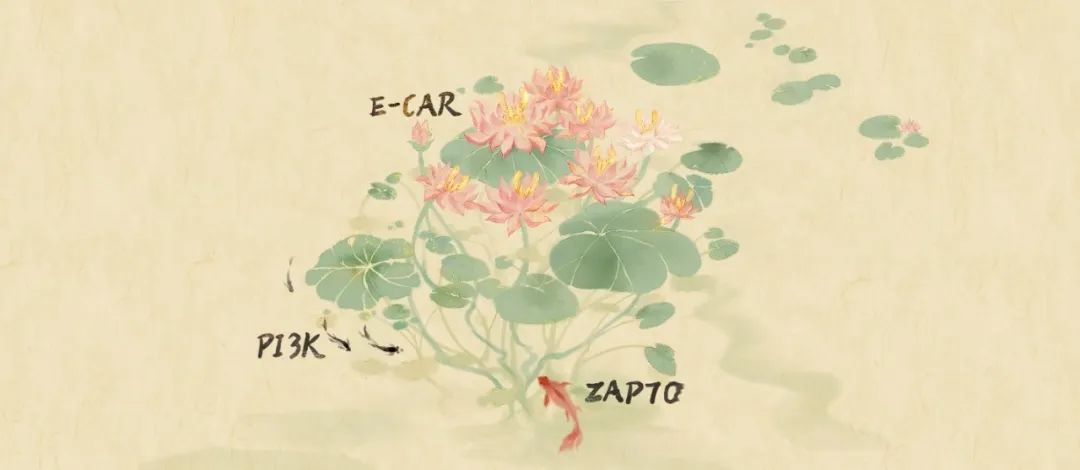
▲E-CAR胞内段相分离就像睡莲的根茎交错缠绕,吸引来的各种小鱼意味着成熟的免疫突触招募了各类下游信号分子,介导T细胞的免疫应答反应。
分子细胞卓越中心许琛琦研究员和上海科技大学生命科学与技术学院王皞鹏研究员为该论文的共同通讯作者。分子细胞卓越中心博士研究生徐心怡,上海科技大学与分子细胞卓越中心联合培养硕士研究生陈昊天,分子细胞卓越中心博士研究生任正旭,国科大杭州高等研究院硕士研究生徐晓敏为该论文共同第一作者。该研究获国家自然科学基金委、科技部重点研发计划、中国科学院青年团队、上海市科委等项目资助。该研究得到分子细胞卓越中心动物实验技术平台、细胞分析技术平台和分子生物学技术平台的大力支持。
参考资料:
1.https://www.cell.com/immunity/abstract/S1074-7613(24)00520-X
2.https://mp.weixin.qq.com/s/JPPqhBw37I3rrSj0N3OM7Q3.https://mp.weixin.qq.com/s/DO26huryI2u93cGngAjnFg
欢迎大家报名参加2025 IBI EXPO大会,与时代同行。如下为2024 IBI EXPO大会现场视频集锦。
IBI EXPO 2025(第三届)生物创新药产业大会将于2025年3月1日至3月2日在苏州国际博览中心盛大举办。大会主题为协同共筑全链条,创新转化新生态。
大会将邀请300+演讲嘉宾,开设30+场论坛活动,涵盖上百个热门话题,围绕细胞与基因治疗、放射性药物、抗体创新偶联、靶向蛋白降解、干细胞再生、mRNA疫苗与核酸药物、外泌体等新分子药物,人工智能药物发现、类器官、新型递送载体等前沿技术,展开交流探讨,联动药企、科研院校、临床资源、供应链企业、投融资机构、园区政府等多方力量,推动前沿创新从科研向产业转化,为生物创新药市场注入发展源泉。
免费参会:杨老师 15517201185
免费参展:袁老师 15572286596
演讲&媒体:王老师 18717836231
12月19日(周四) 19:00-20:00
细胞治疗快速工艺开发
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:欢迎个人转发文章至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。如需转载请在文章下方留言获取授权。


点点“分享”、“点赞”和“在看”,给我充点儿电吧~





