Dennis J. Slamon, Patrick Neven, Stephen Chia, Peter A. Fasching, Michelino De Laurentiis, Seock-Ah Im, Katarina Petrakova, Giulia Val Bianchi, Francisco J. Esteva, Miguel Martın, Arnd Nusch, Gabe S. Sonke, Luis De la Cruz-Merino, J. Thaddeus Beck, Xavier Pivot, Gena Vidam, Yingbo Wang, Karen Rodriguez Lorenc, Michelle Miller, TetianaTaran, Guy Jerusalem
翻译:
雷蕾
浙江省肿瘤医院
审校:
陈占红
浙江省肿瘤医院
点评
MONALEESA-3 研究给临床带来的思考
点评专家:
佟仲生
天津医科大学肿瘤医院
如果将
2016
年作为
CDK4/6
抑制剂的元年,
2017
年当是
CDK4/6
抑制剂开花结果之年,而
2018
年
8
月
JCO
全文发表的
MONALEESA-3
临床研究,更呈现出
CDK4/6
抑制剂的浓墨重彩、后劲十足。
MONALEESA-3
临床研究主要评价
CDK4/6
抑制剂
ribociclib
联合氟维司群针对一线及二线内分泌治疗
HR
阳性
/HER2
阴性绝经后晚期乳腺癌的临床疗效。
全组
726
例患者,按
2:1
比例随机进入联合治疗组(
ribociclib
联合氟维司群)
484
例,对照组(安慰剂联合氟维司群)
242
例。
主要研究终点
PFS
,次要终点
OS
、
ORR
、
CBR
及安全指标。
中位随访
20.4
个月的结果显示,联合治疗组
20.5
个月(
95%
置信区间
[confifidence interval, CI]
,
18.5-23.5
个月)较对照组
12.8
个月(
95% CI
,
10.9-16.3
个月)的中位
PFS
明显延长,亚组分析可见无论对既往未接受内分泌治疗或一线内分泌治疗进展后患者,联合治疗组均占优。
联合治疗组与对照组的
ORR
分别为
40.9%
、
28.7%
,前者占优。
联合治疗组的不良反应以中性粒细胞减少最常见,超过
10%
出现
3
级不良事件患者中,联合治疗组明显比对照组的中性粒细胞减少(
46.6%
v
0%
)比例增多。
值得注意的是联合治疗组与对照组相比,
QT
间期延长占比较多(
6.2%
v
0.8%
)、联合治疗组出现
2
例
Hy' s
定律,与
ribociclib
和或氟维司群相关。
MONALEESA-3
研究给临床带来更多的思考,其一:
本项研究的临床设计与其他试验设计不同。从入组患者来看,既包括严格意义上的一线内分泌治疗患者,同时也包含内分泌治疗进展后的二线内分泌治疗患者,从两组临床特征看,一线内分泌治疗和二线内分泌及早期复发患者比例接近
1
:
1
,在足够入组人数的前提下,试验设计大胆缜密,意在解决总人群、一线及二线内分泌治疗联合治疗组的临床疗效。
最终达到了阳性结果,即总人群中,
ribociclib
联合治疗组比对照组的中位
PFS
延长了
7.7
个月。
从亚组分析的森林图看,无论是年龄、肝或肺转移、转移灶多少、既往是否接受他莫昔芬或
AI
,均能看到有利于
ribociclib
联合氟维司群组的阳性结果。
既表明
ribociclib
联合氟维司群为绝经后
HR
阳性
/HER2
阴性晚期乳腺癌患者内分泌治疗的首选方案的结论,同时也间接证实与其他两个
CDK4/6
抑制剂联合内分泌治疗对一线及二线内分泌治疗的一致性。
其二:在
FALCON
研究中氟维司群一线内分泌治疗的中位
PFS16.6
个月,明显好于
AI
,但尚存疑惑,本试验对照组的单药氟维司群在一线和二线各占
53.3%
及
45%
的情形下中位
PFS
达到
12.8
个月的结果,还是再次能够证实氟维司群在绝经后
HR
阳性
/HER2
阴性晚期乳腺癌一线及二线内分泌治疗的合理地位。
同时也意味着氟维司群挑战
AI
类药物作为
HR
阳性
/HER2
阴性晚期乳腺癌一线优选单药治疗,增加了新的证据。
其三:既往含有
CDK4/6
抑制剂内分泌治疗的研究中,其安全性一直令临床医生所关注。
本项研究不能忽视
ribociclib
的安全性问题。
与其他
CDK4/6
抑制剂相似,
ribociclib
仍以血液学毒性为主,与对照组相比,联合治疗组的中性粒细胞减少近
50%
,同时有一定的
QT
间期延长及肝毒性,须引起临床医生的足够的重视。
HR
阳性
/HER2
阴性晚期乳腺癌内分泌治疗从单药的
TAM
、
AI
到氟维司群,正在快步迈向靶向联合内分泌治疗的时代。
这是一种变革也是一种进步,从
MONALEESA-3
研究的成功进一步奠定了
CDK4/6
抑制剂在
HR
阳性
/HER2
阴性晚期乳腺癌治疗中的地位,为绝经后
HR
阳性
/HER2
阴性晚期乳腺癌患者提供了更多的治疗选择。
当然未来可期的是靶向联合内分泌在新辅助治疗、辅助治疗领域取得更大的突破。
摘要
目的
此项
III
期临床研究评估
ribociclib
联合氟维司群对于晚期初治或先前接受过至多一线内分泌治疗的激素受体阳性
/
人体表皮生长因子受体
2
阴性晚期乳腺癌患者的疗效。
患者与方法
患者以
2
:
1
比例随机分配至
ribociclib
联合氟维司群组或安慰剂联合氟维司群组。主要研究终点是各医院本地评估无进展生存期,次要研究终点包括总生存期、总缓解率和安全性。
结果
共有
484
例绝经后女性患者随机分配到
ribociclib
联合氟维司群治疗组,
242
例患者被分配到安慰剂联合氟维司群组。
ribociclib
联合氟维司群组患者的中位无进展生存期较安慰剂联合氟维司群组有明显改善:分别为
20.5
个月(
95%
置信区间
[confifidence interval, CI]
,
18.5-23.5
个月)
vs. 12.8
个月(
95% CI
,
10.9-16.3
个月)(风险比:
0.593
;
95% CI
,
0.480-0.732
;
P<
0.001
)。晚期初治或者先前接受过至多一线内分泌治疗的患者均能从持续性治疗获益,风险比分别为
0.577
(
95%CI
,
0.415-0.802
)和
0.565
(
95%CI
,
0.428-0.744
)。具有可测量病灶的患者中,
ribociclib
联合氟维司群组患者的总缓解率为
40.9%
,安慰剂联合氟维司群组为
28.7%
。两组患者中
3
级不良事件(发生于
≥ 10%
的患者)(
ribociclib
联合氟维司群
vs.
安慰剂联合氟维司群)为中性粒细胞减少症(
46.6% vs. 0%
)和白细胞减少症(
13.5% vs. 0%
);唯一的
4
级不良事件(发生于
≥ 5%
的患者)是中性粒细胞减少症(
6.8% vs. 0%
)。
结论
Ribociclib
联合氟维司群治疗可成为激素受体阳性
/
人体表皮生长因子受体
2
阴性晚期乳腺癌患者的一线或二线治疗新选择。J Clin Oncol 36:2465-2472. © 2018 by American Society of Clinical Oncology
前言
细胞周期蛋白
D-
细胞周期蛋白依赖性激酶(
cyclindependent kinase, CDK
)
4/6-
视网膜母细胞瘤通路失调在激素受体(
hormonal receptor, HR
)阳性乳腺癌较常见
[1]
,且与内分泌单药治疗耐药有关
[2]
。
临床前研究结果表明
CDK4/6
靶向药物能够抑制
HR
阳性乳腺癌细胞系生长,可能与激素阻滞剂协同作用于这种分子亚型的乳腺癌。
Ribociclib
是一种口服生物活性、高度选择性小分子
CDK4/6
抑制剂,单药或联合来曲唑或联合氟维司群使用对
HR
阳性乳腺肿瘤移植模型具有抗肿瘤活性
[
4,
5
]
。
III
期
MONALEESA-2
研究显示
ribociclib
联合来曲唑较安慰剂联合来曲唑明显延长没有接受一线治疗的绝经后
HR
阳性
/
人体表皮生长因子受体
2
(
human epidermal growth factor receptor 2, HER2
)阴性晚期乳腺癌患者的无进展生存期(
progression-free survival, PFS
)。
III
期
MONALEESA-7
研究显示
ribociclib
联合内分泌治疗(他莫昔芬或非甾体类芳香化酶抑制剂联合戈舍瑞林)较安慰剂联合内分泌治疗还能显著延长接受一线治疗的绝经前
HR
阳性
/HER2
阴性晚期乳腺癌患者的
PFS
[7]
。
CDK4/6
抑制剂联合氟维司群已被证实对先前内分泌治疗后进展的
HR
阳性乳腺癌患者有效
[
8-10
]
。
但是,目前没有临床研究评估
ribociclib
联合氟维司群治疗
HR
阳性
/HER2
阴性晚期乳腺癌或
CDK4/6
抑制剂联合氟维司群治疗初治晚期
HR
阳性
/HER2
阴性乳腺癌或先前内分泌治疗结束
>12
个月后确诊复发的
HR
阳性
/HER2
阴性晚期乳腺癌。
本文公布了
MONALEESA-3
试验的研究结果,该研究评估了
ribociclib
联合氟维司群联合方案对晚期初治或先前接受过至多一线内分泌治疗
HR
阳性
/HER2
阴性晚期乳腺癌的疗效。
患者和方法
研究设计
这项
III
期、双盲、安慰剂对照国际合作研究,以
2
:
1
比例随机分配患者接受
ribociclib
(
600mg/d
口服;
用药
3
周,停药
1
周停药)联合氟维司群(
500 mg
,每
28
天一周期,周期的第
1
天肌内注射;
首个周期的第
15
天多予一剂)或安慰剂联合氟维司群。
随机分配时根据患者是否存在肺转移或肝转移、先前是否接受过内分泌治疗(按患者所述晚期初治
vs.
针对晚期疾病接受过至多一线内分泌治疗的患者)进行分层。
治疗持续到发生疾病进展、无法耐受的毒性反应、死亡或因任何其他原因要求停药。可以因不良事件(
adverse evcnts, AEs
)调整剂量,包括中断给药和最多两次减少剂量。
不允许对氟维司群剂量进行调整。
所有患者均书面签署知情同意书。研究执行符合
GCP
原则和赫尔辛基宣言。
研究方案和涉及方案的调整均由每个研究中心的独立伦理委员会或机构审查委员会批准。由参加研究的国际研究者和诺华公司代表组成指导委员会对本研究进行监督。独立数据监查委员会评估安全性数据。
患者
经组织学和
/
或细胞学确诊
HR
阳性
/ HER2
阴性晚期乳腺癌的绝经后女性和男性均可入组。
晚期乳腺癌包括转移性或局部复发但不适合接受治愈性治疗的乳腺癌。其他入组标准:(
1
)晚期初诊、晚期乳腺癌;
(
2
)完成(新)辅助内分泌治疗
>12
个月后复发且没有针对晚期乳腺癌或转移癌进行治疗(第
1
、
2
条入组标准指癌症晚期未行治疗);
(
3
)(新)辅助内分泌治疗期间或结束后
12
个月内复发,且未治疗晚期或转移性疾病(早期复发);
(
4
)(新)辅助治疗后
>12
个月复发疾病进展后针对晚期或转移性疾病接受过一线内分泌治疗;
(
5
)疾病早期未进行过(新)辅助治疗,疾病进展后接受过一线内分泌治疗的晚期或转移性乳腺癌。
(第
3-5
条入组标准是指针对疾病进展至多接受过一线内分泌治疗)。
第
1
条和第
2
条入组标准包括接受一线治疗的患者;
第
3-5
条包括接受二线治疗或早期复发的患者。
所有患者具有至少一个符合实体肿瘤反应评估标准(
Response Evaluation Criteria In Solid Tumors , RECIST; 1.1
版)的可测量病灶
[11]
或一个以溶骨性病变为主的病灶,脏器和骨髓功能正常,美国东部肿瘤协作组(
Eastem Cooperative Oncology aroup, ECOG
)评分为
0
或
1
。
如果患者先前接受过化疗、氟维司群或
CDK4/6
抑制剂、炎性乳腺癌、有症状的内脏疾病或研究者判断患者的疾病负荷不适合接受内分泌治疗或患有显著的心律失常和
/
或不受控制的心脏病,包括根据
Fridericia
公式(
QTcF
)心率校正后
QT
间期
>450 ms
的情况均不适合入组。
研究过程
筛选期,以
RECIST
(
1.1
版)为标准完成本地受试者肿瘤反应的评估,随机分配后每
8
周
1
次,持续
18
个月后改为每
12
周评估
1
次,直至疾病进展或死亡或撤回知情同意或失访;
因任何其他原因而停止治疗的患者,按照方案继续进行评估。随机选择约
40%
的患者的影像数据交由盲态独立审查委员会(
blinded independent central review committee, BIRC
)集中审查。
根据不良事件常用术语标准(
4.03
版)对
AEs
进行监测和分级
[12]
。
在患者完成最后一次研究治疗剂量后进行至少
30
天的安全随访。
ECG
评估在筛选期,第
1
周期第
15
天、第
2
周期第
1
天和第
15
天、所有后续周期第
1
天直至第
6
周期、治疗结束时以及临床需要时。
第
7
周期之前任何时间出现
QTcF ≥ 481ms
的患者均需要在随后每个周期给药前的第
1
天以及每第
3
个周期给药后进行额外
ECG
检查。
主要和次要终点
主要研究终点是本地评估的
PFS
。
为了支持主要研究终点,
BIRC
以随机选择方式对部分患者的
PFS
进行中心评估。
次要研究终点包括总生存期(
Overall survival, OS
)、总缓解率(
Overall response rate, ORR
)、临床获益率以及安全性和耐受性。
数据分析
主要分析治疗组之间
PFS
的差异
,
采用分层对数秩检验方法。
总体及相关亚组的治疗效果运用
Cox
比例风险模型评估。
采用
Cox
比例风险模型分析支持主要疗效终点的中心
PFS
评估。
在观察到大约
364
个分中心研究者评估的
PFS
事件后进行主要
PFS
分析,预设风险比为
0.67
、检验效能为
95%
和单侧显著性水平界值为
2.5%
。
如果主要终点
PFS
有统计学意义,则使用分层对数秩检验单侧界值
2.5%
比较两组的
OS
。
使用了
three-look
设计,最多两次中期
OS
分析(第一次是在
PFS
分析时进行),并计划进行最终
OS
分析。
Lan-DeMets
α
-spending
函数及
O'Brien-Fleming
边 界 用 于 控 制 多 重 性。
使 用
Cochran-Mantel-Haenszel X
2 检验单侧界值为
2.5%
比较治疗组之间
ORR
和临床获益率的不同。
所有疗效分析均在全分析集进行,包括所有随机分配的患者。所有治疗组中,对接受过至少
1
剂研究治疗的患者进行至少一次基线后的安全性评估
。
结果
研究人群
和意向
2015
年
6
月
-2016
年
6
月期间,来自全球
30
个国家的
174
个研究中心共
726
例患者以
2
:
1
的比例随机入组临床研究:
ribociclib
联合氟维司群治疗组(
n=484
)和安慰剂
联合氟维司群对照组(
n=242
;
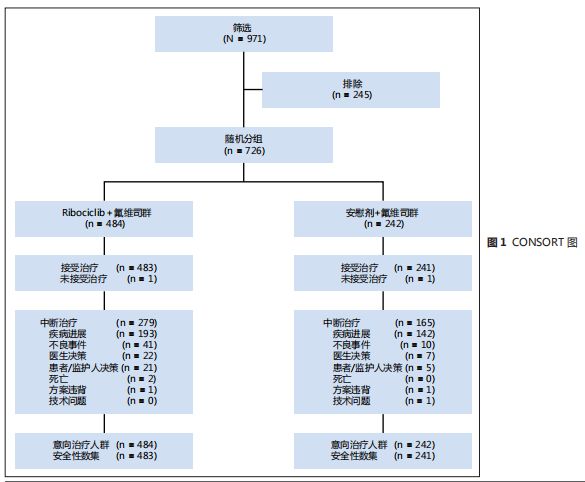
图
1
)。
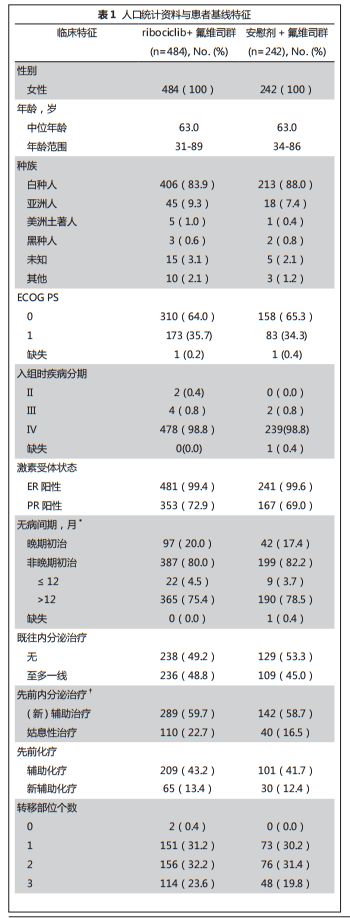
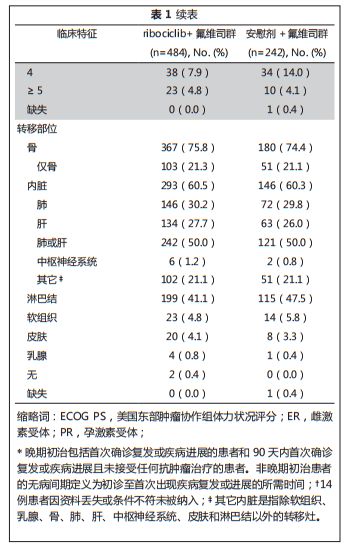
基线人口统计资料和疾病特征,两组均衡可比(表
1
)。
虽然男性患者在方案修订后符合纳入条件,但因完成入组速度较快而男性乳腺癌患者最终未能入组。从随机开始至停止入组的中位时间为
20.4
个月。
共
354
例晚期初治的乳腺癌患者和
372
例先前接受过至多一线内分泌治疗的晚期乳腺癌患者入组。
截止
2017
年
11
月
3
日,
ribociclib
联合氟维司群治疗组
42.1%
的患者和安慰剂联合氟维司群对照组
31.4%
的患者仍在接受治疗。两组(
ribociclib
联合氟维司群组
vs.
安慰剂联合氟维司群组)发生中断治疗最常见原因为疾病进展(
39.9% vs. 58.7%
)和
AEs
(
8.5% vs. 4.1%
)。
ribociclib
联合氟维司群组中位研究治疗暴露时间为
15.8
个月(范围为
0.9-27.4
个月);安慰剂联合氟维司群组为
12
个月(范围为
0.9-25.9
个月)。
ribociclib
和安慰剂的中位相对剂量强度分别为
92.1%
和
100%
。
 主要终点
至数据截止,共
210
个
PFS
事件在
ribociclib
联合氟维司群治疗组发生;
151
个在安慰剂联合氟维司群组发生。
ribociclib
联合氟维司群组较安慰剂联合氟维司群组患者的
PFS
明显延长,中位
PFS
分别为
20.5
个月(
95% CI, 18.5-23.5
个月)和
12.8
个月(
95% CI, 10.9-16.3
个月);
风险比为
0.593
(
95% CI, 0.480- 0.732;
P<
0.001
;图
2
)。
主要终点
至数据截止,共
210
个
PFS
事件在
ribociclib
联合氟维司群治疗组发生;
151
个在安慰剂联合氟维司群组发生。
ribociclib
联合氟维司群组较安慰剂联合氟维司群组患者的
PFS
明显延长,中位
PFS
分别为
20.5
个月(
95% CI, 18.5-23.5
个月)和
12.8
个月(
95% CI, 10.9-16.3
个月);
风险比为
0.593
(
95% CI, 0.480- 0.732;
P<
0.001
;图
2
)。
基于
BIRC
的
PFS
分析支持初步疗效结果。
40%
患者(
n=290
)随机分配至
BIRC
评估,
PFS
风险比为
0.49
(
95% CI
,
0.345-0.703
)。
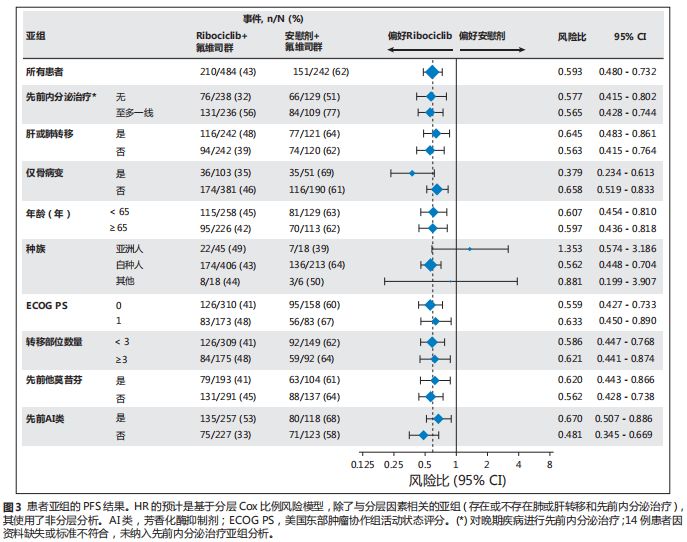
探索性分析证实在各项预设亚组患者也得到治疗有效的一致结论(图
3
)。
PFS
风险比在未经治疗和接受过至多一线内分泌治疗的晚期乳腺癌患者中分别为
0.577
(
95% CI
,
0.415-0.802
)和
0.565
(
95% CI
,
0.428-0.744
)。由于样本量小,事件数量有限,亚洲亚组患者的治疗效果风险比应谨慎解读。
次要终点
第一次计划的
OS
中期分析,数据尚不成熟(成熟度
34%
)。
ribociclib
联合氟维司群组中共观察到
70
例(
14.5%
)患者死亡,而安慰剂联合氟维司群组共有
50
例(
20.7%
),结果未超过预先指定的
O'Brien-Fleming
停止边界。
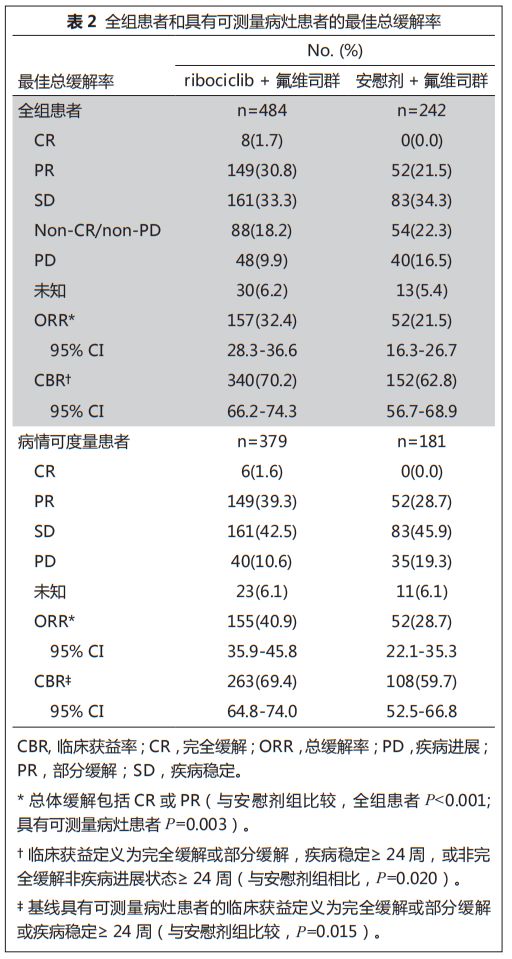
 全组患者中,
ribociclib
联合氟维司群组和安慰剂联合氟维司群组的
ORR
分别为
32.4%
(
95% CI
,
28.3%-36.6%
) 和
21.5%
(
95% CI
,
16.3%-26.7%
)(
P<
0.001
;表
2
);病情可度量患者中,
ribociclib
联合氟维司群组和安慰剂联合氟维司群组
ORR
分别为
40.9%
(
95% CI
,
35.9%-45.8%
) 和
28.7%
(
95% CI, 22.1%- 35.3%
),且
P=
0.003
。
全组患者中,
ribociclib
联合氟维司群组和安慰剂联合氟维司群组的
ORR
分别为
32.4%
(
95% CI
,
28.3%-36.6%
) 和
21.5%
(
95% CI
,
16.3%-26.7%
)(
P<
0.001
;表
2
);病情可度量患者中,
ribociclib
联合氟维司群组和安慰剂联合氟维司群组
ORR
分别为
40.9%
(
95% CI
,
35.9%-45.8%
) 和
28.7%
(
95% CI, 22.1%- 35.3%
),且
P=
0.003
。
纳入安全性研究的患者为
724
例。
两组均出现的最常见全级
AEs
(
≥ 30%
患者)包括中性粒细胞减少症、恶心以及疲劳(表
3
)。
最常见
3
级
AEs
(
≥ 10%
患者)为中性粒细胞减少症和白细胞减少症。
4
级
AEs
(
≥ 5%
患者)仅为中性粒细胞减少症。
ribociclib
联合氟维司群组患者发生粒细胞减少性发热的比例为
1.0%
,安慰剂联合氟维司群组为
0%
。
 接受
ribociclib
联合氟维司群治疗的患者
ECG QT
间期延长(任何级别)的发生率为
6.2%
,而接受安慰剂联合氟维司群治疗的患者为
0.8%
。
根据
ECG
的评估,
ribociclib
联合氟维司群组基线后心电图
QTcF
间期
>480 ms
的发生率为
5.6%
,安慰剂联合氟维司群组为
2.5%
;
其中
QTcF
间期
>500 ms
的发生率分别为
1.7%
和
0.4%
。
QTcF
间期从基线延长
>60 ms
的发生率分别为
6.5%
和
0.4%
。
ribociclib
联合氟维司群组和安慰剂联合氟维司群组因
QTcF
间期延长导致治疗中断的患者例数分别为
3
例 (
0.6%
)和
0
例。
无患者出现尖端扭转型心律失常。
接受
ribociclib
联合氟维司群治疗的患者
ECG QT
间期延长(任何级别)的发生率为
6.2%
,而接受安慰剂联合氟维司群治疗的患者为
0.8%
。
根据
ECG
的评估,
ribociclib
联合氟维司群组基线后心电图
QTcF
间期
>480 ms
的发生率为
5.6%
,安慰剂联合氟维司群组为
2.5%
;
其中
QTcF
间期
>500 ms
的发生率分别为
1.7%
和
0.4%
。
QTcF
间期从基线延长
>60 ms
的发生率分别为
6.5%
和
0.4%
。
ribociclib
联合氟维司群组和安慰剂联合氟维司群组因
QTcF
间期延长导致治疗中断的患者例数分别为
3
例 (
0.6%
)和
0
例。
无患者出现尖端扭转型心律失常。
ribociclib
联合氟维司群组发生
3
级或
4
级
ALT
升高的患者分别为
32
例(
6.6%
)和
9
例(
1.9%
),发生
3
级 或
4
级
AST
升高分别为
23
例(
4.8%
)和
6
例(
1.2%
)。安慰剂联合氟维司群组同时出现
3
级
ALT
和
AST
升高的患者分别为
1
例(
0.4%
)和
2
例(
0.8%
),无
4
级
ALT
或
AST
升高事件。
ribociclib
联合氟维司群组两例患者为
Hy's
定律确诊病例,停用
ribociclib
后肝酶恢复正常。
严重
AEs
在
ribociclib
联合氟维司群组和安慰剂联合氟维司群组中分别发生
138
例(
28.6%
)和
40
例(
16.6%
),其中
54
例(
11.2%
)和
6
例(
2.5%
)由研究药物引起。两组患者报告的最常见全级全因严重
AEs
(
≥ 1%
患者)(
ribociclib
联合氟维司群
vs.
安慰剂联合氟维司群)为肺炎(
1.9% vs. 0%
)和呼吸困难(
1.2%vs. 2.1%
)。
两组
ribociclib
或安慰剂的剂量减量分别发生
183
例 (
37.9%
)和
10
例(
4.1%
),其中
148
例
(30.6%)
和
9
例
(3.7%)
患者只经历
1
次剂量减少。
AEs
是导致剂量减量的最常见原因,因
AEs
报告在两组间至少减量
1
次的患者分别为





