白云山6月28日发布了一纸公告,称下属子公司广州白云山奇星药业有限公司(简称“奇星药业”)收到CFDA核准签发的华佗再造丸等75个品种的《药品补充申请批件》,奇星药业成为这75个品种的上市许可持有人(MAH)。
虽然从文字上看这只是普普通通的一则公告,但背后隐藏的却是75个品种在MAH制度下原地复活的凄美故事……为了让大家能更清楚知道发生了什么,先补充两点背景信息:
2015年12月31日,白云山发布公告称奇星药业所在厂区被纳入广州美术馆、广州科学馆建设政策性征拆范围,截至公告日收到拆迁补偿款20亿元。既然钱已到位,奇星药业自然也是基本完成广州美术馆项目厂区搬迁工作,工厂当然也是要停产了。
药品批准文号握在手里,有那么多人要养活,总不能一直停产吧?权益之计可能 是在停产前先开足马力储备一些货,一直到新厂房落成并获得GMP认证再复产,但因为药品有效期问题,备货显然不可能支撑这么久,所以奇星药业需要尽快想办法让这些眼看要冬眠的文号继续运作起来……
对于奇星药业的这种意外情况,CFDA其实在政策上是留了一条生路的。我们看一下SFDA在2013年发布的38号文件关于药品技术转移的最新规定。根据38号文,对于药品生产企业整体搬迁、兼并等情形涉及的药品技术转让有关事项,以下情形可以申请药品技术转让:
药品生产企业整体搬迁或被兼并后整体搬迁的,原址药品生产企业的药品生产技术可转让至新址药品生产企业。
兼并重组中药品生产企业一方持有另一方50%以上股权或股份的,或者双方均为同一企业控股50%以上股权或股份的药品生产企业,双方可进行药品技术转让。
以上两种情况,第1种是奇星药业最简单的解决方案,但是要停产断货,要等到新厂建立通过GMP认证才能复产,恐怕得等到猴年马月了…第2种是奇星药业最理想的解决方案,毕竟是在白云山集团的成员企业间转让,亲兄弟嘛,走完技术转移流程就复产……
但实际上,奇星药业共拥有75个品种,即便是白云山大家庭的兄弟姐妹愿意拉一把,完成全部品种的技术转移没有2年时间也是下不来的,而且一个个提交补充申请资料,费时费力,绝对是非常痛苦的一件事情。
38号文还规定了技术转移期限——“注射剂等无菌药品生产企业应在2014年12月31日前、其他类别药品生产企业应在2016年12月31日前按上述要求提出药品技术转让注册申请,逾期药品监督管理部门不予受理”。
也就是说,如果奇星药业在2016年12月31日前没有提出技术转移申请的话,这75个品种的批文恐怕要进入冬眠期,甚至活活憋死了……不幸中的万幸,奇星药业命好,赶上了国务院在2016年5月26日推行药品上市许可持有人(MAH)制度,而且广东被纳入了试点……
所谓MAH制度,是指将上市许可与生产许可分离,相互独立。只要成为一个品种的上市许可持有人,就可以将产品委托给不同的生产商生产,不过药品的安全性、有效性和质量可控性均由上市许可人对公众负责。
在《药品上市许可持有人制度试点方案》中,试点药品范围包括以下几种:
(一)本方案实施后批准上市的新药。具体包括:1.按照现行《药品注册管理办法》注册分类申报的化学药品第1~4类、第5类(仅限靶向制剂、缓释制剂、控释制剂),中药及天然药物第1~6类,治疗用生物制品第1类、第7类和生物类似药;2.化学药品注册分类改革实施后,按照新的化学药品注册分类(以下简称新注册分类)申报的化学药品第1~2类。
(二)按与原研药品质量和疗效一致的新标准批准上市的仿制药。具体包括:化学药品注册分类改革实施后,按照新注册分类申报的化学药品第3~4类。
(三)本方案实施前已批准上市的部分药品。具体包括:1.通过质量和疗效一致性评价的药品;2.试点行政区域内,药品生产企业整体搬迁或者被兼并后整体搬迁的,该企业持有药品批准文号的药品。
麻醉药品、精神药品、医疗用毒性药品、放射性药品、预防用生物制品、血液制品不纳入试点药品范围。
奇星药业的情况刚好也在MAH试点范围之内。在这种政策东风之下,奇星药业只要申请成为这75个药品的MAH,就可以委托其他符合条件的企业生产了,可以说是为奇星药业定制了一套完美的解决方案。
在MAH制度推出以后,CFDA在官网上先后进行了三轮解读,以帮助大家掌握相关政策。2016年12月28日,我国首个药品上市许可持有人试点品种“吉非替尼”落户山东;2017年4月,苹果酸奈诺沙星原料药及其胶囊剂成为我国首个创新药的药品上市许可持有人制度试点品种 ……
CFDA在2017年1月6日发布了一个《药品上市许可持有人试点品种申报情况 》的公告,统计了10个试点省份截至2016年12月25日的MAH试点品种申报情况,结果如下:
药品上市许可持有人试点品种申报情况表
(截至2016年12月25日)
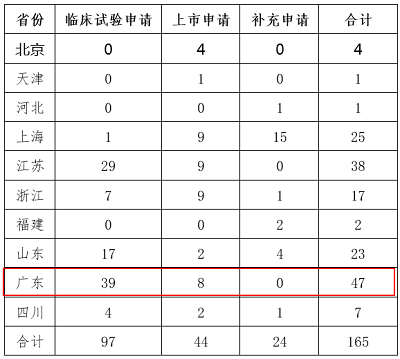
广东省补充申请的数量为0,说明奇星药业直到2016年12月25日还未递交MAH申请,但是到了2017年6月28日便获批成为MAH,说明省局和CFDA对于MAH申请给予了特快审评审批通道,效率极高,还降低了企业进行技术转移的成本。所以,小编看到白云山的公告之后只想说一句话:“MAH就是好哇,奇星药业的75个文号原地复活了~~”
既然奇星药业已经成为华佗再造丸等75个品种的MAH,理论上讲可以委托给任何符合条件的企业生产,那些产能富裕的企业,你们的机会来了喔。最后成人之美,把奇星药业的75个品种清单公布一下,大家各取所需。
奇星药业的75个中成药品种清单
来源:医药魔方数据库
药品名称(中文) | 首次上市年份 | 批准文号 |
百梅止咳颗粒 | 1999 | 国药准字Z19993177 |
板蓝根颗粒 | 1996 | 国药准字Z44020854 |
保儿安颗粒 | 1994 | 国药准字Z44022385 |
保婴散 | 1994 | 国药准字Z44020778 |
鼻咽清毒颗粒 | 1994 | 国药准字Z44022386 |
补血调经片 | 1994 | 国药准字Z44022788 |
丹七片 | 1994 | 国药准字Z44021391 |
风湿定胶囊 | 1994 | 国药准字Z44020779 |
风湿定片 | 1994
| 国药准字Z44020746 |
复方川贝母片 | 1996 | 国药准字Z44021392 |
复方丹参片 | 1996 | 国药准字Z44020934 |
复方感冒灵胶囊 | 2002 | 国药准字Z20026843 |
复方感冒灵片 | 2002 | 国药准字Z20023390 |
复方感冒灵片 | 1994 | 国药准字Z44022789 |
复方南板蓝根颗粒 | 1994 | 国药准字Z44020780 |
复方南板蓝根片 | 2002 | 国药准字Z20023015 |
复方蛇胆陈皮末 | 1994 | 国药准字Z44020747 |
复方蛇胆川贝散 | 1994 | 国药准字Z44023245 |
复方余甘子利咽含片 | 1996 | 国药准字B20020422 |
妇康宁片 | 1994 | 国药准字Z44020935 |
贯防感冒片 | 1994 | 国药准字Z44022790 |
喉康散 | 1994 | 国药准字Z44020781 |
猴枣牛黄散 | 1994 | 国药准字Z44022791 |
华佗再造丸 | 1996 | 国药准字Z44020748 |
护肝片 | 1996 | 国药准字Z44020939 |
护心胶囊 | 1994 | 国药准字Z44022412 |
健儿乐颗粒 | 1994 | 国药准字Z44022413 |
健脾补血颗粒
| 1994 | 国药准字Z44020782 |
健脾补血片 | 1994 | 国药准字Z44020749 |
鸡骨草肝炎颗粒 | 1994 | 国药准字Z44022388 |
金丹丸 | 1996 | 国药准字B20020525 |
精制冠心颗粒 | 2002 | 国药准字Z20026540 |
金鸡虎补片 | 1994 | 国药准字Z44022792 |
金菊感冒片 | 1994 | 国药准字Z44022793 |
抗感解毒颗粒 | 1999 | 国药准字Z19993182 |
龙凤宝胶囊 | 1994 | 国药准字Z44022414 |
螺旋藻片 | 1996 | 国药准字Z44020978 |
脑得生片 | 1996 | 国药准字Z44021397 |
千柏鼻炎胶囊 | 1994 | 国药准字Z44022415 |
千柏鼻炎片 | 1996 | 国药准字Z44020750 |
清热定惊散 | 1994 | 国药准字Z44023246 |
清热散结片 | 1994 | 国药准字Z44022794 |
蛇胆半夏片 | 1994 | 国药准字Z44020751 |
蛇胆半夏散 | 1994 | 国药准字Z44023247 |
蛇胆陈皮散 | 1996 | 国药准字Z44020785 |
蛇胆川贝胶囊 | 1999
| 国药准字Z19993174 |
蛇胆川贝散 | 1996 | 国药准字Z44020752 |
蛇胆姜粒 | 1994 | 国药准字Z44022416 |
生脉饮 | 1996 | 国药准字Z44020587 |
肾炎平颗粒 | 1994 | 国药准字Z44022398 |
四方胃胶囊 | 1994 | 国药准字Z44023248 |
四方胃片 | 1994 | 国药准字Z44020753 |
天凤胃痛散 | 1994 | 国药准字Z44023249 |
通便宁片 | 1993 | 国药准字Z10930020 |
香砂胃痛散 | 2002 | 国药准字Z20026393 |
血压平片 | 1994 | 国药准字Z44020754 |
心舒宁片 | 1994 | 国药准字Z44022796 |
新雪颗粒 | 1994 | 国药准字Z44022417 |
新雪片 | 1994 | 国药准字Z44022795 |
西洋参黄芪胶囊 | 1992 | 国药准字B20020687 |
虚汗停颗粒 | 1994 | 国药准字Z44020783 |
虚汗停颗粒 | 1994 | 国药准字Z20093240 |
养血安神片 | 1994 | 国药准字Z44020942 |
益妇止血丸 | 1997 | 国药准字Z10970108 |
元胡止痛片 | 1996 | 国药准字Z44020915 |
云芝肝泰颗粒 | 1994 | 国药准字Z44022418 |
玉液消渴颗粒 | 1994 | 国药准字Z44020943 |
增抗宁片 | 1994 | 国药准字Z44020755 |
珍珠层粉 | 1994 | 国药准字Z44020784 |
珍珠末 | 1994 | 国药准字Z44022797 |
治感灵颗粒 | 1994 | 国药准字Z44020850 |
止咳枇杷颗粒 | 2002 | 国药准字Z20027461 |
壮腰健肾片 | 1994 | 国药准字Z44022798 |
壮腰健肾丸 | 1994 | 国药准字Z44022799 |
紫雪颗粒 | 2002 | 国药准字Z20025351 |
后话:2017年2月22日,CFDA发布了《食品药品监管总局办公厅关于药品技术转让有关事项的通知》,38号文作为实施新修订GMP的过渡性文件正式退出。企业如有进行技术转移的需要,可按照2009年《药品技术转让注册管理规定》(国食药监注〔2009〕518号)的程序和要求申报补充申请,由CFDA进行审评审批。CFDA正在研究制定简化药品技术转让程序的相关政策。













