BioArt按
:
不同的抗原刺激会引起不同的
T细胞抗原受体(TCR)
磷酸化模式,从而引发特异性的免疫应答反应。
阐明TCR的磷酸化机制因此是理解获得性免疫为什么具有特异性的关键所在。
6月28日,中科院上海生化与细胞研究所
许琛琦
研究员课题组在
PNAS
杂志上以长文形式(PNAS Plus)发表了题为“Ionic CD3−Lck interaction regulates the initiation of T-cell receptor signaling”的研究论文,
该研究揭示了Src家族酪氨酸激酶Lck识别不同底物的新型分子机制,及其对T细胞信号起始的直接调控作用。

论文解读
:
T细胞活化依赖于细胞表面的T细胞抗原受体(T-cell receptor, TCR)。TCR可以识别“自我”和“非我”抗原,并根据抗原的特质引发特异性的下游信号通路,从而使得T细胞产生特异性分化并获得不同的效应功能。TCR复合体有4种CD3信号链(CD3
γ
/
δ
/
ε
/
ζ
),共携带了20个酪氨酸磷酸化位点。不同的抗原刺激会引起不同的TCR磷酸化模式,从而引发特异性的免疫应答反应。
阐明TCR的磷酸化机制因此是理解获得性免疫为什么具有特异性的关键所在。
为了探究这一科学问题,在
许琛琦
研究员的指导下,硕士研究生
李伦乙
、博士后
郭兴东
、博士研究生
施小山
、硕士研究生
李昌庭
等人运用多种技术手段分析了Lck磷酸化四种CD3信号链的过程。他们发现Lck具有明显的底物选择性,即更倾向于携带正电荷的
CD3
e
链。生物化学与生物物理的实验发现Lck的Unique domain(UD)与
CD3
e
链胞内区的碱性氨基酸富集区(BRS)发生静电相互作用,从而高效地介导了磷酸化过程。将BRS区替换到其他的CD3链后,Lck对它们的磷酸化水平明显提高。接着,他们在293FT细胞中重构了整个TCR复合体及其磷酸化调控蛋白,该系统可以使得他们能够排除下游信号反馈调控来独立地研究TCR磷酸化事件。他们发现利用突变削弱
CD3
e
-BRS/Lck-UD相互作用后,TCR复合体的整体磷酸化水平会明显降低,说明了
CD3
e
招募Lck对TCR磷酸化的起始非常关键(
图1
)。
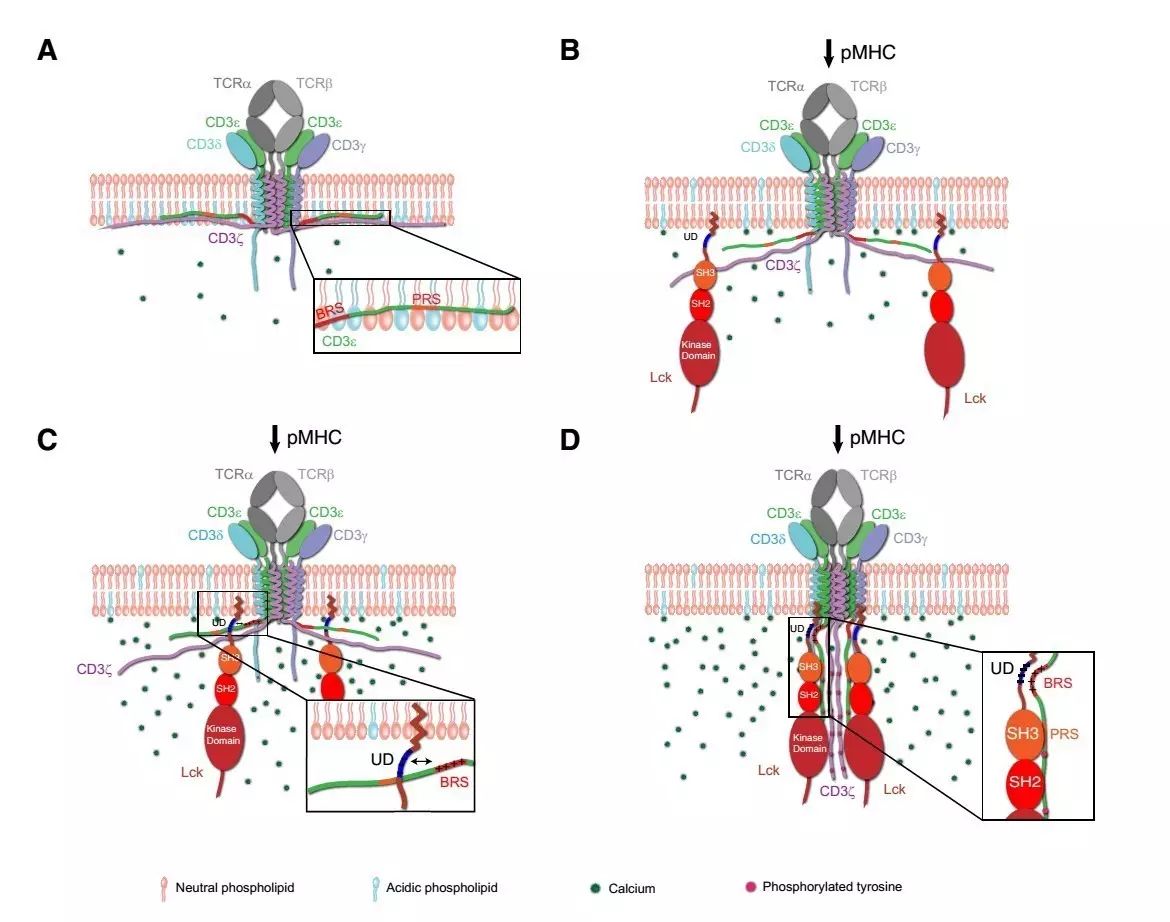
图1:TCR磷酸化起始模型
。
A.
静息态的T细胞中,
CD3
e
和CD3
z
链的胞内区通过静电相互作用与细胞质膜内层的酸性磷脂结合,从而将这两个胞内区屏蔽在膜中,其中包括酪氨酸磷酸化位点和负者招募Lck的BRS区。CD3
d
和
g
的胞内区虽然暴露在细胞质中,但是由于它们不能独立招募Lck而难以被磷酸化。
B.抗原(peptide MHC complex,pMHC)结合使得TCR发生形变,引发
CD3
e
和CD3
z
链的胞内区从膜上解离。
C.CD3
e
BRS区通过与Lck UD区的静电相互作用来招募Lck。D.被招募的Lck磷酸化四条CD3链中的酪氨酸位点,从而激活T细胞中的下游信号通路。
许琛琦研究员的前期工作发现了
CD3
e
的BRS区可以与细胞质膜的酸性磷脂相互作用,从而使得整个
CD3
e
的胞内区被屏蔽在膜脂双层中(
Cell
2008
)。基于以上发现,这种膜屏蔽机制既屏蔽了
CD3
e
的酪氨酸位点,同时也阻止其BRS区与Lck的相互作用,达到抑制TCR整体磷酸化的效果。在T细胞被抗原活化后,抗原结合引起TCR形变可能使得
CD3
e
胞内区从膜上解离;或者钙离子通过中和酸性磷脂负电荷的方式使得未直接接触抗原的TCR中的
CD3
e
胞内区从膜上解离(
Nature
2013
)。不同亲和力的抗原会引发不同程度的
CD3
e
膜解离(
Cell Res
2017
),因此会带来不同的Lck招募程度和TCR的磷酸化程度。
该项研究工作阐明了TCR磷酸化起始的关键机制,同时揭示了Src家族酪氨酸激酶具有高度底物选择性这一现象。由于Src家族在多种细胞类型中都发挥重要作用,该项工作的发现为理解其它细胞的信号转导提供了新的线索。
该项工作得到了上海科技大学
王皞鹏
教授的大力帮助,并得到国家自然科学基金委、中国科学院先导B专项以及科技部的经费支持。该研究工作还得到国家蛋白质科学设施(上海)核磁共振系统,生化与细胞所细胞分析技术平台、分子生物学技术平台的大力支持。
参考文献:
Li L, et al. (2017) Ionic CD3-Lck interaction regulates the initiation of T-cell receptor signaling.
PNAS
. Published online before print.
Xu C, et al. (2008) Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif.
Cell
135(4):702-713.
Shi X, et al. (2013) Ca2+ regulates T-cell receptor activation by modulating the charge property of lipids.
Nature
493(7430):111-115.
Guo X, et al. (2017) Lipid-dependent conformational dynamics underlie the functional versatility of T-cell receptor.
Cell Res
27(4): 505-525

许琛琦
,博士,现任中科院上海生化细胞研究所研究员,所长助理,国家“杰青”。长期从事分子免疫学研究,揭示了脂质分子对免疫应答的调控机制,并且发展了基于脂代谢调控的肿瘤免疫治疗方法。发现细胞质膜中的酸性磷脂通过静电相互作用屏蔽关键受体的功能位点,从而维持T细胞的静息态;而钙离子可以直接与酸性磷脂结合并中和其负电荷,引起受体活化,从而调控T细胞的活化态。这种脂质分子的调控机制也适用于B细胞和肺癌细胞。近年来开创性地开展了脂质代谢与肿瘤免疫的交叉研究,发现了肿瘤免疫治疗的新靶点-胆固醇酯化酶ACAT1,并且证明了ACAT1抑制剂的抗肿瘤功能。以第一作者或通讯作者在
Cell、Nature、Nature Review Immunology、J Exp Med、PNAS、Cell Research
和
Nature Communication
等国际知名杂志发表多篇学术论文。获得中科院百人计划(2010)、国家杰出青年基金(2014)、国家万人计划“青年拔尖人才”(2015)、全国优秀科技工作者、上海市优秀学术带头人、中科院青年科学家奖、上海市科学技术进步奖、上海青年科技英才、邹承鲁奖励基金杰出研究论文奖、明治生命科学杰出奖等人才项目和荣誉。值得一提的是,
许琛琦
课题组和
李伯良
课题组合作完成的“
基于胆固醇代谢调控的肿瘤免疫治疗新方法
”项目入选中国科协2016年度“
中国生命科学领域十大进展
”和科技部“
2016年度中国科学十大进展
”,这个工作也入选了
BioArt推出了“2016年中国生命科学十大进展”
,详见:
BioArt推选出2016年度“中国生命科学十大进展”
。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





