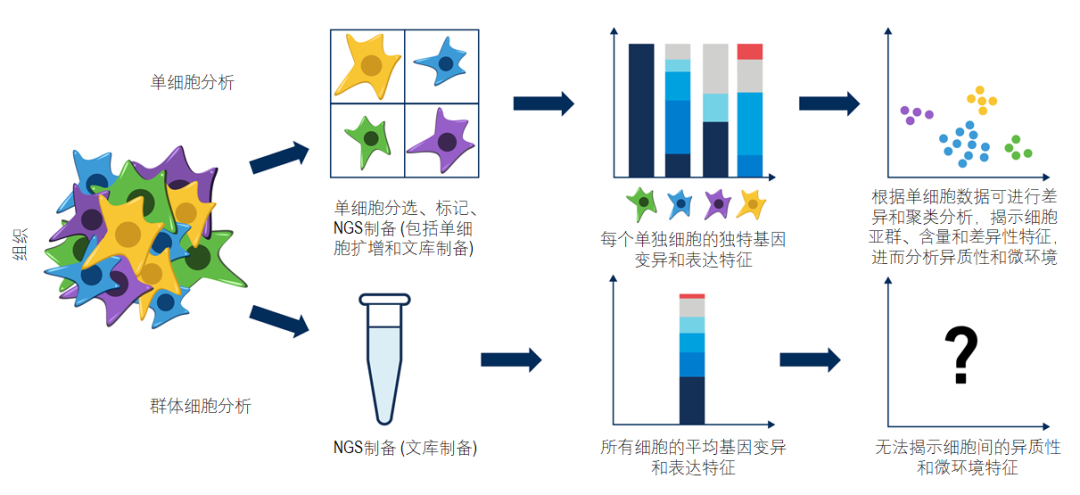
可能有人会问:如今新一代测序(NGS)技术都如此成熟了,单细胞测序有什么难的呀?比如,有些孕妇会在医生的建议下接受无创产前筛查(NIPT)来避免产下缺陷宝宝,有些癌症患者会在医生的指导下接受肿瘤靶向基因检测获得精准的药物治疗,这些都是NGS的成熟和临床转化带来的应用,单细胞测序无非就是把单个细胞作为测序对象,难在哪里呢?难就难在这个对象非常微小且各不相同,测序过程中存在两大挑战:一是因为单个细胞的核酸起始量过低无法测序;二是因为不易高效率地分选和标记单个细胞,可能会导致张冠李戴。细胞之于人体就像是群众之于国家,用NGS进行个体基因测序就像是通过宏观调查手段了解国民的平均身高,相对比较容易,但单细胞测序就像是要通过微观调查方法记录14亿人民每个人的准确身高,那就难如登天了。
也许有人还会问:既然已经可以用NGS检测进行许多临床诊断了,为什么还要挑战难度如此之高的单细胞测序呢?就像个体之间会存在差异性,个体组成团体后会产生更大的差异性一样,细胞之间也存在着差异性(异质性),细胞之间的相互作用就产生了更复杂的差异性(微环境)。目前我们面临的许多临床难题都是因为这种异质性和微环境造成的,比如肿瘤组织的耐药和复发就是因为NGS只检测到了部分对药物敏感的肿瘤细胞的特征,导致患者一开始服药有效,而随着敏感细胞的大量死亡,部分耐药细胞获得了适宜的生存空间茁壮成长,另有一些原本敏感的细胞在死亡压力的筛选下进一步突变从而得以幸存和东山再起,肿瘤就开始耐药和复发了。单细胞测序就是探索异质性和微环境的最有效工具,可以帮助我们深入理解肿瘤基因的变异是如何驱动恶性细胞的异质性和进化并获得不受控的能力,从而达到控制肿瘤恶化的目的(图1)。
图1. 单细胞测序和常规NGS测序的区别
前面提到,要实现单细胞测序,必须首先克服两大挑战:1)高效的分选和标记单个细胞;2)提高单个细胞的核酸起始量达到测序上机的要求;然后分选和扩增完的样品才能和常规NGS测序的工作流程相衔接,实现下游的各种生物信息学分析和转化应用。
图2. 单细胞测序前端流程和常规NGS测序流程的衔接及主要的技术方法
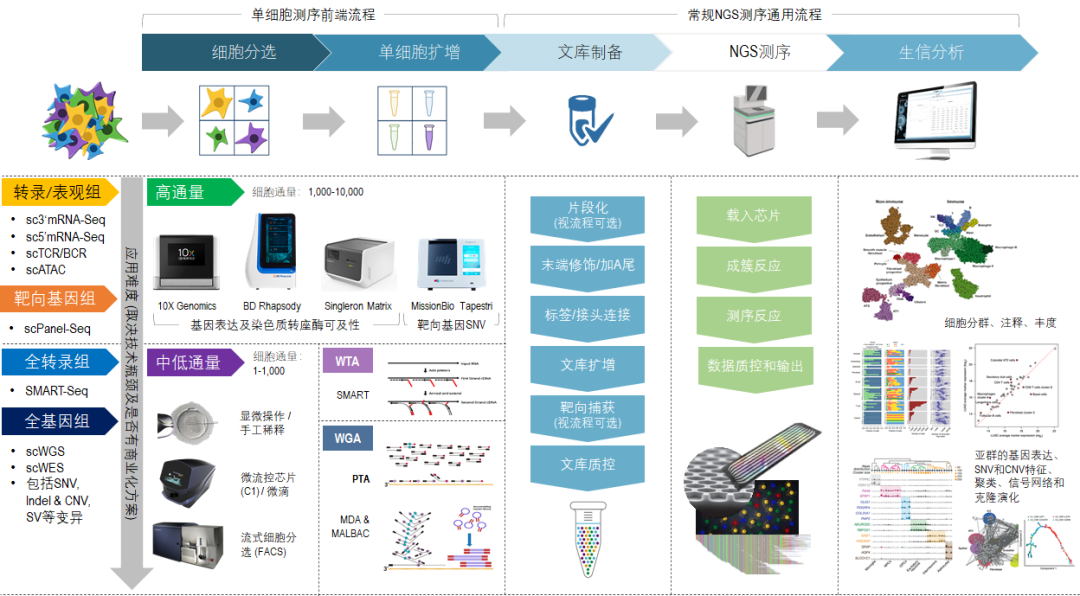
在单细胞测序的前端流程中(图2),根据有无成熟商品化方案再进行分类,可分为高通量分选制备和中低通量分选制备,其中:
高通量分选制备可通过自动化仪器来进行,如10X Genomics,BD Rhapsody,Singleron Matrix和MissionBio Tapestri等,每批次每样品的细胞通量可达1000~10,000,可从单细胞悬液样品起始,高效分选、标记及扩增单细胞,以获得足量和已标记单细胞来源的核酸。虽然这些仪器大大提高了细胞分选和扩增的通量,降低了成本,但由于技术原理的局限性,只能进行部分应用,比如单细胞的3’或5’-基因表达(Gene Expression)、染色质转座酶可及性(ATAC)和靶向基因变异(Targeted Panel)检测等,使用场景比较有限。
中低通量分选制备常通过显微操作、微流控芯片和流式细胞仪结合手工制备来进行,每批次、每样品的细胞通量常为1~1,000,虽然通量降低增加了制备成本且依赖前端细胞富集的有效性,但优势在于可拓宽应用范围至全基因组(WGS和WES)和全转录组(SMART-Seq),大大丰富了各种高挑战的使用场景,比如单细胞的拷贝数变异(CNV)、可变剪切(Alternative Splicing)、基因融合(Gene Fusion)等分析助力肿瘤学研究,比单纯的基因表达分析更能全面揭示肿瘤细胞是如何从底层的基因变异开始,一步步驱动恶性演化和逃逸药物治疗的,这是新药研发的前提,也是诊疗的基础,可涵盖高通量制备方法目前无法企及的应用场景。
由此可见,单细胞应用要真正实现有价值的临床转化,首先要突破全基因组扩增(WGA)的技术性壁垒,其次要突破提升细胞通量、降低制备成本的规模化壁垒。WGA和细胞通量就像“鱼”和“熊掌”,目前还没有可以兼得的方案,有待技术的创新和成熟。















