撰文丨牛津街52号
责编丨迦溆
高维度高分辨的影像方法是生物学研究的重要手段之一。光学显微技术可利用荧光蛋白或抗体染色进行多维成像,随着超分辨荧光显微技术的发展,亚微米甚至是纳米尺度的研究也成为可能。然而电子显微成像技术超高的原生分辨率依然是光学显微技术难以媲美的。同时电子显微镜技术不依赖特定的抗体染色,而是利用非特异性的膜染色法,因而可以更全面的展现细胞的形态。
脑组织结构复杂,不仅细胞类型多,而且神经元之间又通过突触形成极为复杂的网络。这些复杂单元以及其构成的神经网络被认为是大脑认知、学习等功能的源泉,是破解人工智能的关键。我们不仅需要以很高的精度重建这样一个网络
(突触连接有时只有几十纳米)(图1)
【1】
,还需要分辨这一网络中各个细胞的种类
(如兴奋或抑制型神经元)(图2)
【2】
。因此,
结合光学和电子显微成像技术在维度和分辨率上各自的优势进行关联成像,对探究脑功能的秘密具有至关重要的意义。
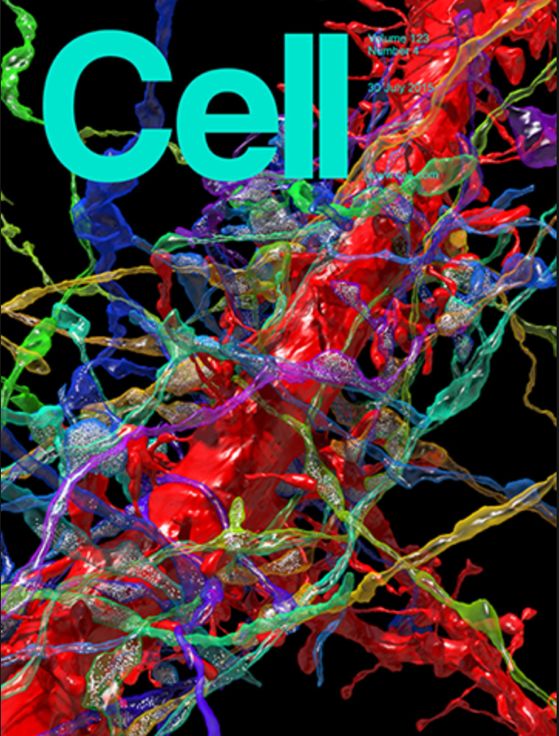
图1, Lichtman组完成的神经元超微结构三维重建以封面文章2015年发表在
Cell
上;
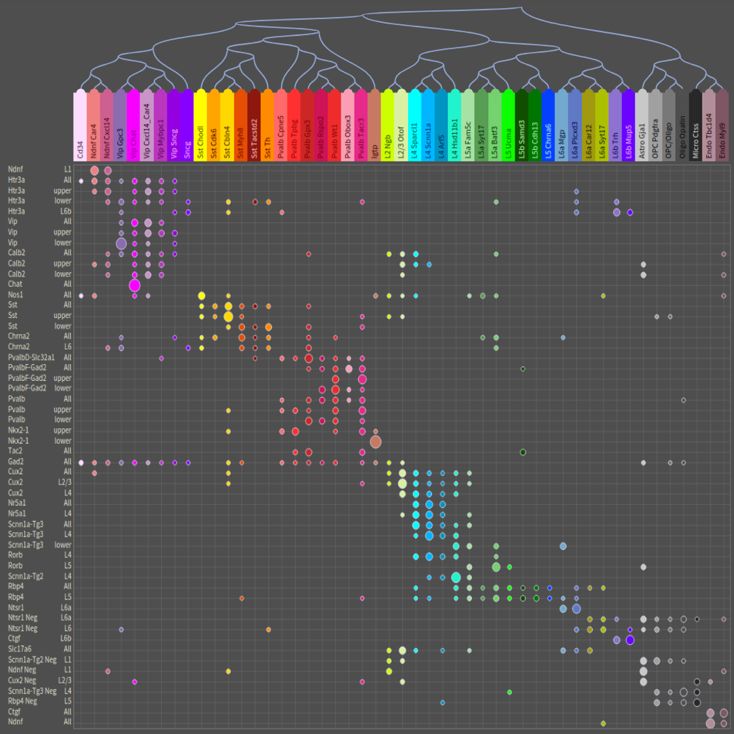
图2, Allen Brain Institute发表的脑细胞分类图谱
针对光-电关联成像,研究人员已经在模式体系上进行了相应的尝试,如在培养的单层细胞上,利用抗体染色后对同一样品进行电子显微镜染色和成像并将两次影像叠加,则可获得相应的关联成像信息,这一看似显而易见的组合却面临一个致命的挑战——细胞膜。现有技术为了让抗体深入组织或者进入细胞内,需要用表面活性剂对样品进行通透处理,移除部分细胞膜,以便抗体的穿透。可想而知这一过程极大地破坏了电子显微成像观测的对象,细胞膜的破坏使神经连接的确认和重建变得极为困难。
为了探究大脑功能的奥秘,我们必须对无损的脑组织进行研究。
为了解决这一挑战,已有研究尝试了通过对组织样品先进行树脂固定和超薄切片后,再对每一片样品分别进行免疫染色和光学成像,这一方法被称为
Array Tomography
(图3)
【3】
。
它解决了样品的穿透问题,但是对数以千计的样品切片进行免疫染色不仅是一个费时、费力而且昂贵的过程,且为了保证蛋白的抗原性,所选用用来固定的树脂也需要具有一定的亲水性,因而降低了超薄切片的质量,影响了后续电子成像的质量。利用荧光蛋白标记相应靶标可避免对细胞膜的破坏,但是在动物中同时标记多个荧光蛋白,具有较大难度,且会对动物的发育造成影响,不适合研究大脑复杂的分子特征。
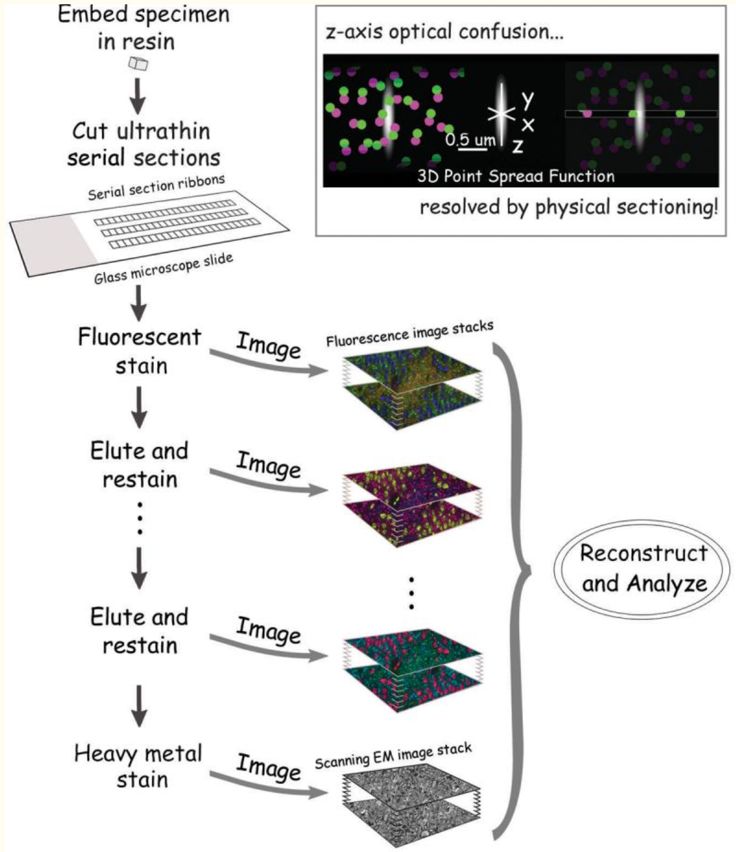
图3. Array tomography流程图
使关联成像时光学与电子成像不再互相牵制,对于复杂神经网络的重建具有重要意义。
近期,来自
哈佛大学
Jeff Lichtman
研究小组的Xiaotang Lu 与 Daniel Berger 博士后研究员和来自哈佛大学医学院的Tao Fang博士后研究员等合作在
Nature Methods
杂志上发表了题为
Nanobody immunostaining for correlated light and electron microscopy with preservation of ultrastructure
的论文,
发现使用一种新型的抗体片段——纳米抗体,可以在不进行膜通透的条件下,对深层组织和胞内蛋白进行染色,从而使大体积、原生组织光-电关联成像成为可能。这种方法被命名为纳米抗体介导的原生组织大体积组织染色法,简称NATIVE
【4】
。

纳米抗体是来自驼科特有的重链抗体可变域的片段,是已知最小的可由自然抗体获得的具有完整抗原识别能力的抗体片段。纳米抗体的分子量只有传统抗体的1/10,体积约为1/15。细胞在固定后往往展现出一定的通透性,虽然不足以让传统抗体通过,但足以让纳米抗体进入胞内
(图4)
。
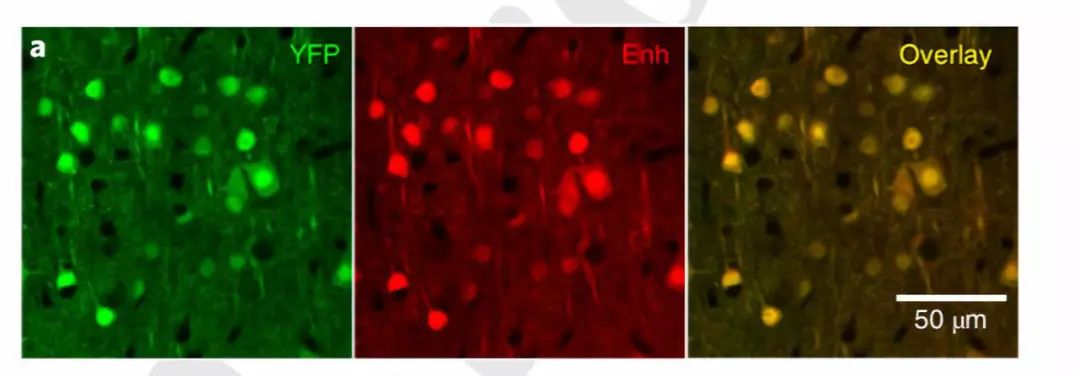
图4. 纳米抗体显示了良好的特异性和组织穿透性,可以在不移除细胞膜的条件下进行胞内蛋白染色
受到这一发现的鼓舞,研究人员进一步使用了三种纳米抗体,分别识别星形胶质细胞、小胶质细胞和脑血管内皮细胞,在原生脑组织上进行多维和大体积的荧光成像后, 立刻对该组织进行电子显微样品染色。利用Lichtman实验室发展的自动超薄切片胶带收集系统
(ATUM)
,可以迅速、简便地对大体脑组织进行切片采集和电子显微成像。将相应荧光影像与电子显微影像重叠,可在高质量的电子显微图像上清晰区分相应的细胞类型
(图5)
。
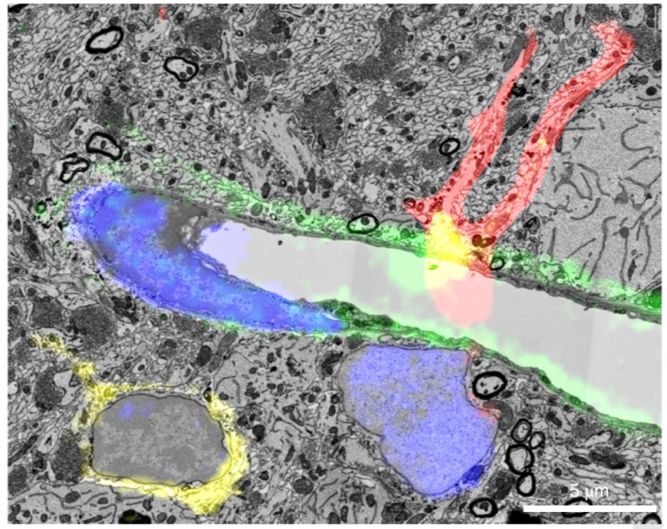
图5. 电子显微图像上叠加荧光影像,红色是星形胶质细胞,黄色是小胶质细胞,绿色是血管上皮细胞
在高质量的电镜图像引导下,研究人员继而可以在5nm的分辨率下对通过纳米抗体免疫染色确定的细胞进行三维重建,本文重建了血脑屏障组成的一部份,并在三维重建中重现小胶质细胞清除神经元碎片的过程,以及星形胶质细胞对突触的包裹
(图6)
。
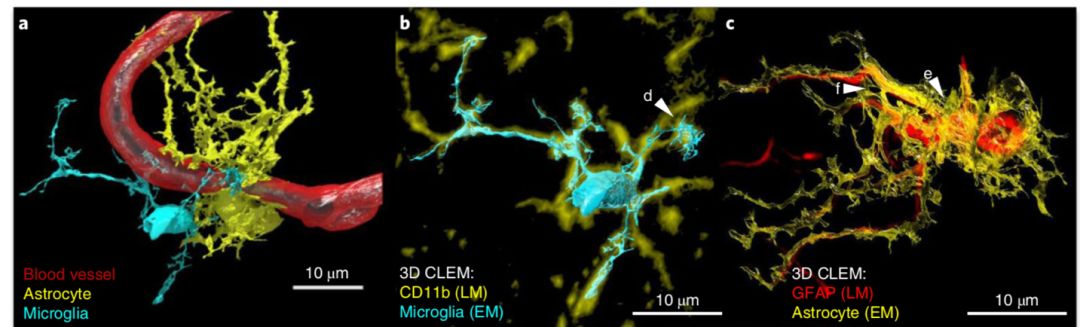
图6. 三维高分辨光-电关联显微重建















