NFκB通路活化参与CRPC的形成
2012年,Edwards等以临床病人为研究对象,比较了相同病人在CRPC时期和非CRPC时期,NFκB通路的活化水平,并分析其与疾病复发和死亡的相关关系。结果表明NFκB通路活化参与CRPC的形成。
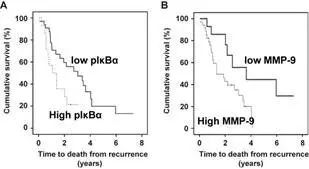
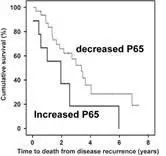
在CRPC肿瘤中,p65, IkBa
ser32/36
和 MMP-9与肿瘤复发周期和生存时期有显著的关系。p65,pIkBα和MMP表达量越高,疾病越容易复发。
参考文献:Mccall P, Bennett L, Ahmad I, et al. NFκB signalling is upregulated in a subset of castrate-resistant prostate cancer patients and correlates with disease progression.[J]. British Journal of Cancer, 2012, 107(9):1554-63.
抑制NFκB信号通路可逆转CRPC对抗雄激素的耐药性
雄激素受体剪切变异体与CRPC的发展相关,也与高亲和力的抗雄激素的抗性相关。但是雄激素受体剪切变异体(ARVs)的表达调控机制还未被揭示。Robert 等2015年的研究对该机制进行了初步探索。
研究指出NF-κB信号通路活化增强前列腺癌细胞(PCs)ARVs表达,并且影响药物抗性的产生。降低NF-κB信号通路活性可抑制ARVs表达并逆转CRPC对抗雄激素的耐药性。
并且联合使用抗雄激素和NF-κB通路靶向药物显著抑制CRPC小鼠肿瘤增长。以上实验结果表明NF-κB信号通路活化导致的ARVs表达升高是前列腺癌细胞(PCs)发展为CRPC的重要机制。
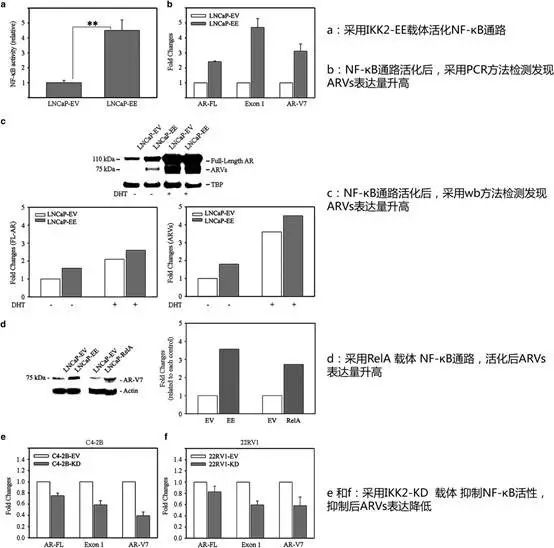
(a)NF-κB信号通路活化增强前列腺癌细胞(PCs)ARVs表达
首先,作者在前列腺癌细胞中采用IKK2-EE和RelA两种载体活化NF-κB信号通路(Figure 1a 和1d),通过qPCR和Western blot两种手段检测三种ARVs(AR-PL,Exon1和AR-V7)表达,发现NF-κB活化后,ARVs表达量显著增加(Figure 1b 和1c)。
接下来,采用IKK2-KD载体进行回复实验抑制NF-κB活化后,ARVs表达量显著减低(Figure 1e 和1f)。此外作者还在PCs细胞中加入NF-κB抑制剂(BMS345541),也得到了类似的结论。
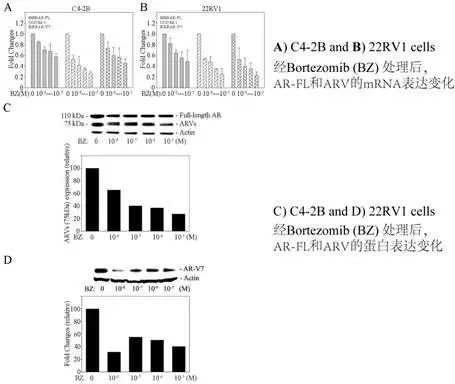
(b)降低NF-κB信号通路活性可抑制ARVs表达并逆转CRPC对抗雄激素的耐药性
接下来为了找寻NF-κB信号通路活性和ARVs表达引起耐药性的关系,作者首先在PC细胞分别活化和抑制NF-κB活性后,加入抗雄激素药物Bic后,检测细胞增殖情况。发现NF-κB通路抑制可逆转细胞的耐药性。

同时发现加入NF-κB抑制剂(Bortezpmib)后,ARVs的mRNA和蛋白表达量降低。
(C)联合使用抗雄激素和NF-κB通路靶向药物显著抑制CRPC小鼠肿瘤增长
最后作者通过皮下注射方式建立CRPC动物模型,并暴露抗雄激素和NF-κB抑制剂,结果显示二者联合暴露可显著减低肿瘤体积和重量,并通路免疫组化方法确定了NF-κB通路活性和ARVs表达降低。
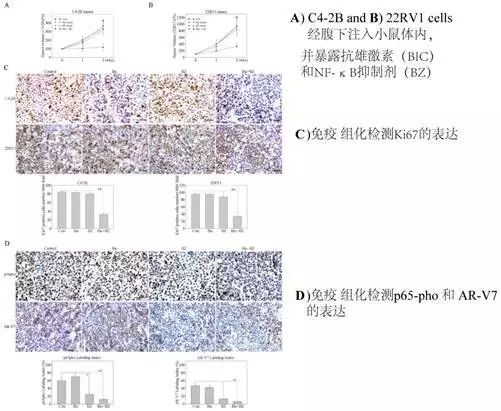
参考文献:Jin R, Yamashita H, Yu X, et al. Inhibition of NF-kappa B signaling restores responsiveness of castrate-resistant prostate cancer cells to anti-androgen treatment by decreasing androgen receptor-variant expression[J]. Oncogene, 2014, 34(28):3700-10.
青蒿酯(AS)靶向NFκB信号通路逆转CRPC对抗雄激素的耐药性
青蒿酯(AS)具有抗细胞增殖,血管生成,细胞转移的活性。它的作用机制包括抑制NF-κB通路活性,因此作者假设青蒿酯可能靶向NFκB信号通路逆转CRPC对抗雄激素的耐药性。
(a) AS可逆转CRPC对抗雄激素的耐药性
作者分别将PC3,22RV1和LNCaP细胞单独或联合暴露于AS和抗雄激素Bic,发现与Bic单独暴露相比,AS和抗雄激素Bic联合暴露可显著降低细胞增殖,细胞克隆形成能力,细胞侵袭转移能力。
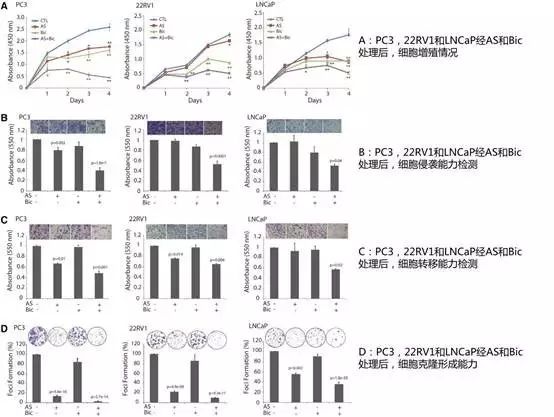
(b)AS通过抑制NFκB信号通路逆转CRPC对抗雄激素的耐药性
接下来,作者进一步探讨NFκB信号通路是否参与AS对抗雄激素耐药性的作用。结果表明,与Bic单独作用相比,AS和Bic共同作用可抑制NFκB信号通路的活性,并且降低ARVs的表达。
(c)AS和Bic联合暴露可抑制CRPC小鼠肿瘤生长和远端转移
最后,通过体内实验作者进一步证实AS逆转CRPC对抗雄激素的耐药性。AS和Bic联合暴露时,肿瘤的体积显著性减小,肿瘤转移显著性下降。
参考文献:Nunes J J, Pandey S K, Yadav A, et al. Targeting NF-kappa B Signaling by Artesunate Restores Sensitivity of Castrate-Resistant Prostate Cancer Cells to Antiandrogens12:[J]. Neoplasia, 2017, 19(4):333.






