2016年,CDE进口化药新受理号共901个,其中批准临床有87个,批准进口有24个,不批准1个,企业撤回5个。
下图是进口化药主要分类:
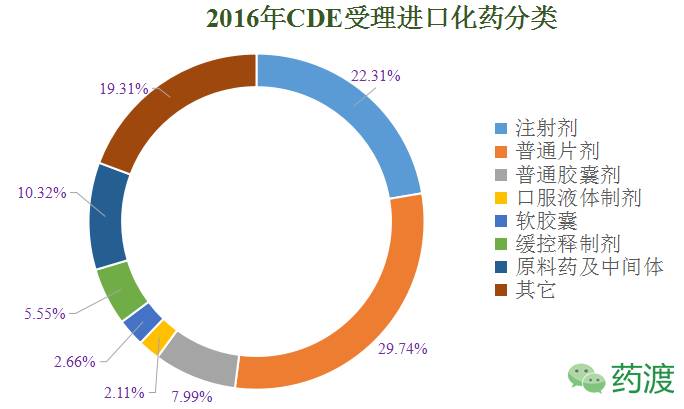
2016年CDE新受理的进口化药批准进口有24个,涉及品种11个:
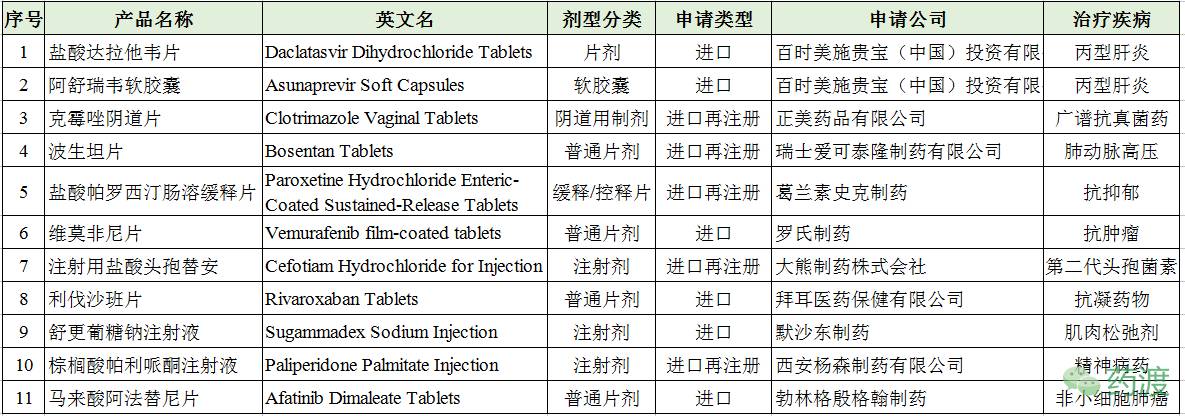
达拉他韦是一种用于治疗丙型肝炎(HCV)的药物,可与索非布韦、病毒唑等联用。达拉他韦是一种选择性非结构5A蛋白(NS5A)抑制剂,而NS5A是HCV病毒转录和翻译过程中起着重要的作用,因此达拉他韦抑制体内丙型肝炎病毒的生长,而对宿主细胞的毒性较低。达拉他韦是由施贵宝(BMS)科学家Daklinza发现的,2014年08月获得EMA的批准,2017年01月获得盐酸达拉他韦片的批准;2015年07月获得FDA的批准盐酸达拉他韦片NDA,商品名为Daklinza®(以科学家名字命名),批准规格为30mg、60mg、90mg。达拉他韦易溶于水(>700 mg/mL),片剂生物利用度67%。FDA显示,盐酸达拉他韦片目前还处于市场独占期(到2020年),且部分专利仍处于有效期状态,无仿制药获得批准或预批准。CFDA显示,施贵宝获批的规格仅为60mg。
阿舒瑞韦是选择性丙型肝炎病毒(HCV)非结构蛋白3蛋白酶(NS3)抑制剂,由施贵宝(BMS)开发。阿舒瑞韦软胶囊与盐酸达拉他韦片联合,可用于治疗成人基因1b型慢性丙型肝炎(非肝硬化或代偿期肝硬化),这是一种不含有干扰素给药的完全口服给药方案,适用于治疗基因1b型慢性丙型肝炎(CHC)代偿性肝病成人患者,包括对单独应用干扰素治疗或干扰素联合应用利巴韦林治疗不适合或不耐受的患者。阿舒瑞韦软胶囊于2012年08月获得EMA的批准;2014年07月获得PMDA的批准,批准规格为100mg;2017年04月获得CFDA的批准上市,批准规格为100mg;FDA暂未对其批准。
克霉唑是一种广谱抗真菌药,主要用于阴道酵母菌感染、口腔念珠菌病、尿疹、花斑癣及其它癣。克霉唑能通过抑制真菌细胞膜的合成,并影响其代谢过程而产生抗真菌作用。对浅表真菌及某些深部真菌均有抗菌作用。临床主要供外用,治疗皮肤霉菌病,如手足癣、体癣、耳道、阴道霉菌病等。该品毒性大,口服可有胃肠道反应、肝功异常及白细胞减少等。克霉唑于1969年被发现,原研公司为拜耳(Bayer),2012年获得CFDA的批准;正美药品有限公司本次为进口再注册,首次批准时间为2013年09月。
波生坦是一种治疗肺动脉高压(PAH)的药物,一种双重内皮素受体拮抗剂,具有对ETA和ETB受体的亲和作用。波生坦可降低肺和全身血管阻力,从而在不增加心率的情况下增加心脏输出量。波生坦片原研企业为瑞士爱可泰隆制药(Actelion Pharms),于2001年11月获得FDA批准的NDA,商品名为Tracleer®,批准规格为62.5mg和125mg。瑞士爱可泰隆制药公司本次为进口再注册申请,CFDA于2017年01月重新批准,批准规格为125mg。FDA显示,波生坦片目前无市场独占期和专利期,也无仿制药;CFDA也未批准国产药。
帕罗西汀是一种苯基呃啶衍生物,是选择性5羟色胺再吸收抑制剂(SSRI),能阻断突触前膜对5-HT的再摄取,延长和增加5-HT的作用,从而产生抗抑郁作用。可用于治疗伴有焦虑症的抑郁症患者,也可用于原恐障碍、社交恐怖症及强迫症的治疗。帕罗西汀原研企业为SmithKline Beecham(2000年变更为GSK),1994年获得FDA批准的盐酸帕罗西汀片,商品名为Paxil®;1999年获得FDA批准的盐酸帕罗西汀缓释片NDA,商品名为Paxil CR®,批准规格有12.5mg、25mg和37.5mg。2010年08月,葛兰素史克制药首次获得CFDA批准进口,本次为进口再注册,批准规格为12.5mg和25mg。
维莫非尼是一种用于治疗晚期黑色素瘤的B-RAF酶抑制剂。黑色素瘤是一种来源于黑色素细胞的恶性肿瘤,是皮肤肿瘤中恶性程度最高的瘤种,容易出现远处转移。在中国黑色素瘤患者中,大约26%的患者存在B-RAF基因突变。随着黑色素瘤生长,癌细胞更深地渗透到皮肤和粘膜中,最终到达血管或淋巴通道,并迅速传播到整个身体和主要器官;维莫非尼可以显著降低晚期恶性黑色素瘤患者的死亡风险和肿瘤进展风险。维莫非尼片原研企业为罗氏Roche,于2011年08月获得FDA批准的NDA,商品名为Zelboraf®,批准规格为240mg;2012年02月于加拿大上市;2012年02年获得EMA的批准上市。据悉,Zelboraf®已在包括美国和欧盟在内的99个国家和地区获得批准,迄今已被用于治疗全世界超过50,000名患者。本次为CFDA对其进行加速审批,是我国国内首个获得上市批准的高选择性的B-RAF抑制剂,批准规格为240mg。
盐酸头孢替安为半合成的注射用第二代头孢菌素,其抗菌作用机制与其他头孢菌素类药相似,主要是通过与细菌细胞一个或多个青霉素结合蛋白(PBPs)相结合(头孢替安与PBP-1、PBP-3有较高的亲和力),抑制细菌分裂细胞的胞壁合成,从而起抗菌作用。头孢替安在体外对金黄色葡萄球菌、溶血性链球菌、肺炎链球菌和草绿色链球菌的多数菌株以及大肠埃希菌、变形杆菌、克雷白杆菌、淋球菌、伤寒沙门菌等革兰阴性菌具有较强的抗菌活性。头孢替头孢替安口服不吸收。肌内注射,其生物利用度为86%。头孢替安原研企业为日本武田制药Takeda Pharmaceutical,1981年02日在日本上市,商品名为Pansporin®;1988年注射用盐酸头孢替安获得FDA的批准上市,商品名为Ceradon®,批准规格为1mg/vial,现已撤市。2006年01月,大熊制药株式会社首次获得CFDA批准的注射用盐酸头孢替安,本次为进口再注册。
利伐沙班是一种口服具有生物利用度的Xa因子抑制剂,能阻止血栓的形成。利伐沙班通过选择性地阻断Xa因子的活性位点,而不需要辅因子(例如抗凝血酶Ⅲ)以发挥活性。通过内源性及外源性途径活化X因子为Xa因子(FXa),在凝血级联反应中发挥重要作用。利伐沙班片是第一个口服使用的Xa因子抑制剂。利伐沙班最初是由拜耳Bayer发现的,2008年获得EMA的批准,商品名为Xarelto®,批准规格为2.5mg;而2011年强生制药(Janssen Pharms)获得FDA批准的NDA,商品名为Xarelto®,批准规格为10mg、15mg和20mg。同为抗凝血剂,利伐沙班的价值超过华法林钠的70倍。
舒更葡糖钠一种修饰后的γ环糊精类化合物,是一种新型氨基甾体类肌松药的特异性拮抗药,主要用于临床麻醉,是麻醉药理学里程碑式的研究成果。舒更葡糖通过与氨基甾体类肌松药在血浆中特异性地紧密结合成稳定螯合物的方式降低血浆肌松药浓度,使神经肌肉接头处肌松药不断顺浓度差转运至血浆,再通过肾脏排出体外,最终达到拮抗肌松的作用。舒更葡糖钠最初是由苏格Organon公司发现,后该公司归属到Merck(2009年),版权归Merck所有。2008年舒更葡糖钠首先在瑞典上市,用于逆转由罗库溴铵或维库溴铵导致的肌肉松弛症状。2010年和2015年默沙东制药公司分别向日本和美国递交申请,并于2015年12月15日获美国FDA批准上市,商品名为Bridion®,批准规格为500mg/5ml和200mg/ml。2017年4月26日,CFDA正式批准默沙东麻醉领域的创新药物舒更葡糖钠注射液上市,批准规格为5ml/瓶(500mg)和2ml/瓶(200mg)。
棕榈酸帕利哌酮是第2代抗精神病药帕利哌酮的长效注射制剂,主要用于精神分裂症的全程治疗,既适用于维持用药以预防复发,也适用于急性期治疗以控制精神症状。棕榈酸帕利哌酮是帕利哌酮和棕榈酸通过酯化反应而成的,进入体内水解为帕利哌酮。帕利哌酮又名9羟基利培酮,是利培酮在体内经肝脏CYP2D6酶代谢后的活性代谢产物。帕利哌酮对多巴胺2(D2)受体、5-羟色胺2A(5-HT2A)受体有较强的阻断作用,从而发挥出抗精神病作用。2006年12月,Janssen Pharms获得FDA批准的棕榈酸帕利哌酮缓释片NDA,商品名为Invega®,批准规格为3mg、6mg、9mg、12mg和1.5mg,其中12mg已撤市;无注射剂产品;2007年棕榈酸帕利哌酮缓释片获得EMA的批准。2011年01月,强生制药的棕榈酸帕利哌酮注射液首次获得CFDA的批准进口,用于精神分裂症的急性期和维持期治疗,是目前中国唯一的每月注射1次长效针剂;本次为进口再注册。
阿法替尼是一种是表皮生长因子受体(EGFR)和人表皮生长因子受体2(HER2)酪氨酸激酶的强效、不可逆的双重抑制,是第二代高效双重非可逆性的酪氨酸激酶抑制剂剂,临床上用于治疗非小细胞肺癌(NSCLC)。马来酸阿法替尼片原研公司为勃林格殷格翰制药Boehringer Ingelheim,于2013年07月获得FDA批准的NDA,商品名为Gilotrif®,批准规格为20mg、30mg和40mg;在美国上市之后,陆续又在全球70多个国家获批用于治疗EGFR突变的非小细胞肺癌患者。临床试验数据显示,阿法替尼可明显延长EGFR突变的非小细胞肺癌患者的生存期。2017年勃林格殷格翰制药陆续获得CFDA批准上市,商品名为吉泰瑞®,批准规格为20mg、30mg、40mg和50mg。阿法替尼是首个“上市申请”获得优先审评的进口新药,同时也是第一个以“优先审评”资格被CFDA批准上市的进口新药,提示海外新药进入中国的速度明显加快。
2016年CDE共批准进口化药品种共11个,其中5个为进口再注册。11个品种中,除克霉唑阴道片和注射用盐酸头孢替安不是原研企业外,其余均为原研生产企业。
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详情请点击“6-7月 | 王牌写手获奖名单”