
细菌感染是对公众健康的最大威胁之一。近年来,多种耐药菌的兴起,使现有抗生素的杀灭效果明显下降,生物膜的形成进一步削弱了治疗效果。
近日,来自吉林大学的邴薇/中国医学科学院生物医学工程研究所李稳、Xueping Li等人
开发了一种pH响应光动力探针TI,并将其与ROS反应性一氧化碳(CO)供体组装在一起,然后将其封装在基于透明质酸(HA)的微针贴片中(图1)
。
本文首先是设计和合成一种基于花青素衍生物的高性能光治疗剂,所开发的探针可以感知并动态调整其荧光和PDT特性,以响应感染微环境中的酸度变化。随后,作者将疏水探针与ROS响应的CO供体CORM-401共同组装以形成生物相容性治疗纳米系统并将其进一步封装在透明质酸(HA)微针贴片中,以增强其在感染部位的机械穿透和控释活性。
当遇到产酸细菌时,纳米试剂发生分子结构变化,产生明亮的荧光信号输出,可以实时、灵敏地检测感染并区分感染的严重程度,为治疗程序提供判断依据。同时,激活纳米探针的PDT特性,不仅可以通过氧化损伤直接杀死细菌,还可以触发CORM-401释放CO进行辅助气体治疗。
相关研究成果以
“Bacterial Microenvironment-Responsive Microneedle Patches for Real-Time Monitoring and Synergistic Eradication of Infection”
为题于2024年12月12日发表在
《Advanced Functional Materials》
上。
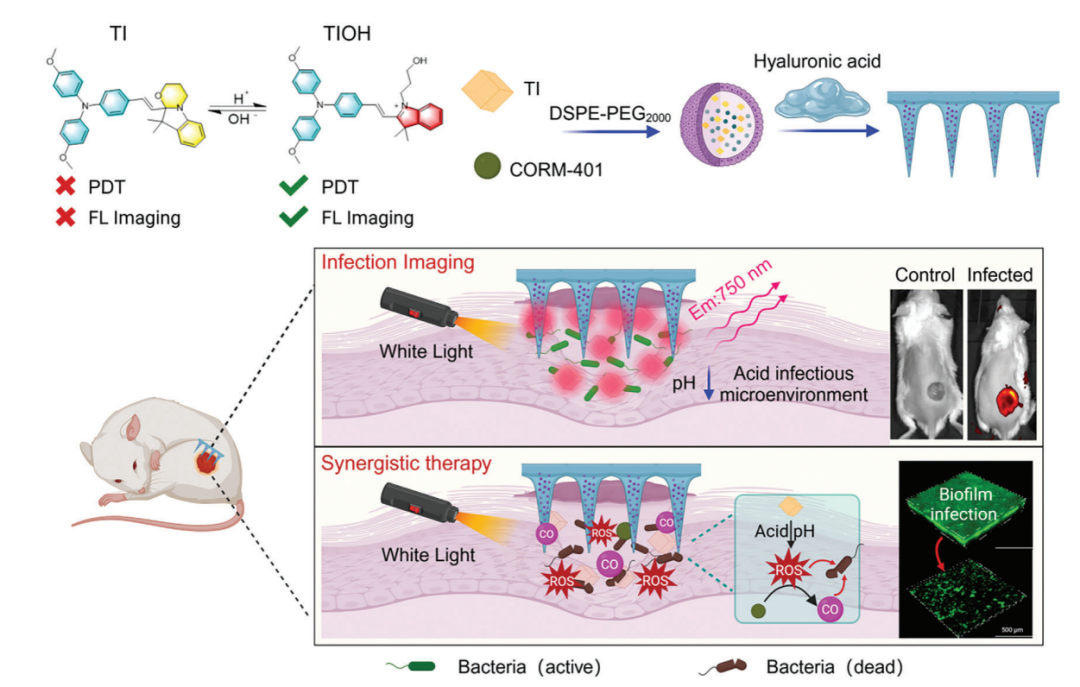
图1本文治疗性微针平台概述
1.TI的基本性质
作者首先开发了一种具有改变电子相互作用的pH触发结构可转换分子,记作TI(图2a)。许多细菌,特别是致病菌,在其代谢过程中经常产生酸性副产物,导致在其周围环境中产生轻度酸性感染环境,其特征是pH值范围通常在6.5到5之间。为了说明TI在监测细菌感染方面的潜力,作者研究了不同pH条件下钛的光物理性质,TI随着pH的变化而表现出可逆的分子开关(图2b)。通过高分辨率质谱和核磁共振波谱(图2c)证实了酸性pH下的分子结构转变。此外,溶液颜色的变化与pH值的变化相对应,可以用肉眼很容易地辨别出来(图2d)。
鉴于荧光成像提供实时反馈和高灵敏度,随后监测了TI在不同pH水平下的荧光光谱,以评估其荧光感应感染的潜力。如图2f所示,随着pH值的降低,出现了一个近红外波长发射带,并且随pH值的降低而增加。由于近红外荧光激活几乎是“开到关”的,从pH 8.0到3.0, 750 nm处的荧光信号显著增加了8倍。使用体内成像系统(IVIS)捕获的不同pH值下TI溶液的近红外荧光图像也显示了酸性条件下信号强度的显著升高(图2g),突出了其监测酸诱导感染的潜力
。
在实际应用中,抗疲劳性和光稳定性是至关重要的先决条件。如图2h所示,当pH值在8和3之间循环调节时,TI的吸收谱可以可逆地切换而没有明显的衰减。在5个pH循环中,TI保持了其精确和快速的pH响应,没有聚集或降解的迹象,从而肯定了该pH转换系统的鲁棒性。此外,在长时间暴露于白光下,酸活化TIOH的荧光强度基本保持不变,与吲哚菁绿(ICG)的稳定性迅速下降形成鲜明对比,其吸光度下降高达73%(图2i)。为了评估来自一系列生物分析物的潜在干扰,作者在生理条件(37°C, pH 7.4)下监测了TI在各种必需离子和生物相关小分子存在下的荧光(图2j)。
在这些假定的生物干扰存在的情况下,探针的荧光光谱没有观察到显著的偏差。因此,TI表现出可逆的pH响应性,出色的光稳定性和对pH的高选择性,使其在感染治疗中的应用具有很高的吸引力
。
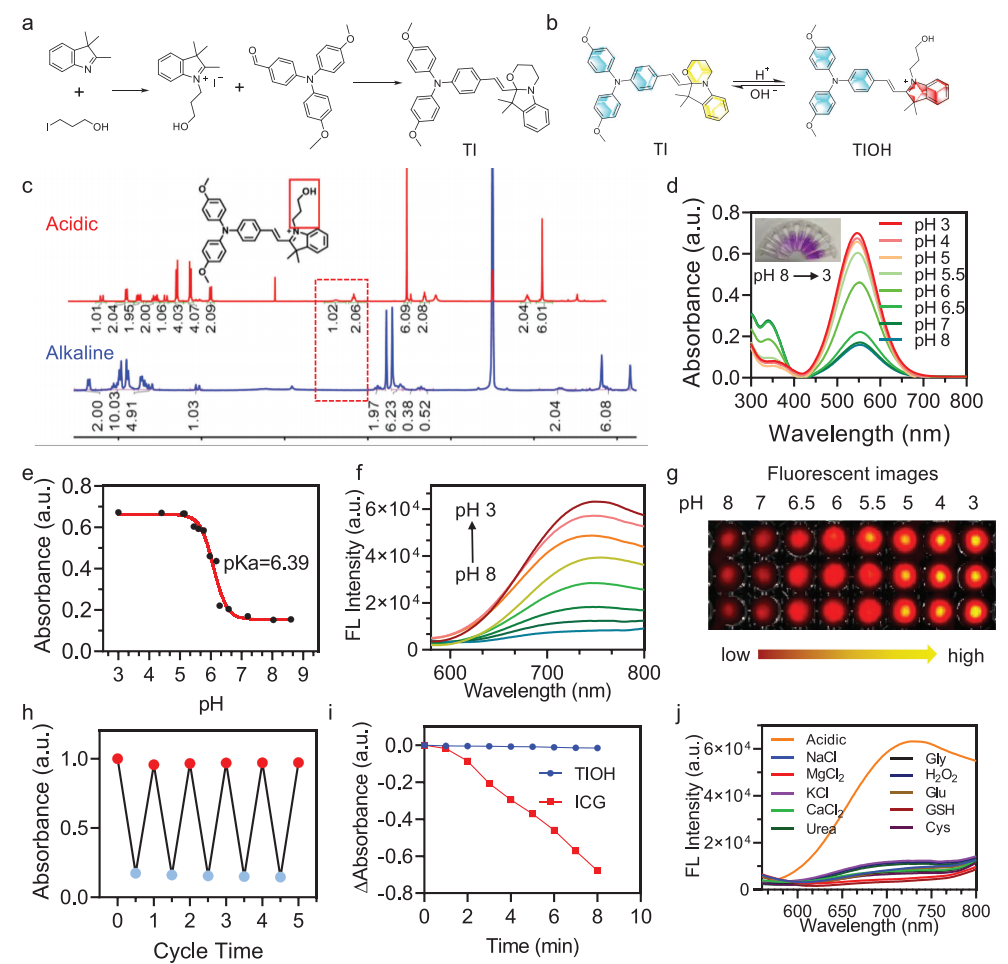
图2 TI的基本性质
接下来,作者以1,3-二苯基异苯并呋喃(DPBF)作为ROS指标,研究了TI在不同pH条件下生成ROS的能力。
在酸性pH条件下,在TI存在和相同的白光照射下,由于光敏过程中产生的ROS氧化DPBF,DPBF的吸光度急剧下降(图3a)。作为对照,在酸性pH环境中,不暴露于光下的DPBF和TI的混合物和单独暴露于光下的DPBF溶液都没有明显的吸收减少(图3b)。这一观察结果表明,光激活和酸激活的TI对于触发ROS的产生都是必不可少的。
作者通过TMB检测证实了I型和II型PDT过程同时发生(图3c-d)。此外,基于实验和模拟进一步验证了TI由pH控制的ROS生产能力,这些特殊的属性使TI成为推进精确和有效的PDT治疗感染的极有希望的候选者
。
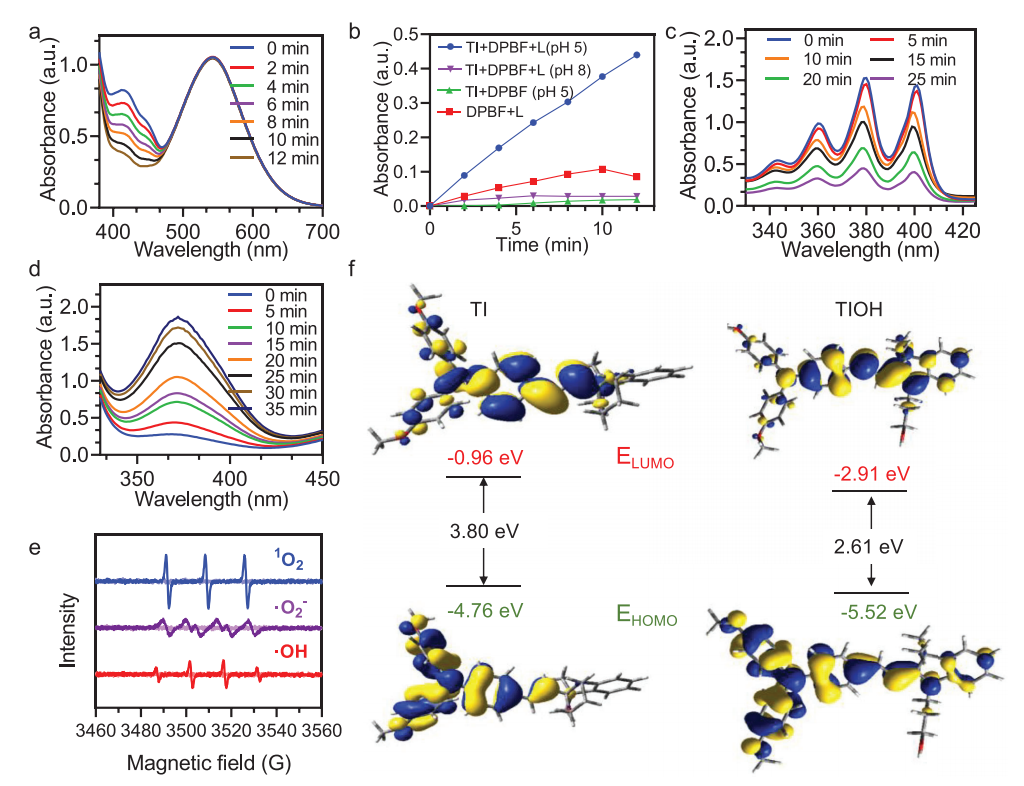
图3 TI在不同pH条件下生成ROS的能力
2.TICO NPs的合成、ROS响应CO释放特性及其生物相容性
为了获得具有生物相容性的纳米试剂,以DSPE-PEG2000为表面活性剂,采用纳米沉淀法将疏水性TI配制成水溶性纳米粒子。
通过动态光散射(DLS)和透射电子显微镜(TEM)分析表征了所得NPs的大小和形态(图4a),结果表明TI NPs的平均直径为126 nm,具有均匀的球形结构。与溶液中的TI分子相比,TI NPs表现出类似的吸收和发射光谱,以及类似的pH响应性(图4b)。
随后,作者研究了TICO NPs是否具有光诱导ROS生成和ROS响应CO释放的特性。
TI加入到TICO NPs中不会影响其酸反应性ROS生成性能(图4c)。在酸性pH(pH 5.0)条件下,在存在TICO NPs的情况下,长时间光照可以观察到CO探针的荧光强度显著增强,表明CO的释放是可控的(图4d)。
综上所述,白光照射不仅通过TI介导的光敏作用触发ROS生成,还实现了CO释放的级联激活,为协同抗菌作用提供了强有力的支持
。
生物相容性实验表明TICO NPs具有良好的生物相容性(图4e-g)。
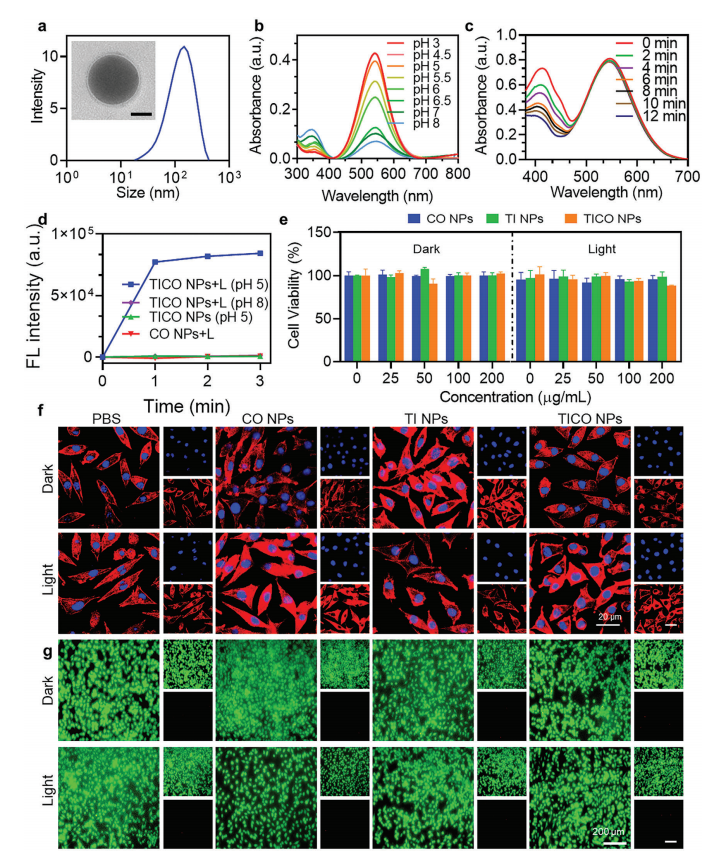
图4 TICO NPs的合成、ROS响应CO释放特性及其生物相容性
3.TICO NPs的抗菌效果
接着,
作者使用标准平板计数法评估TICO NPs对大肠杆菌(革兰氏阴性微生物)和金黄色葡萄球菌(革兰氏阳性微生物)的抗菌效力。
如图5a-c所示,与仅接受PBS处理的对照组相比,未经光照的TICO NPs处理的细菌菌落形成单位(CFU)仅略有减少。
TICO NPs对革兰氏阴性和革兰氏阳性微生物都具有强大的光毒性,主要归因于PDT效应和CO气体处理的强大协同作用
。作者使用扫描电子显微镜(SEM)检查了不同处理后细菌的形态变化。如图5d,e所示,与PBS对照类似,仅暴露于TICO NPs或光照射下的细菌结构保持完整。当大肠杆菌和金黄色葡萄球菌暴露于TICO NPs +光照射时,其细胞壁受到严重损伤,导致包膜广泛破裂和塌陷。TICO NPs在光照射下的强大抗菌作用可能是由于PDT和CO在分解细菌细胞壁和质膜方面的协同相互作用,最终导致细菌细胞膜的收缩甚至破裂,染色结果进一步证实了这一点。
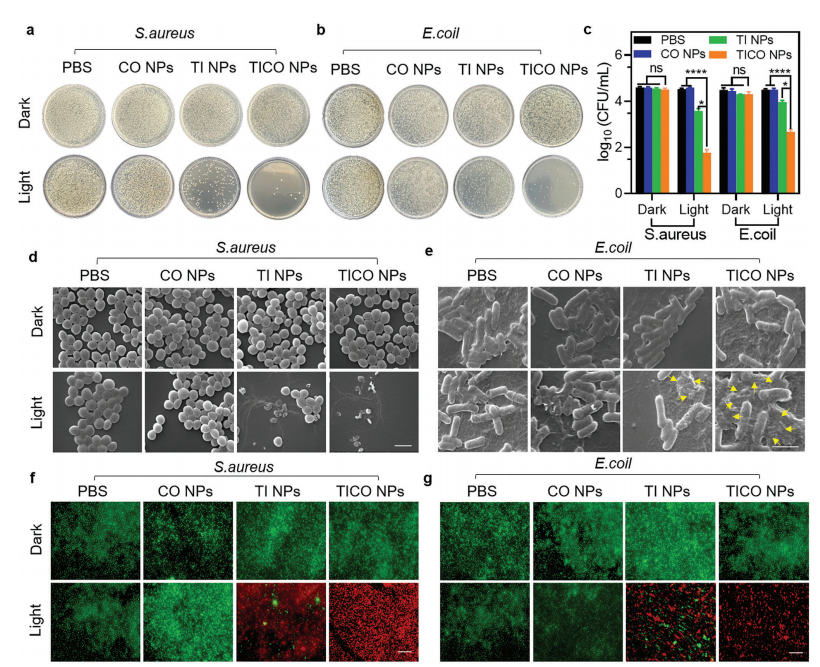
图5 TICO NPs的抗菌效果
4.TICO NPS用作MN贴片的基本特性
随后作者使用HA作为MN基质制造TICO NPS合并治疗学MN贴片。微针的制备过程如图6a所示。SEM观察到每个尖头锥体针高1000 μm,基宽500 μm,中心距550 μm。NPs的引入并没有改变MN的基本形态。与单独的HA MNs透明无色的外观相比,TICO NPs的加载导致针状颜色明显转向淡黄色。另外,与水溶液接触后,纳米颗粒迅速从衬底层分离,衬底层的完全分离仅在2分钟内实现(图6d-e)。
作者还进行了压缩试验以评估TICO@MN的机械性能,MNs的压缩力足以满足穿透角质层屏障所需的最小力(0.1 N)。离体皮肤穿刺实验表明MN贴片可以有效穿透真实皮肤和皮下组织(图6g)。对提取的皮肤组织进行血红素和伊红(H&E)染色,进一步证实MN已穿透角质层,进入表皮层,穿透深度约为≈150 μm(图6h)。CCK8试验所示,TICO@MN贴片也显示出高的细胞相容性(图6i)。通过利用机械渗透和控制释放的优势,MN贴片在按需透皮感染管理方面具有良好的潜力
。
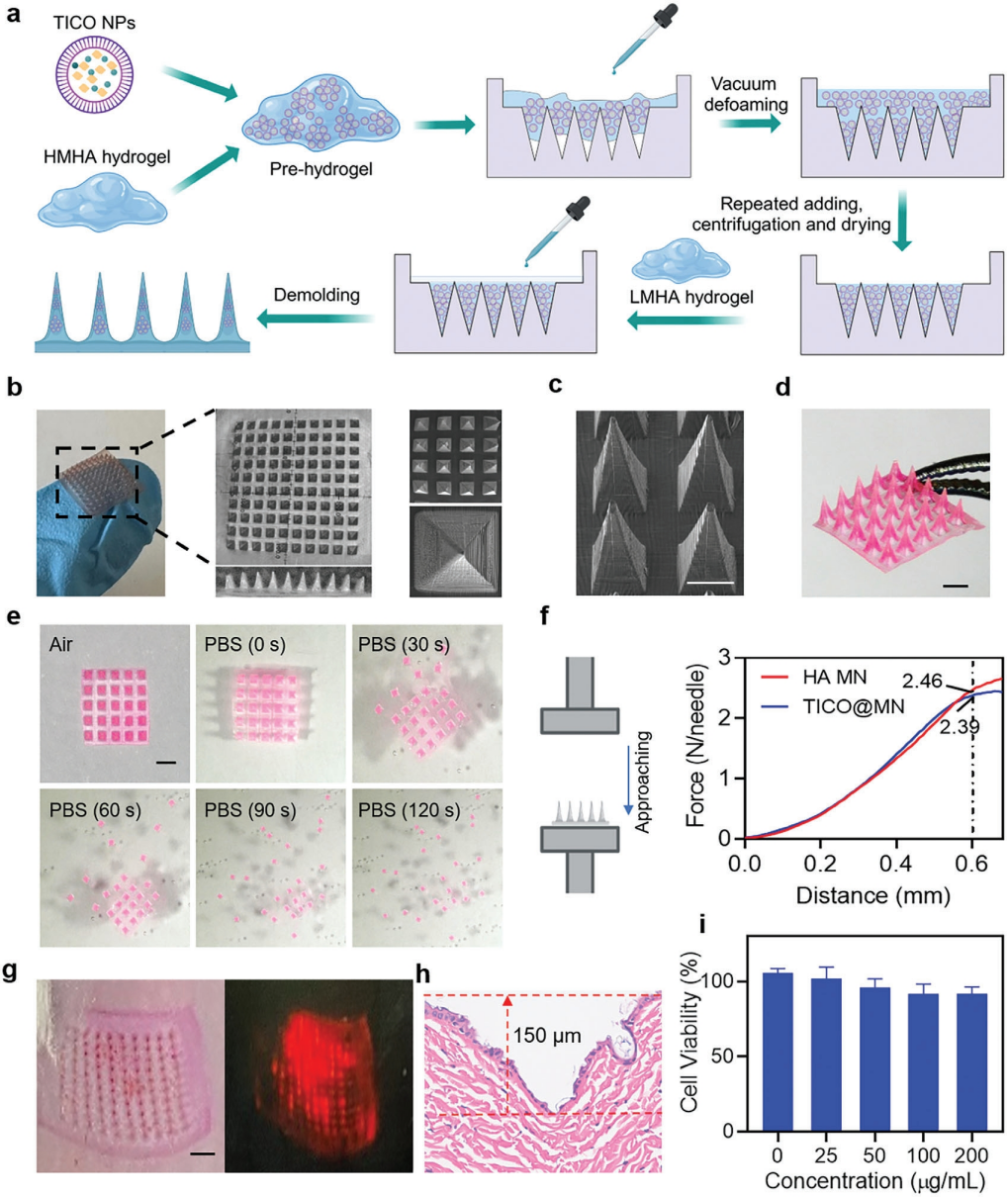
图6 微针贴片的基本特性
然后,作者进一步确认了包裹在纳米颗粒内的纳米探针保留了其pH响应传感和抗菌性能,同时在MN中加入TICO NPs并不会影响它们的pH感应能力(图7a)。作者检查了TICO@MN穿透和根除成熟生物膜及其嵌入细菌的能力,采用金黄色葡萄球菌生物膜作为候选模型来研究TICO@MN的抗生物膜功效(图7b-c)。
结果表明,利用PDT和CO气体治疗的综合效益,TICO@MN在光辐射下具有出色的生物膜破坏活性。为了进一步评估生物膜内细菌的生存能力,使用共聚焦激光扫描显微镜(CLSM)对生物膜内染色的活细菌进行了三维重建(图7d),在TICO@MN +光处理的生物膜内观察到微弱的局部绿色荧光,表明活菌明显减少。定量分析显示进一步证实了TICO@MN在光照下具有良好的除菌和抗生物膜效果(图7e)。

图7 TICO@MN的pH响应传感和抗菌性能
5.TICO@MN实时监测体内感染条件下pH变化
鉴于TICO@MN在体外具有显著的pH响应特性,作者使用小鼠伤口感染模型来评估其实时监测体内感染条件下pH变化的能力(图8)。在细菌接种后2、6、12和24小时的时间间隔内,将TICO@MN贴片植入感染伤口,评估其原位监测感染微环境的能力。将MN贴片轻压在创面上3分钟,使用IVIS连续监测MN贴片发出的荧光信号。值得注意的是,早在细菌接种后6小时,TICO@MN-applied伤口就出现了可识别的红色荧光信号。随着感染的进展,荧光强度逐渐增强,在感染后12 h达到峰值(图8b,c)。这些结果表明,TICO@MN可以成功地用于敏感的诊断感染,即使在早期阶段。此外,在较高初始细菌浓度诱导的严重感染部位检测到更明显的近红外荧光信号(图8d、e)。
因此,pH敏感TICO@MN显示出监测感染进展和实时区分不同感染严重程度的显著潜力
。
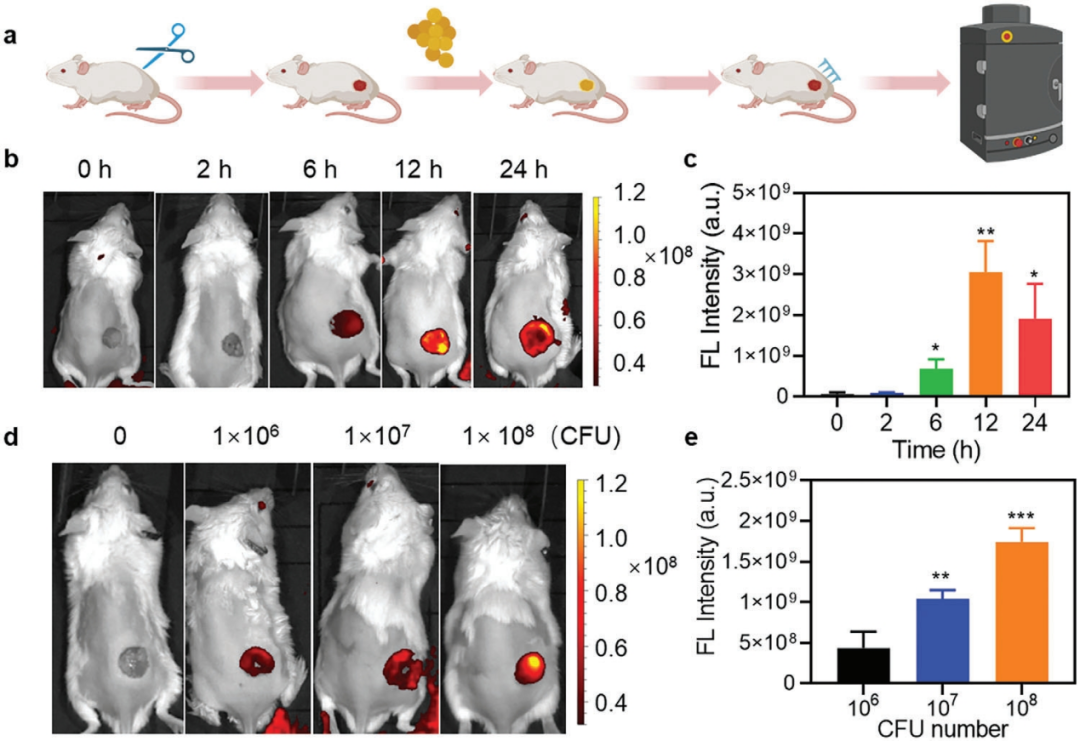
图8 TICO@MN实时监测体内感染条件下pH变化
由于在体外观察到良好的细菌根除效果,随后在小鼠皮下感染模型中评估了TICO@MN的抗菌和伤口愈合能力(图9)。
数码照片显示接受TI@MN +光照或TICO@MN +光照治疗的组溃疡减少,伤口愈合趋势明显(图9b)。根据创面愈合伪彩色图和定量创面面积分析(图9c),TI@MN +光照组创面闭合率达到约77%,用TICO@MN加光照治疗的感染伤口几乎完全愈合,治疗7天后仅观察到最小的疤痕。
TICO@MN +光处理与游离TICO NPs +光组相比,表现出更好的抗感染效果
。H&E和Masson染色显示TICO@MN +光处理组胶原沉积明显增加,表明组织修复有明显改善。此外,CD31免疫组化染色显示TICO@MN +光组创面区域新血管的形成增强。
为了直接评估不同配方的除菌效果,作者收集创面组织并均质,然后使用涂布板技术测定创面组织内的细菌负荷(图9e,f),定量菌落计数表明TICO@MN照射组超过96.3%的细菌被有效清除。采用酶联免疫吸附法(ELISA)定量评估感染组织中IL-6和TNF-rfs的水平(图9g、h)。这些结果表明TICO@MN +光处理介导的细菌快速有效的清除可以抑制创面炎症的繁殖,从而促进组织再生。
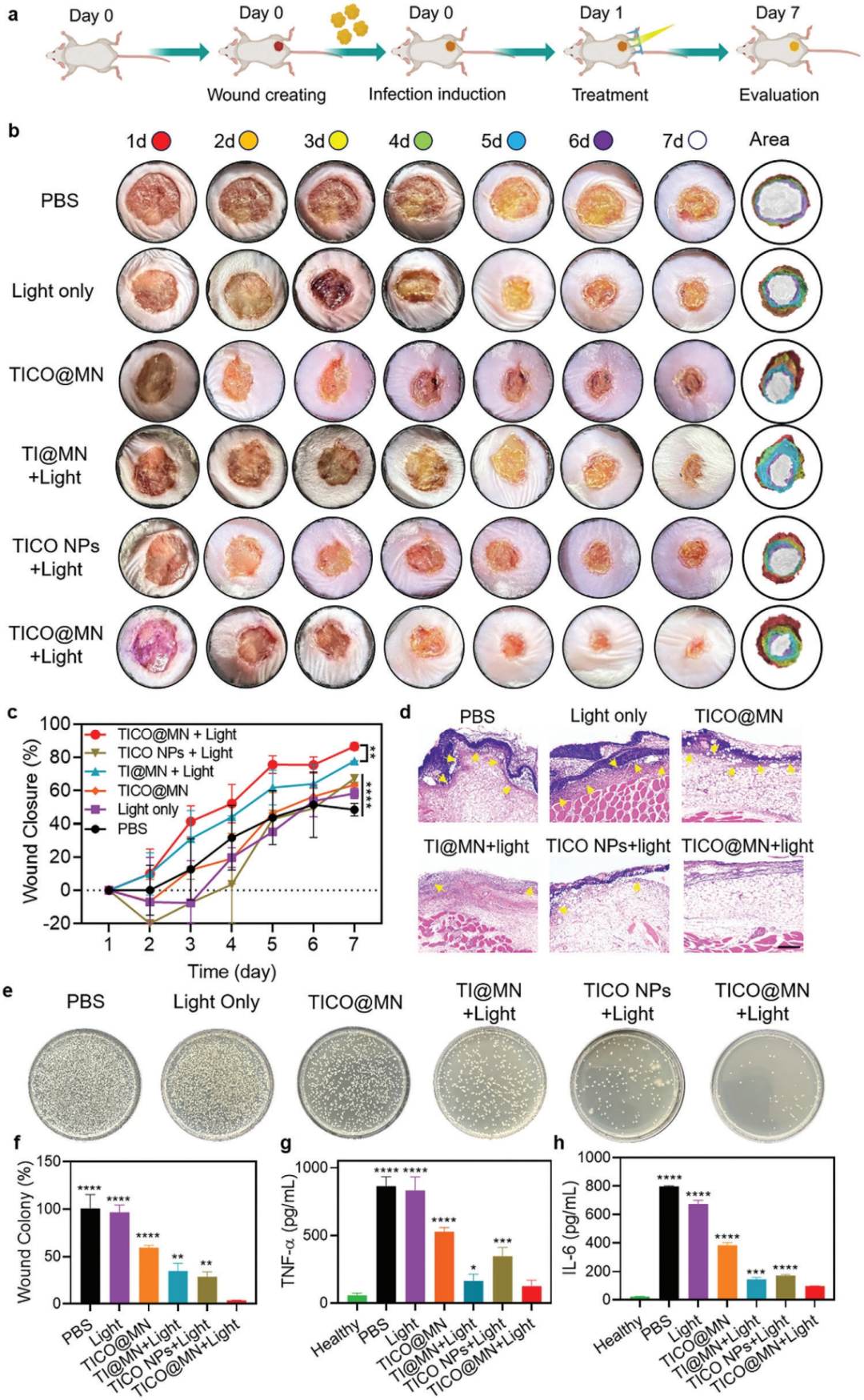
图9 TICO@MN的体内伤口愈合
综上,本文开创了一种治疗性的MN平台,该平台集成了感染微环境激活的实时成像和按需细菌消除功能。该方法包括设计和合成一种高性能的光治疗有机分子探针,名为TI,它具有弱酸pH响应近红外荧光发射和ROS生成能力。将疏水探针TI与ROS反应性CO供体共同组装,以形成高效的细菌纳米杀手,随后将其封装在HA基MN中。MN贴片增强了TICO NPs在皮下感染部位的机械渗透,然后根据细菌分泌的透明质酸酶降解释放纳米药物。当遇到产酸细菌时,TICO NPs发生动态的分子结构变化,导致明显的荧光输出。此外,研究显示TICO@MN加光照治疗可以减轻伤口的炎症反应,加速伤口愈合。这种智能MN系统可以实时监测伤口感染并提供按需、特定部位的治疗,为解决伤口感染提供了一种有希望的方法,同时减轻了抗生素耐药性带来的挑战。
参考资料:
https://doi.org/10.1002/adfm.202414834
来源:
EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






