本文是孔较瘦发布的
第205篇
原创文章
欢迎转发,欢迎留言交流
关注孔较瘦,非常有搞头


LDL-C水平升高与冠心病的关系,已被人们所熟知。但血脂异常包括很多亚类,其中,脂蛋白(a)水平升高也可能促进动脉粥样硬化。但仅有少数对照性临床试验评估了其临床意义。本文将总结Lp(a)的遗传学、结构和功能,以及与动脉粥样硬化性疾病间的关系,就这一血脂异常进行简单介绍。
结构和功能
Lp(a)是一种LDL,由一个大分子糖蛋白和两个apo(a)蛋白通过二硫键与apoB共价结合形成。Apo(a)链包含5个富含半胱氨酸的结构域,称为“kringles”。第4个kringle与纤溶酶原的纤维蛋白结合部位同源,纤溶酶原是一种血浆蛋白,激活后可溶解血凝块。
由于结构与纤溶酶原相似,Lp(a)通过与纤溶酶原竞争结合分子和细胞,妨碍纤溶酶原的激活,减少纤溶酶的生成,从而干扰纤维蛋白溶解。Lp(a)还可通过高亲和力受体与巨噬细胞结合,促进泡沫细胞形成以及胆固醇在动脉粥样硬化斑块内的沉积
。
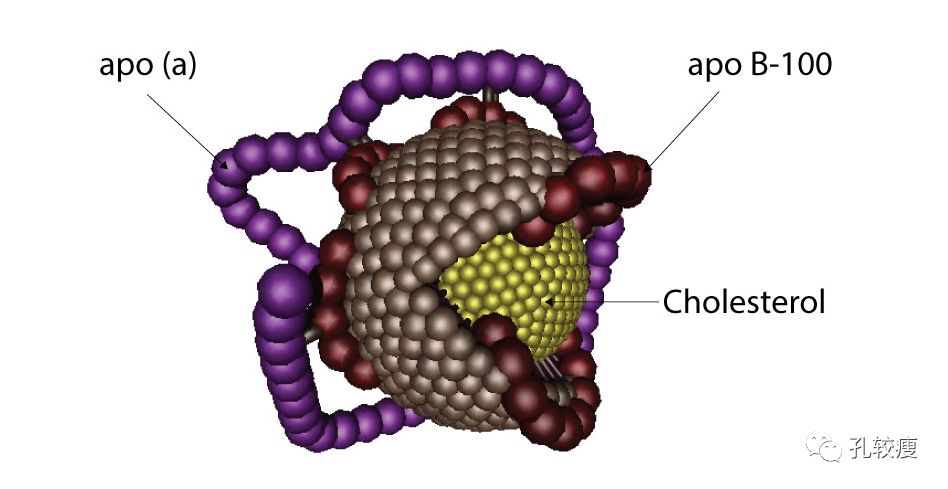
Lp(a)的结构示意图
遗传学
血清Lp(a)水平主要是由遗传决定的。
在无家族性高胆固醇血症的欧洲裔家族中,Lp(a)水平90%以上变异性可归因于apo(a)基因位点的多态性(亚型),这些基因位点也称为LPA基因。
Lp(a)的分布还存在种族差异。
非洲裔美国人的Lp(a)水平分布正常,然而,白种人、东亚和亚洲印度人群的Lp(a)水平分布则偏高,黑人的值比白人略高。
ASCVD
风险
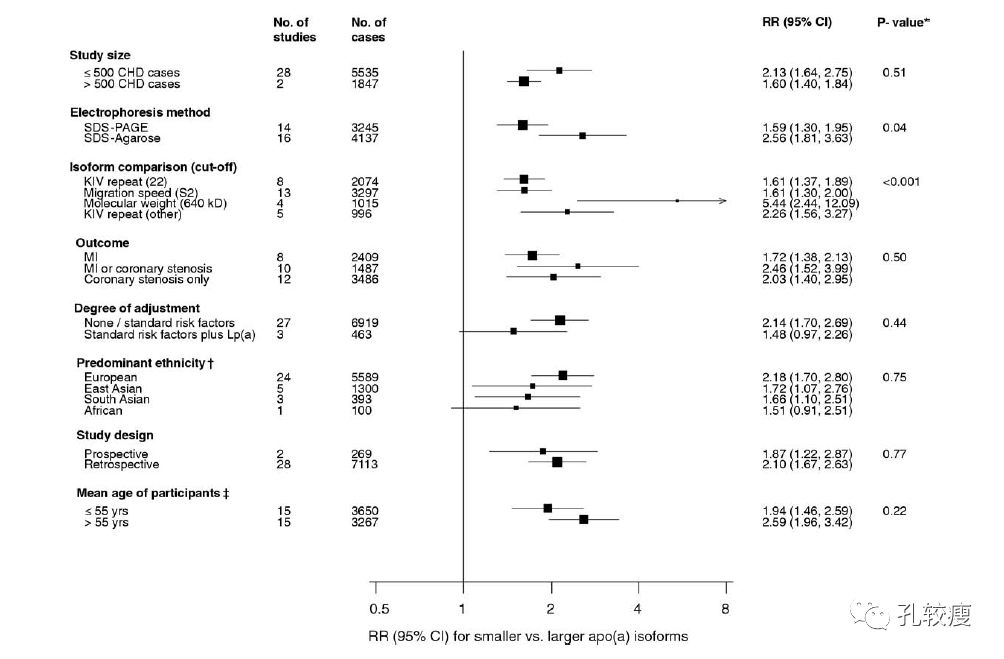
2009年一篇meta分析纳入了36项前瞻性研究中120,000多例参与者的记录,总结了Lp(a)与CVD的关系。该研究显示,Lp(a)与CHD风险之间承接关系。在所纳入的24项队列研究中,基线Lp(a)值上1/3和下1/3患者组的CHD发生率分别为5.6/1000人年和4.4/1000人年。
在校正了多个传统危险因素后,Lp(a)比正常水平每增加一个SD,CHD的RR是1.13(95%CI 1.09-1.18)。

Lp(a)与心血管事件的关系(点击图片可查看大图)
上述研究主要评估的是无确诊CVD的患者。
FOURIER研究纳入了接受他汀类治疗的CVD患者,比较了evolocumab与安慰剂,分析显示,相比于基线Lp(a)水平处在最低四分位数的患者,处在最高四分位数(>165nmol/L)的患者发生CHD死亡、MI或紧急血运重建的风险更高(HR 1.22,95%CI 1.01-1.48)。
另外,在早发CHD患者中,也常常检测到Lp(a)过量
。
 FOURIER研究中不同Lp(a)水平与心血管事件的关系
FOURIER研究中不同Lp(a)水平与心血管事件的关系
(点击图片可查看大图)
脑血管疾病
Lp(a)水平与脑血管疾病有关,这种相关性在男性中强于女性。一项meta分析纳入了来自56,010例受试者中超过4609次脑卒中事件的资料,发现Lp(a)升高是脑卒中的一个危险因素。另外一项Meta分析纳入了6项将缺血性脑卒中作为结局进行评估的研究,其相对危险度是2.14(95%CI 1.85-2.97)
。
荟萃分析中Lp(a)水平与脑血管事件的关系,其相对危险度是2.14(95%CI 1.85-2.97)。
(点击图片可查看大图)
高血压患者
在原发性高血压患者中,Lp(a)可能在靶器官损伤发生中起一定作用。在一项研究中,比较了277例未经治疗的高血压患者与102例健康对照者。研究发现,Lp(a)水平是对包括肾脏、心脏和动脉血管壁等靶器官损伤的最佳预测变量
。
动脉粥样硬化血栓形成的机制
●动脉粥样硬化病变部位的巨噬细胞上发现的极低密度脂蛋白受体,可结合并通过胞吞作用介导Lp(a)的分解代谢,使它在溶酶体中降解。这可导致脂质在巨噬细胞内的蓄积。
●结合到内皮和细胞外基质成份,以及受体介导的内皮刺激素血管舒张能力选择性破坏导致内皮功能障碍
。
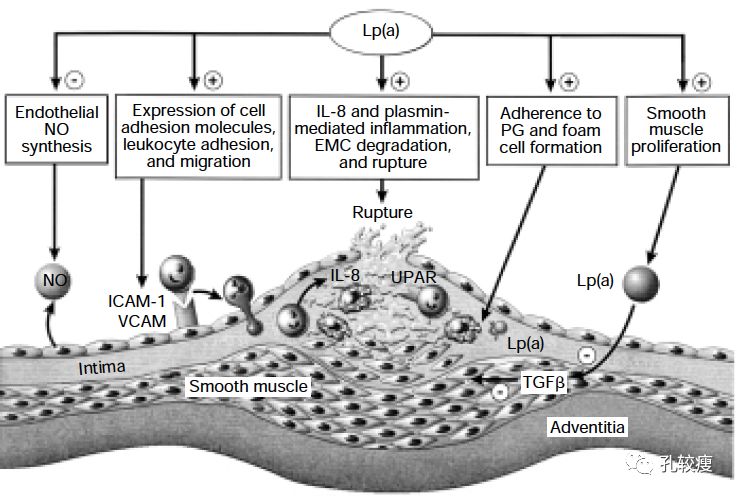
Lp(a)水平与动脉粥样硬化的关系示意图(点击可查看大图)
● 胞间黏附分子-1表达增加,导致单核细胞募集到血管壁并与巨噬细胞结合。这可促进泡沫细胞形成,以及Lp(a)在动脉粥样硬化斑块的沉积
。
● 增强LDL-C对氧化修饰的易感性
。
● 与纤维蛋白溶解系统和凝血系统相互作用,导致组织因子介导的血栓形成增加并抑制血凝块溶解
。

Lp(a)水平与血栓形成关系示意图(点击可查看大图)











