撰文|大牛
编辑|暖手
来源|细胞王国
我国是骨质疏松症患者人口大国,其中大多数为原发性骨质疏松症。积极深入探求病因,对治疗原发性骨质疏松症有重要意义。干细胞衰老及功能退化与骨质疏松症的发病密切相关。干细胞的衰老导致其增殖能力下降,成骨分化能力下降,成脂分化能力增强,骨矿盐沉积减少,进而导致骨细微结构破坏,整体骨质疏松。研究人员尝试将干细胞自体、同种异体或者基因修饰后移植到骨质疏松位点发现能够有效增加移植位点的骨量,提高骨密度,增强骨的机械强度,改善骨质疏松症状。通过干细胞移植增加骨量有望成为治疗骨质疏松症的新途径。
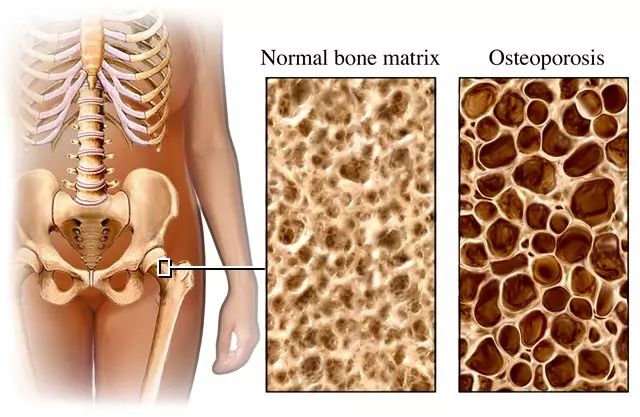
图片源自:www.81.cn
骨质疏松症(osteoporosis)是一种以骨量低下,骨微细结构破坏,骨强度降低和脆性增加为特点的全身性骨代谢疾病。国际骨质疏松基金会调查显示,全球50岁以上的人群中,约1/3的女性和1/5的男性出现了骨质疏松性骨折。2008 年发布的《骨质疏松防治中国白皮书》报告我国至少有7000 万人患骨质疏松症,2.1亿人骨量低于正常标准,存在骨质疏松的风险。预计在未来30年中,骨质疏松性骨折会占到所有骨折病例的一半以上。目前临床上骨质疏松症的治疗以药物为主,大致可分为四类:促进骨形成药,抑制骨吸收药,矿化作用药物及中药。临床上常用的药物多数为骨吸收抑制药,尽管能够延缓骨质疏松的进展,减少骨量的继续丢失,但并不能弥补已经丢失的骨量。
随着对干细胞研究的深入,人们开始探索利用其诸多优势从细胞水平甚至基因方面治疗骨质疏松症的可能。
原发性骨质疏松症细胞水平的发病机制的研究
间充质干细胞(MSCs)作为成骨细胞的前体细胞直接影响成骨细胞的质量和数量进而影响骨生成。研究发现骨质疏松症患者的MSCs 数量明显低于正常人,导致成骨细胞的数量也非常少。科研人员通过比较骨质疏松症患者和正常人的MSCs,发现骨质疏松症患者的 MSCs增殖速率降低,对胰岛素样生长因子(IGFs)应答反应减弱,细胞外基质中Ⅰ型胶原蛋白的生产能力下降,MSCs的碱性磷酸酶(ALP)活性降低,钙盐沉积减少。Zhou等发现老年性骨质疏松症患者的骨髓间充质干细胞(BMSCs)数量远远低于年轻人,细胞倍增时间是年轻人的1.7倍,与衰老相关的β-半乳糖苷酶的量是年轻人的4倍。Wang等研究发现绝经后骨质疏松症患者的MSCs增殖速度明显降低,且其成骨分化能力减弱,ALP活性低。
骨质疏松症患者往往伴随着骨髓脂肪含量的增高。研究发现原发性骨质疏松症患者不论是雌激素缺乏型还是老年型其 BMSCs成骨分化能力均受到了抑制,但成脂能力却加强了。研究发现Mir-27a对于BMSs的分化有至关重要的作用,BMSCs在成骨分化时Mir-27a表达会显著增加,成脂分化时表达则会降低。相比正常组,Mir-27a在骨质疏松症组中的表达相对较低。骨质疏松症患者骨髓中过量的脂肪细胞会分泌大量的TNF-α和IL-6,但是会抑制成骨细胞生成,干细胞的生存环境中各种因子的比例失调不利于BMSCs的成骨分化。
MSCs在成熟和分化的过程中会受体内多种激素的影响及转录因子和信号通路的调控。成骨细胞起源于MSCs,主要接受骨形态发生蛋白、TGF-β、胰岛素、神经传导物质、甲状旁腺激素、成纤维细胞生长因子(FGF)、Runx2转录因子、Wnt信号通路的正调控及阻黑体、硬化蛋白、IL-6和TNF-α的负调控。破骨细胞起源于单核造血干细胞,是目前已知的唯一促骨吸收细胞,其主要接受巨噬细胞集落刺激因子、RNAKL 的正调控及雌激素、骨保护蛋白(OPG)、IFN-γ的负调控。研究发现骨质疏松症患者和正常患者相比其血清和骨髓液中OPG和RANKL的比例明显下降,RANK被RANKL激活后能促进破骨细胞的分化和成熟。OPG通过结合破骨细胞分化因子(RANKL)减少前体破骨细胞的分化及成熟,抑制骨吸收。
由此推测微环境中调控MSCs分化的某些因子和信号通路的紊乱可引起干细胞的老化和功能的衰退,造成了骨代谢平衡失调,最终引起骨质疏松症。
图片源自:stemcell.baike.com
干细胞移植的进展
研究发现MSCs除了有自我更新和多系分化的一般干细胞生物学性质外,还具有免疫调节、造血支持和分泌多种生物活性物质的特殊能力,干细胞来源广泛,存在于多种组织中。体内外实验显示干细胞可以分化为多种细胞系,包括脂肪细胞、成骨细胞、肌腱细胞、软骨细胞、心肌细胞、神经细胞、基质细胞等,使MSCs成为组织工程的首选。
1. 单纯干细胞移植:研究人员尝试将干细胞注入到骨质疏松症患者骨髓中,通过补充干细胞的数量,提高成骨细胞的分化以促进骨形成,取得了比较满意的结果。将干细胞与藻酸钙凝胶混合后用骨髓穿刺针自体注射到去势后骨质疏松家兔的股骨远端,术后8周发现注射区域骨密度(BMD)开始增加,12周时BMD达到正常兔的88%,显著高于对照组。Micro-CT显示注射区域出现密集的骨小梁结构和增厚的骨皮质,治疗期间未见明显的炎症反应和坏死。研究发现MSCs的自体移植治疗骨质疏松症有明显的效果,但是骨质疏松症患者的MSCs往往伴随着增殖分化能力低下的特点,因此同种异体移植MSCs成为研究者新的尝试途径。Ocarino等在骨质疏松大鼠的股骨远端注入了健康大鼠的BMSCs,用GFP示踪,术后8周发现GFP阳性的细胞出现在骨小梁中,组织形态学分析发现股骨远端骨小梁面积百分数几乎达到了正常大鼠水平。Feng 等用骨质疏松症大鼠行同种异体骨髓移植(BMT),术后3个月观察到BMT大鼠的造血系统和淋巴系统已经完全恢复,骨小梁的数量增加,骨矿物质含量已达到健康大鼠的水平,大鼠的骨质疏松情况得到明显改善。
2. 基因修饰的MSCs移植:研究发现单纯MSCs移植能有效治疗局部骨质疏松,但不同年龄段人群的MSCs的增殖分化存在差异,目前学者们致力于利用基因修饰技术增强 MSCs 成骨分化能力的探索。
骨形态发生蛋白(BMP)属于TGF-β家族,具有强大的促成骨活性,目前已用于治疗新鲜骨折、骨不连、骨缺损、脊柱融合等疾病。Jiang等通过阳离子脂质体把BMP-9基因转染到MSCs,被转染的MSCs与PLGA形成复合体,复合体被移植到了骨质疏松的兔子体内,术后8周与对照组相比发现转染组出现了更明显的钙结节,电镜下骨小梁密集程度更高,小梁间距更窄,皮质区钙盐大量沉积,表明被转染的MSCs拥有更强的成骨分化能力和骨形成能力。
RANKL由成骨细胞表达,而RANK由破骨细胞及其前体细胞表达,RANK被RANKL激活后能够促进破骨细胞的成熟及分化,促进骨吸收,但RANK-Fc能够对抗RANKL抑制破骨细胞的活化。Cho等用反转录病毒转染MSCs,使其过度表达RANK-Fc并示踪,然后将其静脉注射到绝经后骨质疏松的大鼠体内,8周后检测发现骨吸收被明显抑制,并产生钙结节,骨量得到明显的改善。
待解决的问题
1. MSCs移植的实际操作问题:MSCs 治疗骨质疏松症是一项复杂的工程。因为要采集供体富含MSCs的组织,在体外分离,培养,纯化,扩增达到治疗数量的干细胞,直接或者经过处理加工后植入到患者体内,其间还涉及干细胞的冷冻保存和临床应用前的细胞复苏等复杂过程。这一系列体外操作过程全程要求无菌,否则会因外源性的污染导致治疗失败。
在gmp实验室内制备干细胞

图片源自:www.eubio.com.cn
2. MSCs 移植的经济问题:传统的骨质疏松症治疗药物已经给骨质疏松症患者带来了沉重的负担,MSCs移植能否在提高疗效的同时控制成本,也成了人们关注的问题。培养MSCs的耗材价格昂贵,需要专业的技术人员在特定的无菌环境中操作, 这些都会增加治疗成本。MSCs 移植治疗骨质疏松症能否在临床推广成为常规治疗方法值得思考。
展望
我国不仅是人口大国,而且是老年人口大国。随着我国人口老龄化的加速进展,老年人口数量还在增加。骨质疏松症及其并发症严重危害着人们的健康,带来了沉重的经济压力和社会负担,有效治疗骨质疏松症已刻不容缓。MSCs移植治疗骨质疏松症一定程度上具备了理论上优势,随着骨质疏松症细胞层面发病机制研究的深入,相信伴随着科技的进步和经济的发展,人们会攻克研究中出现的问题,使MSCs移植治疗骨质疏松症成为安全、有效的治疗方法。















