投资要点:
2021
年中国伴随诊断市场空间预计
50
亿,寻找小而美行业的领头羊。
伴随诊断与靶向药结合使用能有效提高靶向药的治疗效果。可以确认谁受益,谁有风险,并且通过监控药品的疗效来调整治疗方案。根据
Visiongain
的测算,
2021
年伴随诊断器材和诊断试验服务的市场价值估值将达到
113.6
亿美元,
2015
年
-2021
年的复合增长率为
22%
。
Visiongain
预计,到
2021
年,除欧美以外的其他地区占比有望上升,届时中国的市场份额预期可达到
6.5%
,测算下来中国伴随诊断市场大概
50
亿元。根据
2018
年
5
月
9
日艾德生物投资者关系活动记录表,艾德生物在中国院内市场占有率大约在
60%-70%
。
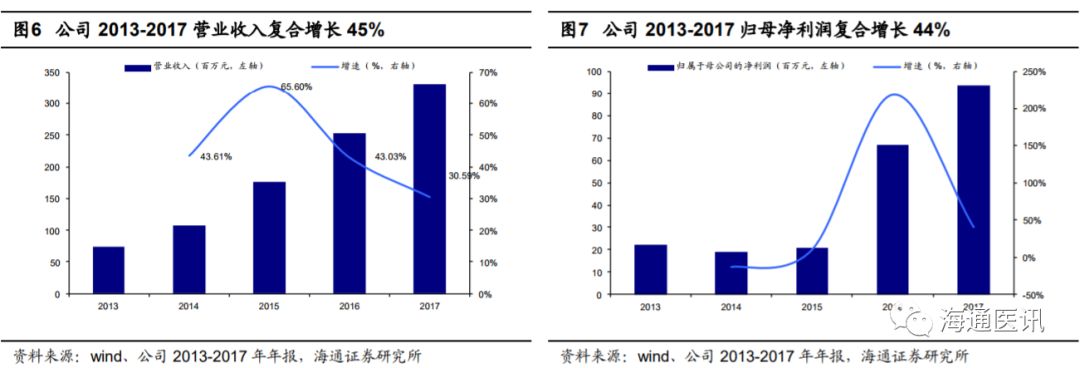
我们认为伴随诊断行业是个小而美的行业,龙头公司艾德生物
2013-2017
年公司营业收入稳步上升,
2013-2017
年公司收入复合增速
45%
,保持了较快的发展,考虑到
2017
年收入端基数低(
3.3
亿元),且
2018
年获批三种新产品有望贡献业绩增量,我们判断公司依然处于高速成长期。
PCR
技术仍然是伴随诊断的主导技术,伴随诊断技术会逐步从
PCR
(单基因或者几个基因,某个癌种)过渡到
NGS
(向多基因,跨癌种发展)。
我们认为,目前
PCR
技术仍然是伴随诊断的主导技术(目前需要检测的靶点通常不超过
10
个),主要集中在非小细胞肺癌、结直肠癌和乳腺癌等。我们认为,未来随着相关审批的推进,会有更多靶向药获批上市,给相应的伴随诊断产品提供广阔的市场空间。随着
NGS
的发展及价格的下行,伴随诊断技术会逐步从
PCR
(单基因或者几个基因,某个癌种)过渡到
NGS
(向多基因,跨癌种发展)。现阶段(
3-5
年)伴随诊断还是以
PCR
技术为主。
公司打造肿瘤基因检测整体解决方案,
2013-2017
年公司收入复合增速
45%
,保持了较快的发展。
公司拥有行业内国际领先、完全自主知识产权的
ADx-ARMS®
、
Super-ARMS®
、
ddCapture®
技术,基于核心技术的优势,公司陆续研发了
21
种单基因或者多基因联合检测试剂,多为我国首批取得国家药监局(
NMPA
)医疗器械注册证书和通过欧盟
CE
认证的产品。如适用于肿瘤组织标本检测的
ARMS
产品线,适用于液体活检的
Super-ARMS
产品线,适用于
10
个基因以上检测需求的
NGS
产品线,此外还有
FISH
、
IHC
、数字
PCR
、核酸提取等产品线,可以满足所有肿瘤基因检测的临床需求。从癌种角度,对应目前具备精准医疗条件的肺癌、结直肠癌、乳腺癌、卵巢癌、甲状腺癌、黑色素瘤等,艾德都有齐全、领先的检测产品。如在肺癌领域,艾德通过适应不同标本类型的单基因、多基因检测产品实现全程化管理。
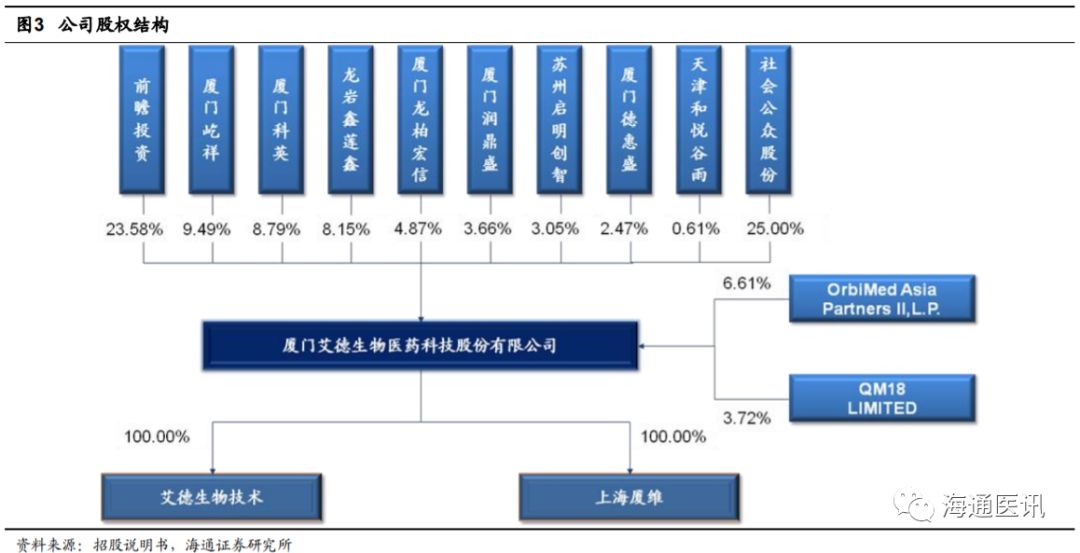
公司实际控制人为董事长郑立谋先生,注重研发,员工激励充分。
公司实际控制人是董事长兼总经理郑立谋先生,控股股东前瞻投资(郑立谋持有
84.64%
,郑立谋之子持有
15.36%
)持有公司
23.58%
的股权。郑立谋先生现任公司董事长、总经理,美国国籍,博士学历,
“
千人计划
”
国家特聘专家,正因为如此,公司非常重视研发,
2014
年至
2017
年,公司研发投入分别为
2039.65
万元、
3377.74
万元、
4931.31
万元、
5082.81
万元,占当期营业收入的比重分别为
19.10%
、
19.10%
、
19.54%
、
15.39%
。持续的研发投入为公司创新能力提升提供了有力保障。公司激励到位,厦门润鼎盛是员工持股平台,
71
名合伙人均为公司员工,部分为董事、监事、高级管理人员。部分员工还通过厦门科英、厦门屹祥以及厦门德惠盛持有公司股份,公司通过股权激励绑定了人才,利于未来长期发展。
看好公司
PCR
产品线产品迭代推动业绩快速增长
。
针对院内检测最普及的
PCR
平台,艾德生物率先开发出
EGFR
、
ALK
、
ROS1
、
KRAS
、
BRAF
、
EGFR/ALK/ROS1
、艾惠健等单基因、多基因检测产品。
2018
年
1
月公司获批人类
EGFR
突变基因检测试剂盒(多重荧光
PCR
法,适用于液体活检),根据
NCCN
指南及专家共识,目前临床上组织检测是金标准,在难以获得组织标本的情况下,液体活检可以作为补充。
2018
年
8
月公司再度获批
“
艾惠健
”
,该试剂盒覆盖了肺癌已上市及未来
3-5
年潜在上市靶向药物所有的核心基因靶点,将助力临床,实现在最短的时间、用最少的样本让患者从精准医疗中获益。以肺癌精准治疗为代表的分子检测临床需求逐渐从单基因过渡到多基因,从静态的检测过渡到动态的检测,从单一的组织检测过渡到多种临床标本的检测,其中不变的临床诉求是准确、快速和合规。基于多技术平台,艾德生物围绕临床需求,陆续开发出一系列率先获批的肿瘤基因检测产品及伴随诊断试剂,打造肿瘤精准医疗伴随诊断整体方案解决平台。
看好公司未雨绸缪,布局
NGS
领域,打造高端解决方案。
NGS
平台,艾德生物获批伴随诊断产品人类
10
基因突变联合检测试剂盒(可逆末端终止测序法)。
2018
年
7
月
23
日,燃石医学的
“
人类
EGFR/ALK/BRAF/KRAS
基因突变联合检测试剂盒
”
成功获批,拿下了中国肿瘤
NGS
第一证。诺禾致源、南京世和、艾德生物紧随其后,分别于
2018
年
8
月
13
日,
9
月
30
日,
11
月
20
日取得了基于
NGS
技术的伴随诊断产品的准产批件。前三项获批伴随诊断产品针对
EGFR
、
ALK
等基因突变,主要适应症均为非小细胞肺癌,可配合使用的靶向药物包括吉非替尼、盐酸埃克替尼、甲磺酸奥西替尼、克唑替尼。艾德生物获批的伴随诊断产品人类
10
基因突变联合检测试剂盒(可逆末端终止测序法)在前三家产品的基础上更进一步,不仅纳入了
10
个基因的检测,还首次将结直肠癌纳入了检测范围,可配合西妥昔单抗注射液进行治疗,成为了国内首个跨癌种的
NGS
检验产品。
其他未来新增长点展望
:
公司的人类
BRCA1
基因和
BRCA2
基因突变检测试剂盒(可逆末端终止测序法)已进行到注册发补阶段。我们认为该产品
2019
年有望上市销售,贡献全新的市场增量,同时还有望依靠该产品打包组合带动因缺少先发优势而表现平平的
HER-2
基因扩增检测试剂盒的销量。
ROS1
基因融合检测试剂盒分别于
2018
年
10
月、
12
月在韩国、中国台湾获批。我们认为海外营收占比正逐年提升,
2018
年全年预期海外营收占比超过
10%
。此外由于海外市场销售、管理等费用较低,我们认为海外的净利率相对大陆更高。今年
ROS1
产品有望进入韩国医保,届时会贡献更多业绩。
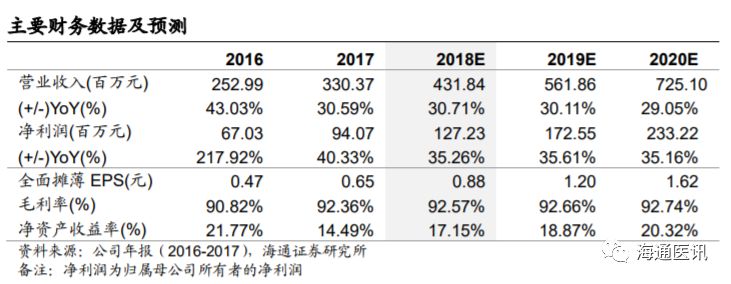
盈利预测。
公司打造肿瘤基因整体解决方案,以目前肿瘤精准医疗应用最成熟的肺癌为例,适应各种不同的肿瘤标本类型,如手术组织标本、穿刺小标本、细胞学标本、血液标本等,少于
10
个基因的检测需求,公司通过
PCR
产品满足,多于
10
个基因的检测需求,公司通过
NGS
产品满足。我们预计公司
2018-2020
年实现归母净利润分别为
1.27
亿元,
1.73
亿元,
2.33
亿元,同比增速分别为
35.26%
,
35.61%
,
35.16%
,分别实现
EPS 0.88
元、
1.20
元、
1.62
元。考虑到行业可比公司
2019
年平均估值为
36.18X
,给予
2019
年
35X-45XPE
,对应合理价值区间为
42.00-54.00
元,给予
“
优于大市
”
评级。
风险提示。
成长性风险,新品研发风险,新品上市推广风险。



1. 寻找小而美的伴随诊断领头羊
1.1 筛选合适用药人群,为精准医疗保驾护航
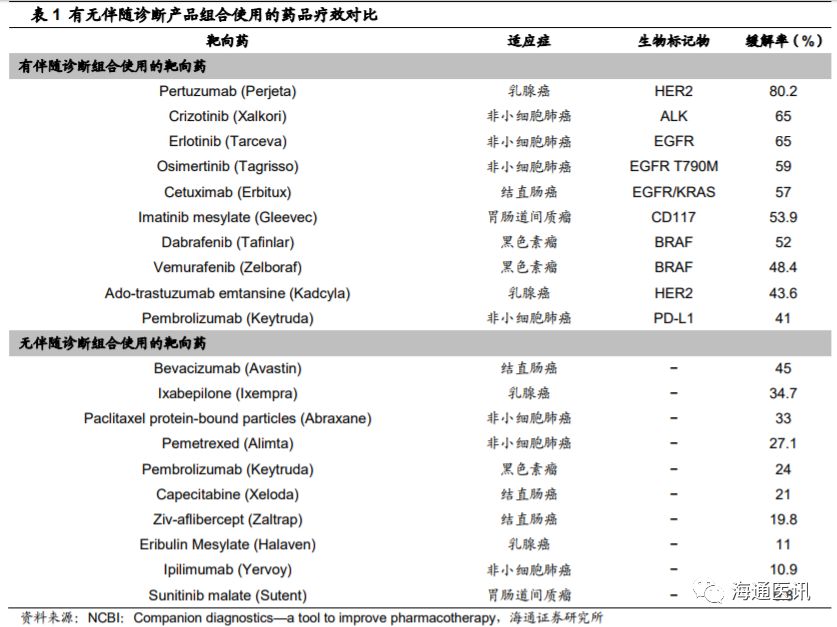
靶向治疗与伴随诊断是实现精准医疗的两大重要工具。伴随诊断是与特定药物的临床应用相关联的一类体外诊断技术,主要通过检测对某种特定药物临床反应具有相关性的基因、蛋白等生物标志物的水平或特征,在不同类型的疾病人群中筛选出最佳用药人群,有针对性地进行个体化医疗。
伴随诊断与靶向药结合使用能有效提高靶向药的治疗效果。
具体而言,
伴随诊断可
以做以下三件事情:
1
)
谁受益:
确定哪些患者是某种特定疗法的最可能受益群体。
2
)
谁有风险:
确定患者在接受某种特定疗法后可能产生的严重的副作用;
3
)
通过监控药品的疗效来调整治疗方案
,从而改善治疗的安全性和有效性。
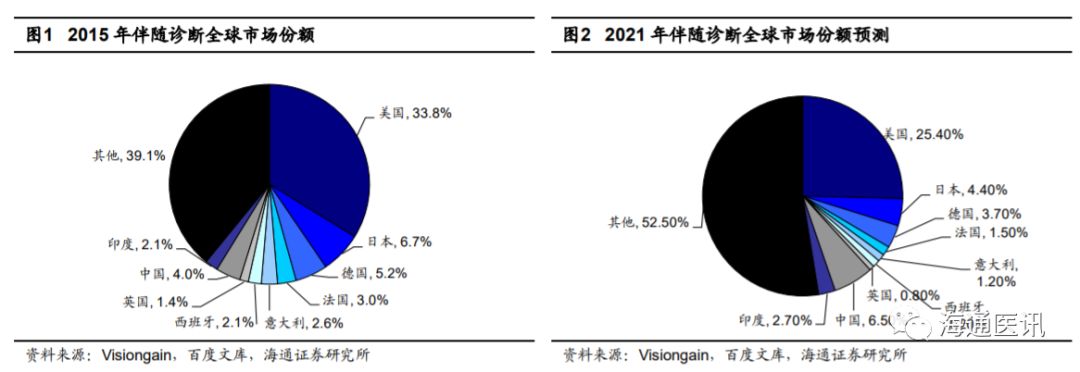
1.2 小而美的伴随诊断行业寻找基数小,新产品迭代上市时期的领头羊
截止
2015
年,就全球范围来看,伴随诊断行业主要集中于以美国为代表的西方市场。根据百度文库报道的
Visiongain
的伴随诊断及个性化治疗市场研究报告数据,
2015
年
-2021
年总体伴随诊断市场年复合增长率为
22%
,预计
2021
年,伴随诊断器材和诊断试验服务的世界市场价值估计将达到
113.6
亿美元
2015
年伴随诊断市场份额占比前三的国家分别为:美国(
33.8%
)、日本(
6.7%
)、德国(
5.2%
),中国市场仅占全球市场份额的
4%
。此外,估计由于疾病、人口等带来的巨大需求以及行业的发展,到
2021
年,除欧美以外的其他地区占比有望上升,届时中国的市场份额预期可达到
6.5%
。根据
Visiongain
的估计测算,预计截至
2021
年中国伴随诊断器材和诊断试验服务的市场价值估计将达到
50
亿元。根据
2018
年
5
月
9
日投资者关系活动记录表,艾德在中国院内市场占有率大约在
60%-70%
。
我们认为伴随诊断行业是个小而美的行业,龙头公司艾德生物
2013-2017
年公司营业收入稳步上升,
2013-2017
年公司收入复合增速
45%
,保持了较快的发展,考虑到
2017
年收入端基数低(
3.3
亿元),且
2018
年获批三种新产品有望贡献业绩增量,我们判断公司依然处于高速成长期。
2. 公司打造肿瘤基因检测整体解决方案
公司主营业务系肿瘤精准医疗分子诊断产品的研发、生产及销售,并提供相关的检测服务。公司产品主要用于检测肿瘤患者相关基因状态,为肿瘤靶向药物的选择和个体化治疗方案的制定提供科学依据。公司是肿瘤精准医疗分子诊断领头羊,同类竞争对手有益善生物、雅康博、源奇生物等。公司拥有行业内国际领先、完全自主知识产权的ADx-ARMS®、Super-ARMS®专利技术,国内首批获得NMPA和欧盟CE认证的最齐全的肿瘤精准诊断产品线。在国内外室间质评(EMQN、PQCC等)中,公司产品连续多年保持优异的准确率和极高的使用率。
2.1 实际控制人为学术带头人,重视研发,员工激励到位
公司实际控制人是董事长兼总经理郑立谋先生,控股股东前瞻投资(郑立谋持有
84.64%
,郑立谋之子持有
15.36%
)持有公司
23.58%
的股权。郑立谋先生现任公司董事长、总经理,美国国籍,博士学历,
“
千人计划
”
国家特聘专家,正因为如此,公司非常重视研发,
2014
年至
2017
年,公司研发投入分别为
2039.65
万元、
3377.74
万元、
4931.31
万元、
5082.81
万元,占当期营业收入的比重分别为
19.10%
、
19.10%
、
19.54%
、
15.39%
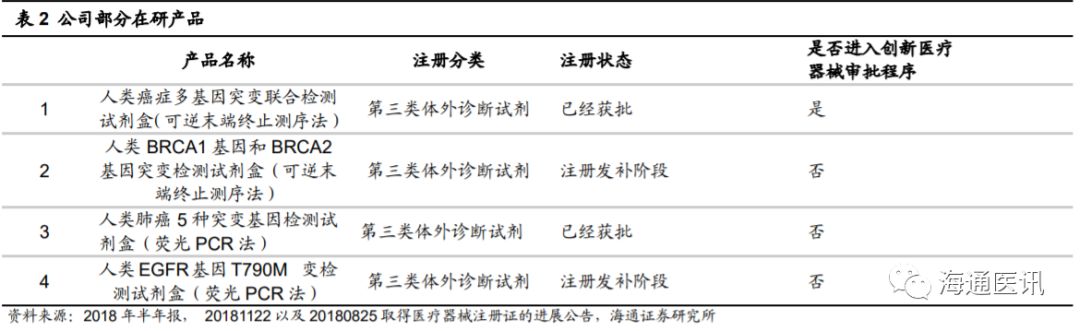
。持续的研发投入为公司创新能力提升提供了有力保障。目前人类癌症多基因突变联合检测试剂盒(可逆末端终止测序法)、人类肺癌
5
种突变基因检测试剂盒(荧光
PCR
法)、人类
EGFR
突变基因检测试剂盒(多重荧光
PCR
法)均于
2018
年获批,人类
BRCA1
基因和
BRCA2
基因突变检测试剂盒(可逆末端终止测序法)、人类
EGFR
基因
T790M
突变检测试剂盒(荧光
PCR
法)在注册发补阶段。
公司激励到位,厦门润鼎盛是员工持股平台,
71
名合伙人均为公司员工,部分为董事、监事、高级管理人员。部分员工还通过厦门科英、厦门屹祥以及厦门德惠盛持有公司股份,公司通过股权激励绑定了人才,利于未来长期发展。

2.2 业绩快速成长的肿瘤精准医疗龙头
公司具有自主知识产权的核酸分子检测技术(ADx-ARMS®、Super-ARMS®)是目前国际上肿瘤精准医疗分子诊断领域领先的技术之一,在肿瘤相关基因突变检测方面具有敏感、特异、简便、快捷的优点,适合于各种检测样本,并可用于多重基因高通量检测,达到行业公认的国际先进水平。
公司产品用于检测肿瘤患者相关基因状态,为肿瘤靶向药物的选择和个体化治疗方案的制定提供科学依据。针对目前肿瘤精准医疗最重要的 EGFR、KRAS、BRAF、EML4-ALK、PIK3CA、ROS1、NRAS、Her-2等基因位点,公司陆续研发了21种单基因或多基因联合检测试剂,多为我国首批取得国家药监局医疗器械注册证书和通过欧盟 CE认证的产品。2012-2018H1年公司主要收入来自产品模式,以2017年为例,当年检测试剂收入占比91.39%,检测服务占比8.48%,其中EGFR基因系列产品(包含EGFR单基因产品和EGFR/ALK/ROS1联检产品)收入占比45.89%。2018H1公司检测试剂业务实现营业收入18542万元,比上年同期增长38.74%,检测试剂收入占比91.57%。
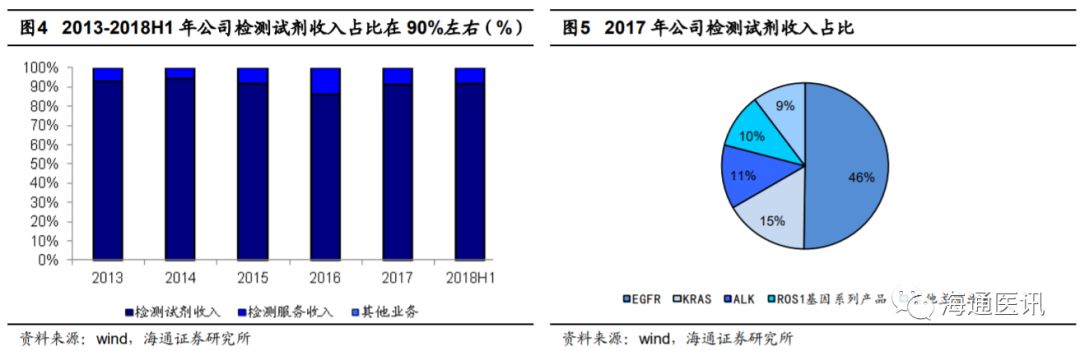
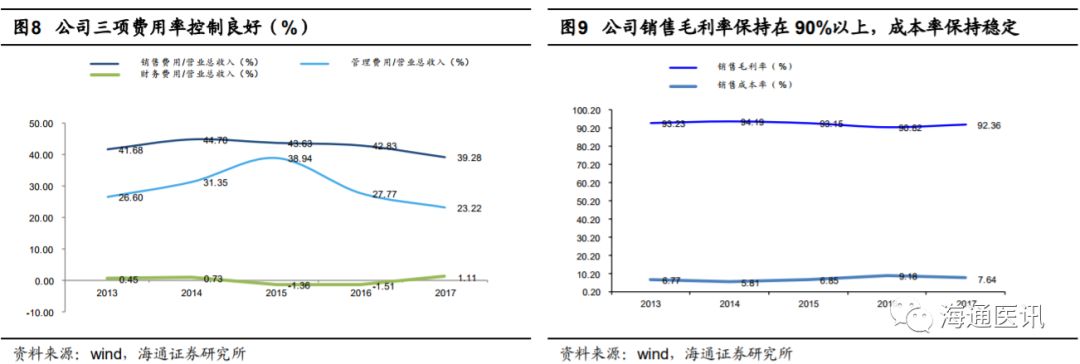
2013-2017
年公司营业收入稳步上升,
2013-2017
年公司收入复合增速
45%
,保持了较快的发展。公司销售模式为:直销与经销相结合,直销为主,经销为辅。直销
2018H1
年收入占比
69%
、经销
2018H1
收入占比
23%
。由于公司直销经销毛利率都保持在
90%
以上,整体毛利率也比较高,保持在
90%
以上。公司销售模式的选择符合产品特点和临床市场需求,并且直销对销售渠道的把控较经销更具优势,也符合医改
“
两票制
”
减少中间流通环节的政策导向。
在技术与产品优势基础上,公司构建了较为完备的营销体系,产品已进入 300 多家
大中型医院销售,成为了阿斯利康、辉瑞、默克、勃林格殷格翰等国际知名制药企业在
肿瘤分子诊断技术领域的研发合作伙伴,赢得了良好的市场声誉和广泛的客户认可。
2.3
PCR产品线产品迭代推动业绩快速增长
ADx-ARMS®技术为公司自主研发的发明专利授权技术。该技术利用特异引物对突变靶序列进行高精准 PCR 扩增放大,并利用一种新型探针在实时荧光定量PCR平台上实现对样品DNA中突变的检测,具有极高的特异性和灵敏度,可准确检测出含量低至1%的突变DNA,适合石蜡包埋样本、新鲜组织和胸水、血清、血浆等样本的基因检测。
2018年1月19日,NMPA通过创新医疗器械特别审批通道,批准艾德生物的Super-ARMS®EGFR基因突变检测试剂盒,用于临床检测晚期非小细胞肺癌(NSCLC)患者血液ctDNA中EGFR基因突变状态,筛选适合接受一代至三代EGFR靶向药物治疗的患者。Super-ARMS®技术是艾德生物自主专利的新一代ctDNA基因突变检测技术,是ADx-ARMS®自主专利技术的革命性升级,延续了简便、快速、准确、易普及等优点,灵敏度高达0.2%,已被纳入液体活检临床专家共识。Super-ARMS®EGFR适用于一代到三代的EGFR靶向药物的检测需求,几乎涵盖所有突变位点。这是我国首个以伴随诊断试剂标准获批上市的ctDNA检测试剂盒,将开启肿瘤液体活检的新里程。Super-ARMS®EGFR基因突变检测试剂盒经过临床试验证实可指导EGFR靶向药物治疗,是NMPA首次参照FDA伴随诊断试剂标准审评的高品质、严格质控的伴随诊断产品。
2018年8月25日,公司公告5种突变基因检测试剂盒(荧光PCR法)获批,5种突变基因检测试剂盒(荧光PCR法)可检测包括EGFR、ALK、ROS1、KRAS、BRAF等基因在内的多个肺癌核心驱动基因。该试剂
盒覆盖了肺癌已上市及未来
3-5
年潜在上市靶向药物所有的核心基因靶点,将助力临床,实现在最短的时间、用最少的样本让患者从精准医疗中获益。我们认为以肺癌精准治疗为代表的分子检测临床需求逐渐从单基因过渡到多基因,从静态的检测过渡到动态的检测,从单一的组织检测过渡到多种临床标本的检测,其中不变的临床诉求是准确、快速和合规。基于多技术平台,艾德生物围绕临床需求,陆续开发出一系列率先获批的肿瘤基因检测产品及伴随诊断试剂,打造肿瘤精准医疗伴随诊断整体方案解决平台。
2.4 多基因联检以及液体活检技术将提高检测率
我国每年新发病的肺癌患者超过
73
万,肺癌
死亡
人数超过
61
万,且在持续增加。即便是早期发现,肿瘤进展中会不可避免地产生耐药,导致
疾病
进一步进展。
《晚期非小细胞肺癌患者外周血循环肿瘤细胞检测
5
例并文献复习》的数据显示,在我国,非小细胞肺癌患者约占肺癌病例总数的
85%
。
EGFR
突变是非小细胞肺癌
NSCLC
最为常见的肺癌基因突变之一,在亚洲,有大约
25%-50%
的
NSCLC
患者存在
EGFR
突变,中国拥有全世界最多的
EGFR
突变患者(突变率约
30%-40%
),人数占全球近一半。因此
EGFR
是靶向药物治疗的重要靶标。
EGFR
一线治疗必须进行
EGFR
基因突变的检测,国内外均推荐
EGFR
基因突变阳性的
NSCLC
(非小细胞(型)肺癌)给予
EGFR-TKI
一线治疗。目前,一代
EGFR
靶向药物有吉非替尼(易瑞沙)、埃克替尼(凯美纳)和厄洛替尼(特罗凯),均已广泛纳入我国医保,用于
EGFR
基因突变阳性患者的治疗。同时,大量患者在一代
EGFR
靶向药物治疗后会出现
T790M
耐药突变。我们预计接受当前
EGFR-TKI
治疗后病情进展的
EGFR
阳性
NSCLC
群体中,超过
50%
的患者产生
T790M
耐药突变,治疗选择十分有限,这些患者可以从三代
EGFR
靶向药物奥希替尼的治疗中获益。
大多数欧美发达国家都将基因检测纳入医保范围,这些国家的检测率基本都能达到
80-95%
。而沈阳市人大代表、辽宁省肿瘤医院肿瘤内科主任李晓玲预计中国北上广的检测率只有
40-50%
,二三线城市更低,只有
20-30%
。我们预计有两个原因,
1
,检测费用相对较高,
2
,组织取样不易,
3
,已上市可供选择的靶向药物种类较少。提升检测率必须从以上几个方面突破。
第一个突破口:从单基因检测到多基因联合检测、从组织检测到组织和血液检测并存是肿瘤伴随诊断的发展趋势。
随着作用于不同基因的靶向药物相继问世,关键驱动基因的同步检测已成为肺癌临床诊疗的
“
刚需
”
。美国病理学家协会
(CAP)
、国际肺癌研究协会
(IASLC)
和美国分子病理学学会
(AMP)
三大权威机构也在
2018
年对其共同发布的肺癌分子检测指南进行了更新,明确了有条件的实验室除检测必检基因
EGFR/ALK/ROS1
外,建议同时检测
KRAS/BRAF/MET/HER2/RET
等基因。目前公司现有的
EGFR
、
ALK
、
ROS1
、
KARS
、
BRAF
等品类增长势头良好,联检产品收入占比的提升也能提高检测率。
2018
年
8
月公司获批的
“
艾惠健
”
覆盖了肺癌已上市及未来
3-5
年潜在上市靶向药物所有的核心基因靶点,将助力临床实现在最短的时间、用最少的样本让患者从精准医疗中获益。随着新产品逐步推广,有望提振业绩。
第二个突破口:
晚期肿瘤患者组织取样不易,我们预计近一半患者因未能获得及时的检测而错失一线精准治疗的机会,
适用血液样本的
Super-ARMS®EGFR
基因突变检测可实现无创取样、快速检测,使更多患者快速获得精准治疗的机会。
另外,耐药复发患者再次组织活检难以实现,基于血液样本的基因检测就显得尤其重要。
第三个突破口:目前的组织检测主要是用药前的检测,虽然组织检测是金标准,但是面临三个问题。(
1
)部分患者无组织标本,或者无足够的组织标本进行基因分型;(
2
)肿瘤内具有异质性;(
3
)重复活检和动态检测均困难。血液检测会伴随患者用药情况进行,由于血液检测具有无创性,实时性,能够提供原发癌和转移灶的基因突变信息,能够实现更好的精准快速诊断。因此检测频次会增加,
我们预计血液检测一个患者一年检测
2~3
次。所有具有用药意愿的患者都需要进行检测。
另外,检测应用场景也会继续扩展:靶向治疗不可避免会产生耐药,因此检测需求不限于目前治疗前的病理检测。
我们预计未来会逐步扩展治疗前快检、治疗期间疗效、耐药检测和预后检测(血液、转移灶等),涉及病理、检验等多个科室。
所以我们预计公司未来还有可能通过不断地推广联检、液体活检等,比如将
EGFR
检测率提升到接近欧美国家渗透率水平:
70%-80%,
同时通过联检提高其他靶点的检测率,实现肺癌等癌种的精准诊疗。
2.5 看好公司未雨绸缪,布局NGS领域,打造高端解决方案
高通量测序技术又称“下一代”测序技术("Next-generation"sequencing technology),以能一次并行对几十万到几百万条DNA分子进行序列测定和一般读长较短等为标志。NGS在检测未知序列、未知突变、高通量多位点检测方面是更好的选择,与伴随诊断领域常用的PCR技术相比,适用于诸如BRCA等有上千个突变位点的靶点检测。NGS作为伴随诊断领域一大研发热点,2016年以来在美国已有4款产品获得FDA批准上市。
中国在
NGS
的研发上紧随美国的脚步,
2018
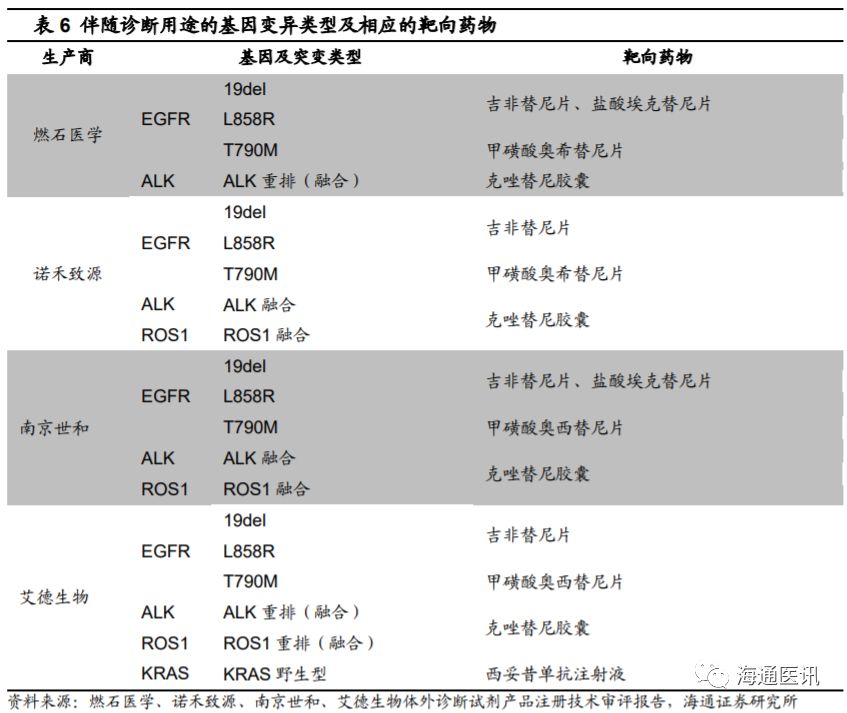
年,燃石医学、诺禾致源、南京世和、艾德生物的
NGS
伴随诊断产品相继获批,前三家公司的
NGS
产品均仅适用于非小细胞肺癌,针对
EGFR
、
ALK
以及
ROS1
上的基因突变,
艾德生物获批的伴随诊断产品人类
10
基因突变联合检测试剂盒(可逆末端终止测序法)在此基础上首次实现了跨癌种检测,纳入了
KRAS
野生型的检测以应对结直肠癌。
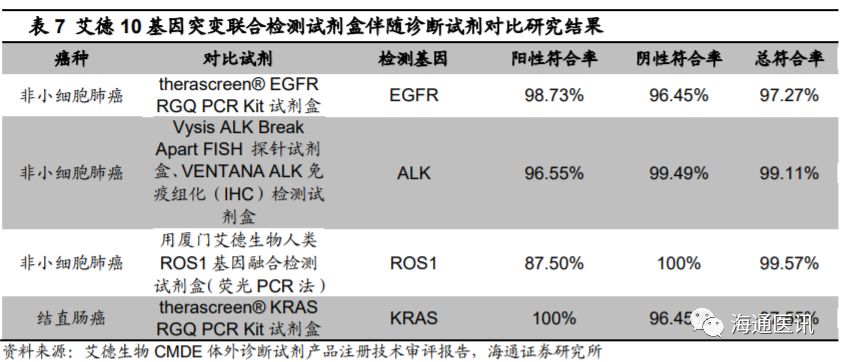
在检测精密度、灵敏度方面,公司的
10
基因突变联合检测试剂盒以
1248
例非小细胞肺癌肺癌、
295
例结直肠癌和
20
例干扰样本为临床评价样本,通过
Sanger
测序法进行对比研究,结果显示对于非小细胞肺癌,考核试剂的阳性符合率为
98.99%
,阴性符合率为
82.49%
,总符合率达到
92.95%
;对于结直肠癌考核试剂的阳性符合率为
100%
,阴性符合率为
94.36%
,总符合率达到
96.27%
,均显示出较好的检测一致性。
我们认为公司的
NGS
伴随诊断产品
10
基因突变联合检测试剂盒
作为
PCR
产品的重要补充,将主要运用于突变点位较多的基因检测以及肿瘤检测大
panel
平台。由于成本较高、操作复杂,并且存在融合基因阳性检出率低于
PCR
等技术瓶颈,未来伴随诊断几个技术平台将继续共存,且现阶段
(
3-5
年)伴随诊断仍将以
PCR
技术为主导。
2.6 重视与创新药企业战略合作,共同迈向产业未来
作为专业的肿瘤精准医疗分子诊断试剂研发生产商,公司得到了客户的广泛认可,成为了阿斯利康、辉瑞、默克、勃林格殷格翰等国际知名制药企业的肿瘤靶向用药分子诊断合作伙伴。公司在国际化合作方面一直动作不断,说明公司非常重视各大研发企业的最新研发进展,力求通过开发配套伴随诊断产品,共同迈向产业未来。
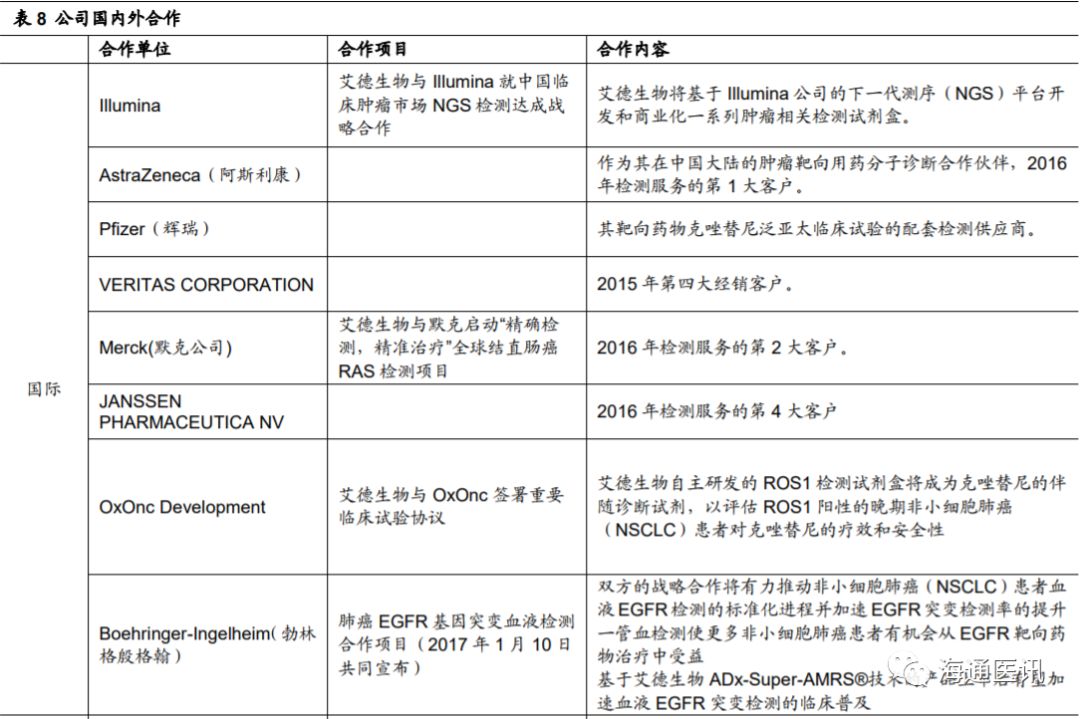
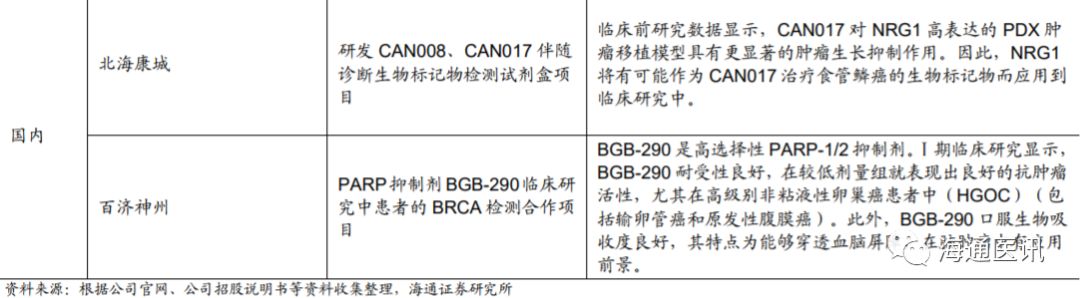
2.7 其他未来新增长点展望
2.7.1 BRCA1/2
基因伴随诊断即将上市














