▎药明
康德/报道
Gillead Sciences近日宣布,美国FDA授予其HIV感染鸡尾酒疗法bictegravir和emtricitabine/tenofovir alafenamide(FTC/TAF)
优先审评资格,预计不晚于2018年2月12日做出决定。

该疗法是一种在研固定剂量的单片剂治疗方案,包含
50 mg的整合酶链转移抑制剂bictegravir(BIC)和200 mg/25 mg的FTC/TAF骨架
,用于HIV-1感染者的治疗。Gilead在今年6月份向FDA提交了该疗法的新药申请,并获得了优先审评资格。
此次新药申请是基于其3期临床试验的优秀数据。
这些数据来自四个独立的研究
,它们都证明,该鸡尾酒疗法病毒抑制率高,在治疗初治患者的安全性和疗效上不劣于含有50 mg的dolutegravir(DTG)的治疗方案,到达了研究的主要终点。
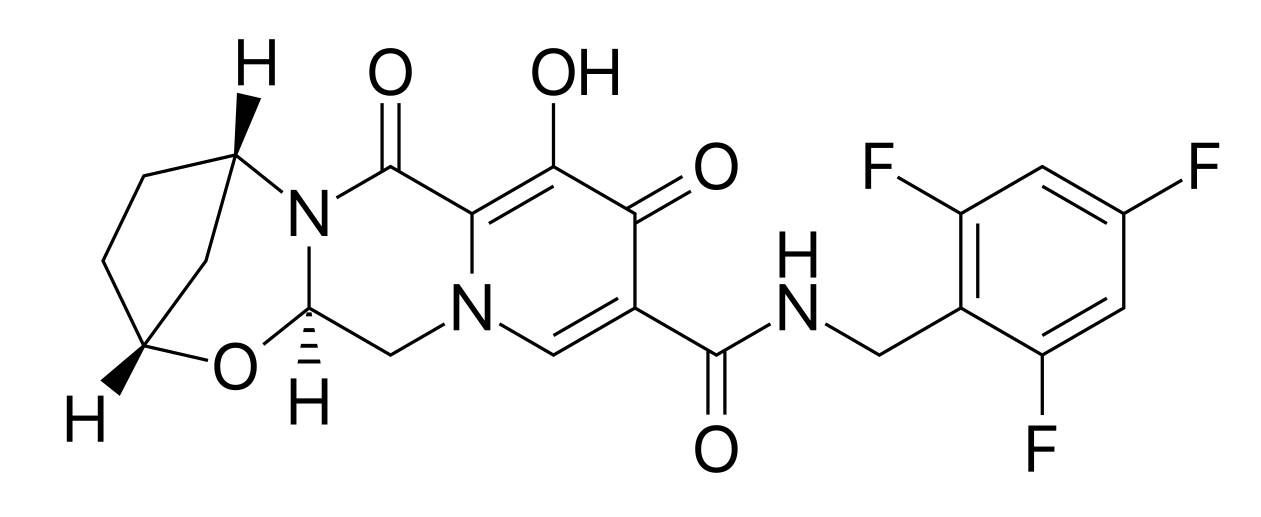
▲整合酶抑制剂bictegravir的结构式
(图片来源:维基百科)
“自从16年前Viread获批后,Gilead继续努力研发和改善对HIV患者的治疗。
这项在研单片剂治疗方案将整合酶抑制剂bictegravir的效力与已被证明的FTC/TAF骨架的疗效和安全性结合在一起。
”Gilead的首席科学官
Norbert Bischofberger博士说道。
除了寻求美国FDA的批准,Gilead Sciences也在寻求欧洲药品管理局(EMA)对BIC/FTC/TAF疗法的批准。
值得一提的是,这个月初美国FDA批准了Gilead的药物Epclusa的
扩大适应症申请
,用于HCV和HIV共感染成人患者的治疗。
我们期待着这一鸡尾酒疗法的获批能为HIV感染者带来新的治疗选择。
参考资料:
[1] Gilead (GILD)'s HIV Triple Combo Gets Sped-up FDA Review, Decision Date Locked Down
[2] Gilead Sciences官网







