
外泌体是一种存在于细胞外的多囊泡体,可通过细胞内吞泡膜向内凹陷形成多泡内涵体,内涵体与细胞膜融合后释放其中的小囊泡。外泌体的直径在40-110 nm之间,其中包含RNA、蛋白质、microRNA、DNA片段等多种物质,存在于血液、唾液、尿液、脑脊液和母乳等多种体液中。外泌体从发现至今已有30多年的历史,虽然最初被认为可能是细胞的“垃圾”,所以才被排出来,但是近年来研究表明外泌体具有功能活性并可进行细胞间信息传递。如今,研究已经发现外泌体在抗原提呈细胞中呈递抗原程中、肿瘤细胞发生发展、神经细胞信号转导过程中都发挥着重要作用。
本文内容整理自生物谷、生物帮、奇点网、药明康德等。
1.Cell:糖尿病研究新突破!脂肪组织巨噬细胞分泌的外泌体能够调节胰岛素抵抗性
doi:10.1016/j.cell.2017.08.035
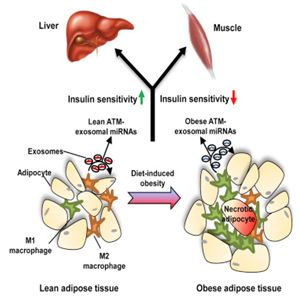
图片来自Cell, doi:10.1016/j.cell.2017.08.035。
由肥胖导致的慢性组织炎症是胰岛素抵抗性和2型糖尿病产生的一种根本原因。但是这种发生的机制在此之前一直是未知的。
在一项新的研究中,来自美国加州大学圣地亚哥分校和中国医学科学院/北京协和医学院的研究人员鉴定出外泌体(exosome)是其中缺失的一环。相关研究结果于2017年9月21日在线发表在Cell期刊上,论文标题为“Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity”。
论文通信作者、加州大学圣地亚哥分校医学院内分泌新陈代谢内科医学教授Jerrold Olefsky博士说,“当外泌体在组织之间迁移时,它们诱导的反应可能是导致糖尿病中的代谢错乱的细胞间通信的一种根本原因。通过对细胞进行荧光标记,我们能够观察到外泌体和它们携带的微RNA(microRNA, miRNA)从脂肪组织经过血液,渗透到肌肉组织和肝组织中。”
Olefsky团队获取在肥胖小鼠的脂肪组织中发现的巨噬细胞,并且收集它们分泌的外泌体。苗条的健康小鼠接受这些“肥胖的”外泌体的处理。他们发现尽管这些之前正常的小鼠并不会体重超重,但是它们也开始表现出肥胖诱导的胰岛素抵抗性。
当逆转这种过程时,Olefsky团队发现当利用来自苗条小鼠的外泌体处理肥胖小鼠时,他们能够恢复这些肥胖小鼠的胰岛素敏感性。这些肥胖小鼠保持体重超重,但是在代谢上是健康的。
类似地,在体外研究期间,当利用“肥胖的”外泌体处理人肝细胞和脂肪细胞时,这些细胞产生胰岛素抵抗性。相反地,当它们接受“苗条的”巨噬细胞外泌体处理时,它们对胰岛素高度敏感。
2.Nature子刊:中科院广州生物院陈小平研究组揭示疟原虫感染小鼠血浆外泌体抑制肿瘤血管生成的分子机制
doi:10.1038/oncsis.2017.52
2017年6月26日,国际学术权威刊物自然出版集团旗下子刊《Oncogenesis》杂志上在线发表了中国科学院广州生物医药与健康研究院陈小平课题组的最新研究成果“Exosomes from Plasmodium-infected hosts inhibit tumor angiogenesis in a murine Lewis lung cancer model”。研究首次发现疟原虫感染小鼠血浆外泌体(exosomes)能够抑制肿瘤血管生成,并初步阐明其分子机制。研究加深了对疟原虫感染宿主所分泌的外泌体与肿瘤血管生成之间的相互作用的认识,为开发疟原虫感染来源的外泌体作为一种新型抗肿瘤制剂奠定了基础。博士研究生杨一峻为论文第一作者,陈小平博士为论文通讯作者。
研究人员选用肺癌小鼠模型作为研究对象,从感染疟原虫的小鼠血浆中获得外泌体,并将这些外泌体注射到小鼠的肿瘤内部,并与没有疟原虫感染的小鼠血浆外泌体进行对照。研究发现,疟原虫感染小鼠的血浆外泌体显著抑制肿瘤血管的生成。进一步的研究发现,疟原虫感染的小鼠血浆外泌体通过至少四种特殊的微小RNA(miR16-5p/17-5p/322-5p/497-5p)抑制血管内皮细胞 VEGF受体(VEGFR2)的 表达从而阻断血管生成的信号通路。这些发现加深了人们对疟原虫抗癌机理的理解,并为疟原虫疗法治疗癌症的临床研究提供进一步的理论依据。
3.Nature:重大突破!利用靶向KRAS突变基因的外泌体治疗胰腺癌
doi:10.1038/nature22341
KRAS蛋白晶体结构,图片来自Thomas Splettstoesser/Wikipedia。
外泌体(exosome)是所有细胞释放出的病毒大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森癌症中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺癌治疗方法。相关研究结果于2017年6月7日在线发表在Nature期刊上,论文标题为“Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer”。论文通信作者为德州大学MD安德森癌症中心癌症生物学系研究员Raghu Kalluri博士。
在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺癌模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺癌细胞中的KRAS突变基因,从而影响多种胰腺癌模型的肿瘤负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括癌细胞)中。
作为一种分子通断开关的KRAS发生突变时会处于“开启”状态。在80%~95%的胰腺导管腺癌(PDAC)当中,这个基因发生突变,这也是这种癌症中最为常见的突变。这些研究人员证实iExosome能够运送特异性地靶向KRAS的siRNA和shRNA分子,并且比他们的合成对应物脂质体(liposome)更加高效。脂质体不具有外泌体表现出的天然复杂性和优势。
德州大学MD安德森癌症中心癌症生物学助理教授Valerie LeBleu博士说,“我们的研究提示着与脂质体相比,外泌体表现出运送siRNA分子和抑制侵袭性胰腺瘤生长的优异能力。我们也证实外泌体表面上的CD47存在允许它们躲避来自循环单核细胞的吞噬作用。”
这些研究人员也证实一种被称作巨胞饮(macropinocytosis)的细胞过程促进发生KRAS基因突变的癌细胞摄取外泌体。巨胞饮参与细胞清除营养物和囊泡。
Kamerkar说,“与之前的发现相一致的,由于增加的巨胞饮过程,达到胰腺的外泌体数量增加可能为外泌体进入KRAS相关的癌细胞提供进一步的优势。尽管胰腺瘤存在致密的基质,我们的结果也支持癌细胞高效地摄取iExosome。还需开展进一步的研究以便更好地理解通过巨胞饮进入细胞中的外泌体是否具有其他的可能增强它们的抗肿瘤能力的特征。”
4.PNAS:重磅:华人科学家在外泌体液体活检领域取得重大突破
doi:10.1073/pnas.1618088114
近日,普渡大学陶纬国(W. Andy Tao)教授团队在癌症的液体活检领域做出了「突破性贡献」,他们通过分析血液中囊泡(extracellular vesicles,EVs;包括近几年颇受业界关注的外泌体在内)内的磷酸化蛋白,实现了检测癌症的目的。本月初,著名期刊《美国科学院院报》刊登了陶教授团队的这一重要研究成果(1),研究的第一作者是来自宝岛台湾的I-Hsuan Chen。
通过检测身体蛋白磷酸化状态来检测癌症,看上去是靠谱的,但是据普渡大学报道,截止陶教授的这篇论文发表前,学界都认为通过血液检测磷酸化蛋白是不太现实的,原因是肝脏在源源不断的往血液中释放磷酸酶,已经磷酸化的蛋白到了血液,它的磷酸都被搞掉了,没办法检测了。
为了解决这个问题,陶教授团队将目光盯在了近几年非常热的囊泡上。这些囊泡都是从不同的细胞上分离出来的小泡泡,它们携带着母细胞的DNA、RNA和蛋白质等信息,通过分析小泡泡可以直接获得母细胞的基本信息。由于血液中散布的囊泡有一层膜保护,因此它们非常稳定,基本不受外界环境的干扰。所以陶教授认为,囊泡里面的磷酸化蛋白也不会受到血液中去磷酸化酶的干扰。
于是陶教授团队从Indiana Biobank收集了保存了5年(有研究表明30年「陈酿」的血样里的外泌体还可以用于分析研究)的30个乳腺癌患者血样,和6个健康人的血样。他们分离出血液里面的微囊泡和外泌体,利用质谱分析蛋白磷酸化状况。最终他们累计找到了近10000个磷酸化的蛋白,其中有144个磷酸化蛋白在乳腺癌患者血样囊泡中的量显着高于健康人。
显然,陶教授团队的初步研究表明,囊泡里的磷酸化蛋白具有作为癌症标志物的潜力,「这个研究肯定是一个突破,说明用囊泡中的磷酸化蛋白检测癌症是可行的。」
5.血液中的哨兵:纳米粒子辅助量化肿瘤特异外泌体用于胰腺癌诊断
doi:10.1038/s41551-016-0021
近日,美国亚利桑那州立大学“VirginiaG.Piper个体化诊断生物设计”研究中心的胡晔教授和他的同事们设计了一种精巧的方法,来解决胰腺癌早期诊断的问题。这种诊断方法的基本原理是对血液中的肿瘤特异细胞外泌体(extracellular vesicles,EVs)的高灵敏检测。
在NatureBiomedicalEngineering杂志最新在线发表的这项研究中,胡教授和他的同事报道了该方法:它能够直接检测源自肿瘤细胞的EVs,这些囊泡上携带了特定的膜蛋白作为胰腺癌的标志物。准确测定这种名为EphA2的膜蛋白,使得这些肿瘤EVs能够用于诊断早期胰腺癌。
这项工作通过两个不同纳米粒子之间的相互作用检测肿瘤分泌的EVs,进而可利用这种方法将胰腺癌患者的血液样品与胰腺炎患者(与胰腺癌有相似的症状)及健康人的血样区分开来。更重要的是,不同疾病都有其特异性的EVs,因而这种技术能够进一步用于更广泛疾病类型的快速灵敏检测。
研究显示,在许多疾病中,循环系统中的EVs数量会显着升高。在特定癌症的发生和发展中,EVs也扮演了重要的角色,包括胰腺癌。肿瘤EVs离开其母体细胞,迁移到其他正常组织,能够影响目标组织的周围环境,创造出一个适合肿瘤浸润和生长的微环境,这是EVs在肿瘤转移中的一个显着功能。就像新大陆的拓荒者,EVs能够为后续癌细胞的入侵开辟道路。
6.PNAS:只需 25 分钟,华人学者带来外泌体提取新突破















