正文

药明康德/报道
阿兹海默病和帕金森病是两种最为常见的神经退行性疾病,
不过,两者的病理特征、影响的大脑部位和临床症状有很大的区别。
在阿兹海默病患者脑内,由β淀粉样蛋白形成的斑块和tau蛋白形成的神经缠结导致了位于海马体和前额叶皮层的神经细胞死亡,使患者的认知和记忆功能衰退。而在帕金森病患者中,由α-synuclein蛋白形成的路易氏体主要影响中脑的黑质部分,导致患者的运动功能受损。
在这些不同的表面现象背后,
两种疾病都是由于蛋白非正常折叠导致聚积,从而影响神经细胞功能甚至死亡。那么这之间是否会有一些共同的机制呢?
新加坡科学家的一项最新研究找到了两者间的一个共同联系——β淀粉样蛋白的前体APP蛋白上称为AICD的部分,它有很强的神经毒性,在两种疾病进程中都扮演的重要作用。这项研究发表在了最近的《科学》杂志子刊《Science Signaling》上。

▲
该研究的主要负责人Eng-King Tan教授(
图片来源:SingHealth Research)
来自新加坡国立大学(NUS)的科学家们是从帕金森病入手进行这项研究的。如同阿兹海默病一样,
帕金森病中也有很小一部分患者是遗传性的。
在能导致帕金森病的基因突变中,较为常见的是
LRRK2
基因。
LRRK2
基因编码的是一种激酶,之前的研究发现,导致帕金森病的突变会增加这个激酶的活性,但是LRRK2激酶活性增加之后如何导致神经毒性却并不清楚。
科研人员首先在一种人的细胞系中寻找LRRK2激酶的可能底物,以试图找出与神经毒性之间的联系。
出乎意料的是,他们发现的一种底物是在阿兹海默病中有着重要作用的APP蛋白。
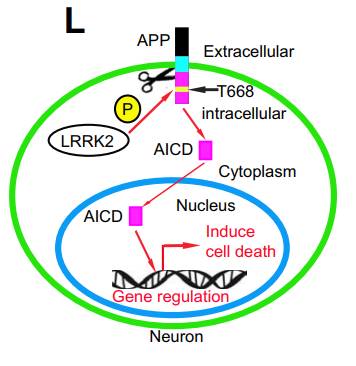
APP是一个跨膜蛋白,在内切酶的作用下,其细胞外部分能够被切割下来,这部分就是β淀粉样蛋白。不过,它的细胞内部分,称之为AICD,却不怎么引入注意。
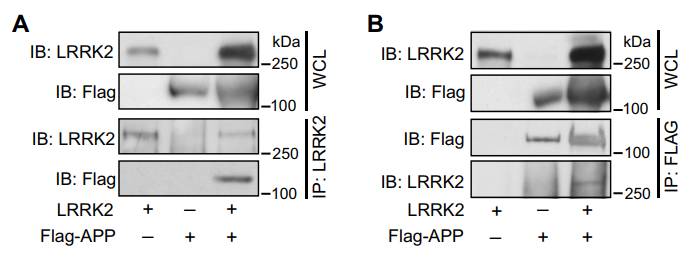
LRRK2能够磷酸化APP蛋白细胞内部分的一个特定位点Thr-668,并且这个位点只能被LRRK2磷酸化。
▲
LRRK2蛋白可直接结合APP蛋白(
图片来源:《Science Signaling》)
进一步的研究还发现,Thr-668被磷酸化之后,能够增加AICD的水平。随后,磷酸化了的AICD能够转移入细胞核,并发挥转录因子的作用。在体外培养的神经细胞中发现,磷酸化的AICD进入细胞核之后对细胞是有毒性的,这个过程加速了神经细胞的死亡。
如果对神经细胞中的APP蛋白进行基因改造,使其Thr-668位点不能被磷酸化,那么这种细胞就能抵御LRRK2突变带来的毒性。
随后科研人员在携带LRRK2突变的小鼠模型中进行了实验,这些实验证实了上述在细胞中的发现。在这种转基因小鼠中,因为LRRK2突变带来的激酶活性增强,导致了APP蛋白上Thr-668位点的磷酸化增加,以及AICD水平的上升。与对照小鼠相比,转基因小鼠中可以观察到更多的磷酸化AICD进入细胞核,并且选择性地导致了中脑黑质中多巴胺能神经细胞的死亡。
科研人员随后给这种小鼠使用了一个LRRK2激酶抑制剂,LRRK2的活性被抑制后,APP的磷酸化水平明显下降,由此带来的神经毒性也明显降低。
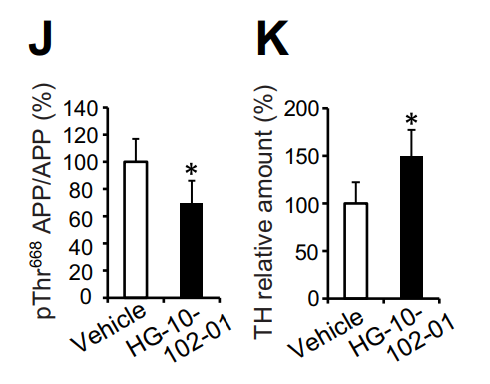
▲
LRRK2抑制剂有效降低了APP的磷酸化(左),并提高了TH蛋白水平(右)(
图片来源:《Science Signaling》)
最后,科研人员获得了一些带有LRRK2突变的帕金森病患者捐献的脑组织。分析发现,患者脑内的APP蛋白上的Thr-668位点的磷酸化水平显著上升。由此证实了APP在遗传性帕金森病患者的致病过程中的重要作用。
▲

















