了解药物的 pKa 在分析方法学的开发过程中有重要的意义,在筛选流动相的 pH 值时,如不知道待分离化合物的 pKa,可能会产生双峰的现象,分离度也不理想。为了介绍药物的 pKa 对化合物分离的影响,我们根据实际的工作经验进行了总结。
一、pKa
酸性物质的pKa是酸解离常数的负对数,碱性物质的pKa是其共轭酸解离常数的负对数。
了解酸或碱性物质的pKa值,可以方便的计算出药物在不同pH溶液中分子型(未解离型)和离子型(解离型)组分比例,对于我们建立和优化色谱条件具有重要意义。
容易得到,对于酸性物质:
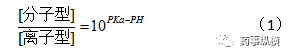
对于碱性物质:
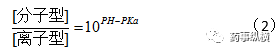
根据我们以前的推论:

K’、KI’、Kf’分别为总容量因子、离子型容量因子和分子型容量因子。
由此可见,分子型和离子型的比例,直接决定了化合物的保留,尤其是在KI’和Kf’相差较大的时候。
二、pKa估算
一般药物的pKa都可以从文献上获得,对于不能从文献获得的,可以进行初步估算。
(1)酸pKa估算
酸性药物一般以含羧基的居多。
当羧基与烷基连接时pKa一般在在4~5之间,如甲酸、乙酸和丙酸的pKa分别为3.8、4.7和4.8。
当含有吸电子基团,酸性增强,pKa相应降低,可参考氯乙酸(pKa2.9),羟基乙酸(pKa3.8)粗布估算。
当羧基与芳环连接时,pKa一般在3~6之间,可以苯甲酸(pKa4.2)为基准,根据苯环上取代的位置和取代基团进行估算。如水杨酸(邻羟基苯甲酸)pKa=3.0。
(2)碱pKa估算
碱性药物一般为脂肪胺、芳胺和含N杂环类化合物,对于羧酸盐类,可以运用其相应羧酸的pKa进行计算。
脂肪胺:pKa一般在9~11之间,如甲胺、乙胺、三乙胺pKa分别为10.6、10.8、11.1。
当含有吸电子基团,碱性降低,pKa相应降低,可以三乙醇胺(pKa=7.8)、乙二胺(pKa1=9.9)为参考。
芳胺:可以苯胺(pKa4.6)为基准,根据苯环上取代的位置和取代基团进行估算。如水杨酸(邻羟基苯甲酸)pKa=3.0。
N杂环:可以母核为基准,根据取代基团的性质和未知估算:
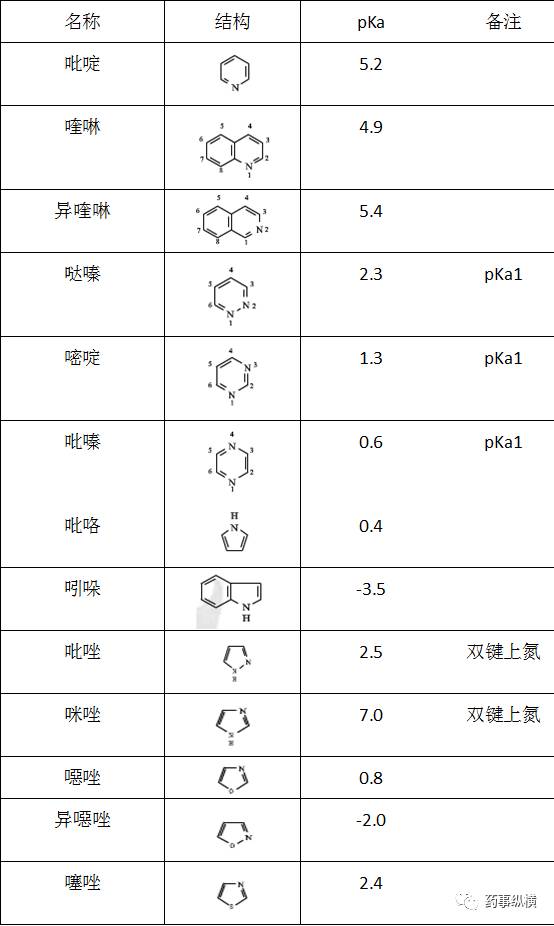
脂肪胺类碱性较强,要完全抑制它们的质子化,pH需要达到11~13以上,普通色谱柱难以承受如此高的pH,需要使用耐高pH值色谱柱。在普通色谱柱承受的pH范围内,它们几乎都以离子型(完全质子化)存在。
芳胺pKa在普通色谱柱承受的pH范围内,调节流动相pH即可调节保留。
N杂环化合物中,吡嗪、吡咯、吲哚、噁唑、异噁唑碱性极弱,几乎不解离,流动相可以不加缓冲盐;其它pKa也多在普通色谱柱承受的pH范围内,调节流动相pH即可调节保留。
三、pKa和初步测定
文献上有多种测定化合物pKa的方法,本文介绍一种HPLC测定pKa的方法。以酸性物质为例,介绍测定方法的原理。
根据式(1)我们知道,在流动相pH远小于pKa(差值不低于2)时,酸性物质99%以上以分子型存在,此时测得的容量因子即可作为分子型的容量因子(kf’)。同理,可以在流动相pH远大于pKa(差值不低于2)时测定出离子型的容量因子(kI’)。
在流动相选择中间pH条件下,测定化合物k’。由于kI’、kf’已经测出,根据式(3)即可以计算出xI和xf,将它们和流动相的pH代入式(1)就可以计算出化合物pKa。
以下为苯甲酸pKa的测定示例:

测定结果如下:
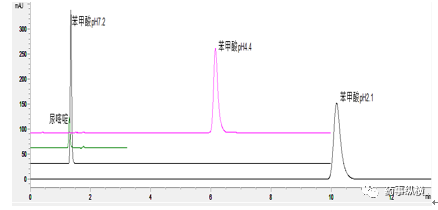
pH 2.1 时可以认为苯甲酸解离被抑制,此时的k’可以作为分子型的kf’, pH7.2 时可以认为苯甲酸完全解离,此时的k’可以作为离子型的kI’,即可以认为 kf’=6.88,kI’=0。
pH4.4时,k’=xIkI’+xfkf’=3.77,由此计算xf=0.55,xI=1-xf=0.45,分子型与离子子型比值为1.22。
根据式(1)即算出pKa=4.5,该值与文献值4.2基本吻合。
对于在流动相中易离解的化合物(比如酸和碱),离子型和分子型的极性通常相差很大,那么他们在HPLC中是否会被分离为离子型和分子型的两个色谱峰呢?
事实上,这个问题可以用酸碱平衡理论解释。下面以酸性物质(HS)为例,看看它们在色谱柱中的色谱行为:
HS在流动相中存在下列离解平衡:
HS→H++S-
如果HS解离常数为Ka,则有:
Ka=[H+][S-]/[HS]
即:[S-]/[HS]=Ka/[H+]
如果保持流动相中[H+]恒定(使用缓冲溶液),[S-]/[HS]也将恒定。这说明在谱带上任何一点,离子型和分子型比例都是恒定的。也就是说分子型和离子型相伴以恒定的比例流出色谱柱,出现的色谱峰是分子型和离子型的叠加。分子型的峰型和离子型的峰形始终保持一致,相伴相生。
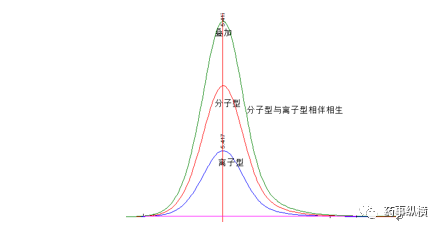
上述结论是建立在以下两个前提之上的:
(1) 离解平衡迅速达到。
(2) 流动相中[H+]恒定;
通常酸碱解离都能达到快速平衡。通常情况下,使用合适缓冲盐即可使流动相中[H+]恒定。但如果缓冲容量超载(组分酸碱性过强、进样量过大、缓冲盐选择不合适、缓冲液浓度过低),由于谱带上各点被分离组分浓度存在差异,无法保证每一点离子型和分子型比例都保持恒定,导致出现峰变形甚至分裂。
对于碱性物质,同理也可得到上述结论。事实上,对于流动相中存在二次平衡的物质的分离,都可按同样思路进行分析。比较典型的离子是糖的色谱分析,糖分离过程中存在α型和β型互变:
α型→β型
只要平衡足够快,我们就会得到一个尖锐和几乎对称的色谱峰,但事实上该互变平衡较为缓慢,导致色谱峰型变宽甚至分裂。因此糖分离中通常使用氨基柱和采用高柱温,希望快速达到互变平衡(碱性条件和高温能加速达到平衡)。
类似的例子还有乙酰乙酸乙酯在流动相中的二次平衡(酮式和烯醇式互变),甚至离子对色谱法也存在诸多二次平衡。
我们知道,离子型组分极性大,容量因子小,保留低,分子型组分极性小,容量因子大,保留大。那么,对于一个在流动性中易解离的化合物(酸或碱),它的保留情况如何呢?
还是以酸性物质(HS)为例,在色谱柱中同时存在离解平衡和分配平衡:
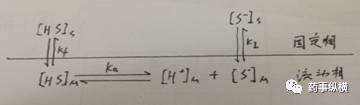
Kf、KI 分别为分子型和离子型在固定相和流动相中的分配系数:
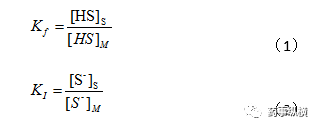
按分配系数定义,组分(离解型和分子型之和)在固定相和流动相中总分配系数K为:
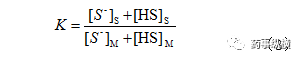
将(1)(2)代入(3)得到:
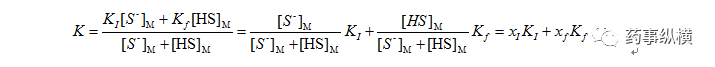
XI、Xf分别为离子型和分子型占比,XI+Xf=1。
两边同时除以相比得到:
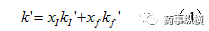
K’、KI’、Kf’分别为总容量因子、离子型容量因子和分子型容量因子。该式显示,总容量因子为各状态组分所占比例与该状态容量因子乘积之和。显然,通常情况下Kf’>>KI’,故分子型占比越多,总容量因子越大,保留越强。
根据解离常数可以得到:
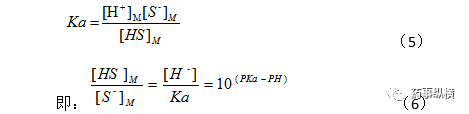
显然,流动相pH比组分pKa小2时,分子型与离子型之比达到100,组分几乎均以分子型存在,总容量因子贡献几乎全部来源于分子型,保留也最强。流动相pH比组分pKa大2时,离子型与分子型之比达到100,组分几乎均以离子型存在,总容量因子贡献几乎全部来源于离子型,保留也最弱。
(4)式和(6)式同时给我们优化色谱条件带来更多选择,即可以仅通过调节流动相pH改变分子型和离子型比例来改变组分的保留值。
对于碱性物质,我们也可以按上述方法得到相同结论。
欢迎广大朋友访问药事纵横的PC主页,网址是www.pharmaguider.cn,点击原文链接可一键直达。

药事纵横是一个开放,由自愿者组成的团体,现有成员13名,分别为Voyager88,雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,蓝色枫叶,ISAL,海角边,yhqqqqq,陈小牛,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711679
















