诺和诺德近期宣布终止口服胰岛素的研发,不禁让人大跌眼镜,这意味着什么呢?本文将回顾整个研发过程及研究结果,从学术的角度拨开商业吹嘘和主观臆想的泡沫,看看为什么口服胰岛素受到近百年百折不挠的追求但又迟迟不能变为现实? 其前景究竟如何?

据FierceBiotech网站10月31日报道,诺和诺德公司宣布终止口服胰岛素的研发。这让人大跌眼镜,这可是这家糖尿病制药巨头多年来的梦想啊!仅仅3年前,该公司还高调宣布将投资36亿美元研发口服胰岛素,豪言将给糖尿病治疗带来革命性突破,并预计在8-10年内上市。在外界看来如此突然的决定,可能有财务压力的考虑,但背后原因无疑是研发面临的巨大困难。
曾几何时,我们频频被一些“爆眼球”的口服胰岛素报道标题所吸引:
《口服胰岛素有望十年内问世》 (南方日报,2012-10-9)
《江大研制胰岛素口服试剂成功》(镇江日报,2015-12-11)
《三项尖端技术使胰岛素口服成为现实》 (中国产经新闻2015-12-10)
《这一次,口服胰岛素真的要来了!》
《口服胰岛素即将成为现实》
等等,不一而足。来了,来了,真的要来了……一次次让患者和医生兴奋不已,眼珠子都要盼出来了,仿佛让人生厌的胰岛素针和笔马上就可以扔到垃圾桶了。但真实的研究现状究竟如何呢?本文就来拨开主观臆想和商业吹嘘的泡沫,看看为什么口服胰岛素能受到近百年百折不挠的追求但又迟迟不能变为现实?哪些关键问题是需要得到解决的?
除了“长生不老药”,恐怕没有哪种药物能够让人保持如此长时间追求而不能得了。下面回顾一下口服胰岛素近百年研发过程中的里程碑事件:
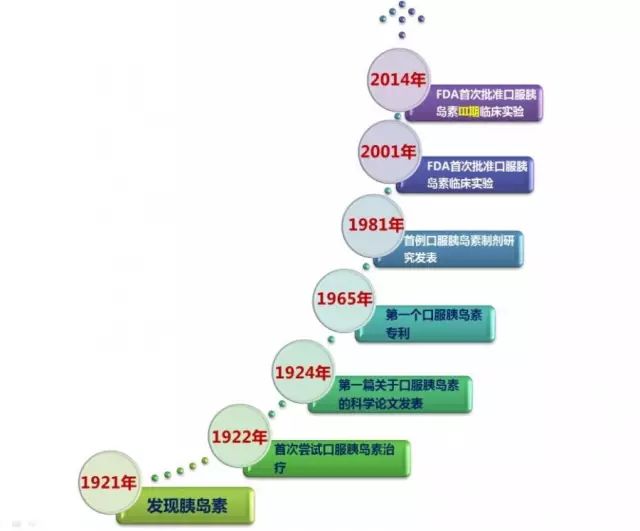
口服胰岛素研发史
1922年:也就是胰岛素发现的第2年,现代糖尿病学创始人Joslin博士就开始尝试研发口服胰岛素。结果是失败的,但揭开了人类追求口服胰岛素百年大梦的序幕。初期研究揭示了口服胰岛素两大主要挑战:高度的药效学个体化差异及极低的生物利用度。这两大挑战,至今未能克服。
1924年:史上第一篇关于口服胰岛素的论文《The oral administration of insulin to rabbits》,发表Experimental Biologic Medicine上。
1981年:才有第一篇关于口服胰岛素的研究发表。
2000年:临床试验开始进行。
2014年:第一个Diasome公司发起的III期研究得到FDA批准,但迟迟并未启动。
至今:从近30年发表的口服胰岛素相关的近400篇文献来看,仅有5%为临床研究报告,绝大多数研究夭折于实验室阶段。
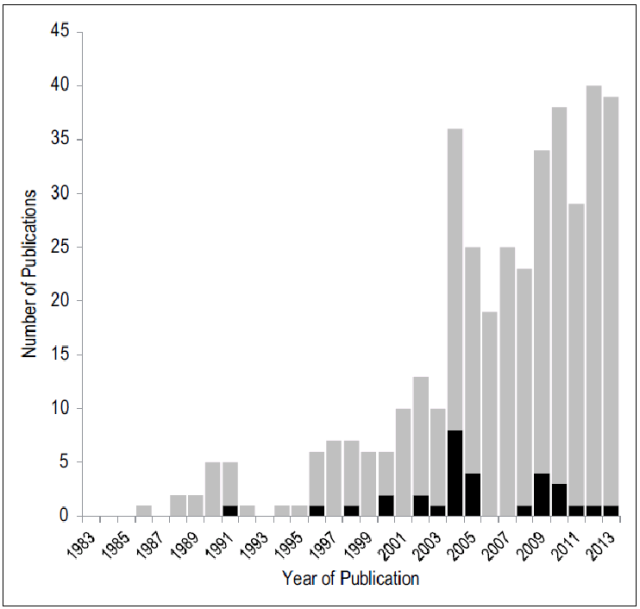
口服胰岛素相关论文发表情况(1983-2013)
既然口服胰岛素的研发道路是如此凶险,以至于几乎无人生还。为何科学家及制药企业仍乐此不疲、不惜代价地去追求呢?
最容易理解和想到的一点显然就是口服胰岛素可以使患者 “摆脱胰岛素注射的痛苦”,提高治疗依从性;
其次,口服胰岛素在肠道内吸收是最符合生理的途径,保持了胰岛素在进入血液之前的肝脏首过效应,避免了高胰岛素血症带来的过度生长刺激及其他不良代谢效应,减少低血糖反应及体重增加风险。
如果口服胰岛素一旦应用于临床,可以推断许多2型糖尿病可以尽早起始胰岛素治疗,将大大有利于血糖控制。
这些潜在优势无疑非常具有吸引力,一直激励着人们进行持续的研究努力。但,愿望是美好的,现实是残酷的……
如前所述,口服胰岛素的两大挑战药效学方面高度的个体化差异及极低的生物利用度在1922年就已经被意识到了。目前,包括胰岛素在内的蛋白质生物利用率不到1%,而只有提高到30%-50%才有使用价值。口服胰岛素极低的生物利用度有两大原因,一是因为它是大分子蛋白质,极易受到胃肠道蛋白酶及酸性环境的降解和破坏,二是它很难穿透肠道上皮吸收入血液。几乎所有的研发努力都是在试图克服这两大难点。科学家想方设法给胰岛素添置装备,甚至让它改头换面:
包被胰岛素:如将胰岛素包被在凝胶亚微米或纳米颗粒内,不仅可以使胰岛素逃过蛋白酶的降解,还可以促进肠细胞对蛋白的吸收,使胰岛素的生物利用率提高到34%。
脂质体:以脂质体作为INS的载体保护药物免受胃肠道蛋白酶的破坏并促进药物在胃肠道的主动转运和吸收。
在制剂中加入缓冲剂,使其所处的环境PH值调节至4-8之间。但在人体,可能对消化系统造成极大损伤。
使用肠道渗透增强剂(如脂肪酸酰化氨基酸),增强肠道细胞的通透性。
近30年间,在保护胰岛素不受胃肠道破坏方面取得很大进展,目前的研发障碍主要在突破肠道可穿透性方面。
在后续的临床研究方面,Akbari等将已发表的头对头比较口服胰岛素及皮下注射胰岛素的11篇临床研究进行了荟萃分析,结果显示,与皮下注射胰岛素相比:
总体降糖有效性(HbA1c,FBG,1h-PBG,2h-PBG,体现降糖效应的葡萄糖输注率)无明显差异;
药代动力学及药效学方面:胰岛素AUC及Cmax也无明显差异,但口服胰岛素达到最大血药浓度时间(Tmax)缩短,也就是达峰速度更快。
给药时间:与皮下注射的餐时胰岛素一样,各种口服胰岛素也多在餐前30分钟给药。
以上结果似乎很完美,但绝大多数并没有继续下一步临床试验,为什么中途放弃呢?具体原因每个公司通常并不公布,因为“报喜不报忧”是行业惯例,这种信息的封闭也是导致其它公司重蹈覆辙,不断失败的重要原因。
下面我们来看看硕果仅存的两个口服胰岛素临床试验的情况:
Diasome公司的HDV-1:
有注射和口服两种制剂。技术采用肝细胞靶向脂质体技术脂质体内包裹胰岛素,定向输送到肝脏,促进肝细胞对葡萄糖的吸收,降低血糖。餐时胰岛素定向作用于肝脏更加符合生理,因此可能减少低血糖或体重增加风险,被认为是一项重要的技术。
IIa期研究是一项在30例1型糖尿病患者中进行的为期两周的随机、双盲研究,结果提示0.1IU/kg口服HDV-1胰岛素在7点血糖(p=0.074)方面有降低趋势且没有低血糖发生,安全性良好;而0.07IU/kg的皮下注射胰岛素却有增加趋势(p=0.087)并有两例低血糖发生。
HDV-1口服制剂是目前唯一能够以相似剂量获得与皮下注射胰岛素相似效果的口服胰岛素,也是唯一获得FDA批准开展临床III期试验的产品,但研究至今并没有展开。
Oramed公司的ORMD-1:
Oramed 公司是以色列一家研制口服胰岛素及GLP-1的制药公司,成立于2006年并于次年在纳斯达克上市,号称拥有独一无二的注射药物口服化技术平台POD(蛋白口服给药):胰岛素被包裹在一个胶囊内,其防酸保护涂层经过胃肠道酸性环境后依然完好,还有蛋白酶抑制剂抑制酶解。
IIb期研究结果:Oramed制药公司2016年5月宣布,口服胰岛素胶囊ORMD-0801在IIb期研究达到主要终点,显著降低夜间血糖且安全性良好,未见任何药物相关严重不良事件。上述描述有些含糊,我们来看看研究具体情况:
在美国33个中心进行的随机、双盲研究,入选了180例二甲双胍治疗血糖控制不佳的2型糖尿病患者,二甲双胍基础上联用ORMD-0801或安慰剂。
结果:同与基线相比,治疗组主要终点(夜间血糖)比安慰剂组多降低0.75mmol/L(P=0.0117),未出现显著的不良反应。次要指标(24h、空腹及白天血糖)也是治疗组更优,但绝对差异均<1mmol/L。29天时的HbA1c差值为0.2%(p= 0.0149)。
分析:首先研究对照组不是皮下注射的胰岛素,很难想象与安慰剂相比只有不到1mmol/L的降糖效果会给患者带来多大获益?其次胰岛素剂量并未公布,如果跟绝大多数口服胰岛素一样,是10~20倍注射胰岛素剂量的话,则价格问题及潜在高胰岛素血症的风险同样值得关注。IIb结果公布后,公司CEO表示:“开发出有效的口服胰岛素将是2型糖尿病治疗史上的革命性事件,我们期望能尽快开展III期研究”。我们不禁要问,III期研究真的准备好了吗?

从前面的研究及结合实际临床需求来看,目前口服胰岛素研发仍未解决的问题包括:
病例数问题:上面的荟萃分析引用的研究,样本量都非常少,最多只有30例。扩大样本量以后,这些结果是否仍然一致?也就是说,是否解决了个体化差异的问题呢?尽管没有后续结果报道,但估计悬,否则干嘛不进行下去了呢?
超大剂量胰岛素问题:除HDV-1外,其他研究中口服胰岛素应用剂量都非常巨大,通常是对照注射组剂量的15~20倍,也反映出其生物利用度的效率仍非常不尽如人意。
超大剂量胰岛素及胃肠道给药带来的致癌风险顾虑:低生物利用度意味着95%的胰岛素未被吸收而保留于胃肠道内,很可能被蛋白酶或多肽酶降解。因此,胰岛素的致有丝分裂作用能否导致胃肠道肿瘤发生率增加呢?必须大样本严格的临床试验去排除。
饮食对于口服胰岛素的影响尚不清楚:目前临床试验中的给药时间多数是餐前30分钟,但极少有研究去评估不同给药与进餐时间间隔的差异。有研究认为,食物消化过程降低了口服胰岛素的药物活性。如果这被证实,那么之前对生物利用率的评估仍是偏高的。
某些因素(如偶尔的饮食变化、应激状态及剧烈运动)可能导致口服胰岛素暂时性吸收增加,因此导致胰岛素过量引发严重低血糖反应。
餐时还是基础?进入临床研究阶段的口服胰岛素中,只有诺和德的3个产品是长效,其它基本为短效。因此,与目前皮下注射的速效胰岛素类似物的药效及药代的比较至关重要,但目前无结论。而长效的实际临床价值不大,由4次注射减为3次,so what?
“人工胰腺”,即闭环胰岛素泵:第一款混合型人工胰腺今年9月已获FDA批准上市,尽管只是混合闭环(餐时仍需要人工输入食物量),但随着速效胰岛素制剂及技术的快速发展,完全闭环可能非常接近现实。一旦实现,患者得到的便利及血糖自动精准控制,口服胰岛素的研发还有多少价值呢?
更快速作用的速效胰岛素类似物:去年底向FDA提交新药申请的速效门冬胰岛素在注射后15分钟内的吸收速度较普通门冬胰岛素快4.5倍,这将很大程度上改善餐后血糖问题。这样,餐前30分钟左右给药的口服胰岛素在血糖控制方面更无优势。
其它非侵入性途径的胰岛素:如吸入、皮肤渗透、滴眼液、直肠给药。这些前景也不乐观,如上市的Exubera和Afrezza两种吸入胰岛素让辉瑞和赛诺菲等大药厂大吃苦头。皮肤渗透等途径是解决基础胰岛素问题而不解决餐时问题,对注射患者痛苦的解除影响有限。
其它方面的进展,如胰腺/胰岛移植、基因治疗、干细胞移植、β细胞功能逆转等。目前还离广泛临床应用有较大距离。
总之,折腾了快100年了,还没有一款口服胰岛素能够面市。本人认为,被FDA批准III期研究的HDV-1口服制剂可能希望尚存,但在公开信息有限的情况下无法判断。当然国内有些公司或单位宣称口服胰岛素研发取得重大进展甚至成为“现实”。但因为无科学数据可查,无法评价,希望有朝一日他们能放出真正的“卫星”。
随着诺和诺德的退出,口服胰岛素的研发犹如到了悬崖边的“狼牙山两壮士”,前面是万丈深渊,后面是强兵追击,如何抉择?这的确是个问题!难怪越来越多的科研人员唱衰口服胰岛素,甚至认为这是科学界的集体幻想。我们不禁想起百年前的前辈的结论:“口服胰岛素在人类糖尿病治疗方面没有或几乎没有价值。”现在看,这个结论仍然是那么的正确。未来,能推翻吗?
http://www.fiercebiotech.com/
Fonte P, et al. Oral insulin delivery: how far are we? J Diabetes Sci Technol. 2013;7(2):520-31.
Akbari V, et al. Efficacy and safety of oral insulin compared to subcutaneous insulin: a systematic review and meta-analysis. J Endocrinol Invest. 2016;39(2):215-25.
Wong CY, et al. Oral delivery of insulin for treatment of diabetes: status quo, challenges and opportunities. J Pharm Pharmacol. 2016;68(9):1093-108.
Zijlstra E, et al. Oral insulin reloaded: a structured approach. J Diabetes Sci Technol. 2014;8(3):458-65.
http://diasomepharmaceuticals.com/
http://www.oramed.com/
本文来源:微信公众号医言糖,转载此文仅为学习交流,如有版权问题请联系我们删除
















