
▎学术
经纬
/报道
今日,《自然》子刊
Nature Cell Biology
的最新一期发表了一篇关于癌症治疗的重要研究。宾夕法尼亚大学佩雷尔曼医学院(Perelman School of Medicine at the University of Pennsylvania)的研究人员
针对著名的“不可成药”靶点,发现了一种新的攻击途径,可以让癌细胞自我毁灭
。动物实验的结果提示,这项新发现可能为多种类型的癌症带来全新的治疗策略。

我们知道,癌症与许多基因的异常表达有关。在多种癌症类型中,一种名为
MYC
的原癌基因发生突变或过度表达。作为一种转录因子,MYC影响许多基因的表达。当它出现异常,会引发连锁反应,让细胞异常增殖,帮助肿瘤不受控制地生长。
多年来,由于直接靶向MYC蛋白的药物极难研发,
MYC成为了臭名昭著的“不可成药”靶点
。
很多研究人员也想到了间接对抗的方法,靶向MYC通路的下游分子来阻止肿瘤生长。例如,在有些肿瘤中,Constantinos Koumenis教授与其同事发现,激酶PERK激活ATF4(活化转录因子4)是MYC活化后的一条关键下游通路。

▲该研究的通讯作者Constantinos Koumenis教授(图片来源:
宾夕法尼亚大学官网)
一开始研究团队想到了用抑制剂阻断PERK。然而,他们发现这还不足以阻止肿瘤细胞的生长。原来在肿瘤细胞中,MYC还会绕道走另一条通路来影响ATF4。
发现这一点后,科学家们有了新的思路。既然
两条信号通路都汇集到ATF4这个下游分子
,那么靶向ATF4也许可以更好地阻止肿瘤生长。
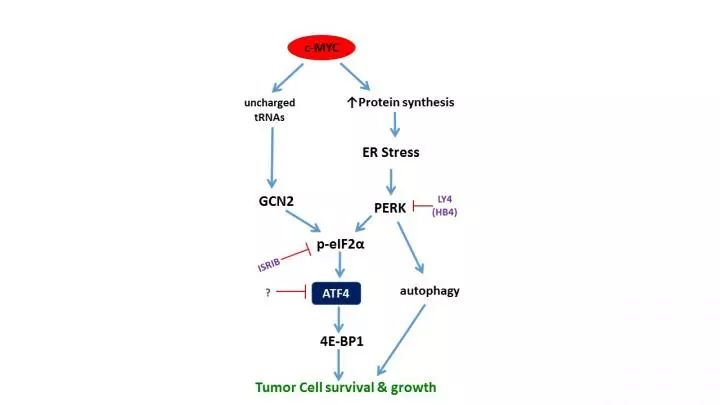
▲
MYC通过两条途径影响下游的ATF4(图片来源:
参考资料[1])
进一步研究发现,ATF4作为MYC的下游,调控MYC靶向的多种基因的表达。这些基因多与细胞合成氨基酸和蛋白质有关,其中包括一种蛋白4E-BP1。这种蛋白质负向调控mRNA的翻译,可以减轻MYC引起的蛋白毒性应激,对于平衡蛋白合成至关重要。
研究人员首先在人类大肠癌肿瘤细胞系中检验了敲除ATF4的后果。结果显示,ATF4表达降低后,MYC的活化造成蛋白质在肿瘤细胞内不断堆积,代谢压力激增。最终,
肿瘤细胞死于内部应激过强
。
而在淋巴癌小鼠模型中,研究团队进一步检验了阻断MYC-ATF4通路的治疗潜力。在敲除ATF4基因后,
MYC
驱动的肿瘤停止生长。相比对照组,
小鼠的无肿瘤生存期和总生存期都得到了显著延长
!

▲在淋巴癌小鼠模型中,条件敲除Atf4基因提高小鼠的无肿瘤生存期和总生存期(图片来源:参考资料[1])
研究人员表示,他们还将继续研究这种间接攻击MYC的方法,弄清楚MYC-ATF4通路中是否还有其他潜在靶点,以及阻断ATF4是否会在人体中产生其他脱靶效应。
杂志同期刊登的评论认为,这项研究“
为肿瘤对内在应激的反应提供了机制上的洞见,并为癌症治疗提供启发
”。期待科学家们借助这条新途径,最终成功围剿肿瘤,造福众多患者!
参考资料
[1] Feven Tameire et al., (2019) ATF4 couples MYC-dependent translational activity to bioenergetic demands during tumour progression. Nature Cell Biology. DOI: 10.1038/s41556-019-0347-9
[2] Kirk Staschke et al., (2019) Adapting to cell stress from inside and out. Nature Cell Biology. DOI: 10.1038/s41556-019-0354-x
[3] Researchers Identify New Way to Make Cancer Self Destruct. Retrieved July 02, 2019, from https://www.pennmedicine.org/news/news-releases/2019/july/researchers-identify-new-way-to-make-cancer-self-destruct

癌症突破
抗癌疫苗
|
癌症地图
|
KRAS
|
酒精
|
CAR-T 2.0
|
单细胞CAR-T
|
外泌体
|
白血病免疫疗法
|
膳食纤维与肝癌
|
中年危机
|
液体活检
|
化疗与癌症转移
|
抽烟喝酒要不得
|
癌症转移
|
癌细胞变脂肪
|
自噬反应
|
钾离子
|
PD-L1远程攻击
|
CAR-T安全性














