本文转载自药明康德“康健新视野”微信公众号
虽然都可以称为癌症,但是由于所处的组织不同,治疗方案就不能一概而论。以皮肤癌为例,位于体表,通过手术或者放疗都可以进行治疗,这对于身体内整体的健康细胞造成的损伤很低;而对于胰腺癌这种类型,癌变组织在身体的深处,只有通过血液将能够杀灭癌细胞的化疗药物带到病灶,理想状态中,肿瘤细胞萎缩依赖于药物在疾病组织的血液和淋巴管中积累的量高于正常组织,这样的方式只有通过其他的思路才能减低对健康组织的毒性。
为了改善化疗药物这种被动的积累,提高有效性和减低副作用,来自哈佛大学威斯研究所(Harvard Wyss Institute)、波士顿儿童医院(Boston Children's Hospital)以及哈佛医学院(Harvard Medical School)的团队,共同开发了一项新的药物递送平台,通过使用安全的、低能量的超声波引发包含了化疗药物的纳米粒子精确分散在肿瘤所在位置,可以使得有效靶向性提高2倍,并且可以显著的降低小鼠乳腺癌模型的肿瘤大小和药物相关的细胞毒性。
研究发表在了最近的《Biomaterials》上。

这种新技术由搭载了化疗药物的纳米粒子聚合体组成,可以通过注射途径进入到血液循环系统中。之后,一个外加的超声激活系统在肿瘤区域开始通电工作,使得血管内通过的聚合体在肿瘤附近被瓦解,释放所搭载的化疗药物。
文章联合第一作者Netanel Korin博士表示,“我们本质上来说是有了一种能够递送药物到任何你想要的地方的外部激活方式,这比仅仅注射一大群纳米粒子来的有效。”

▲电子显微镜下的球形纳米粒子聚合体(图片来源:哈佛大学威斯研究所)
这种新方法的关键在于制造纳米粒子聚合体(NPAs),这是一种微小的结构由包含了药物的纳米粒子组成,被支撑矩阵包围。为了能够得到最好的NPAs,研究人员对各种尺寸的纳米粒子以及纳米粒子-矩阵的比率进行了测试。NPAs需要在注射的过程中能足够稳定,而且当给予低能量超声波时能够很好的崩解,将纳米粒子游离并随着时间推移释放所搭载的药物。
为了测试这种NPAs是否能够如预期所设计的方式工作,团队通过小鼠乳腺癌细胞分别对松散的纳米粒子、完整的NPAs和经过超声处理的NPAs进行了测试。经过超声处理的NPAs和松散的纳米粒子相对于完整的NPAs来说都表现出了更高的肿瘤内化,这表明,超声波能够有效的破碎NPAs的结构,允许纳米粒子渗透到癌细胞内。
下一步,研究人员使用了包含常见化疗药物阿霉素的纳米粒子再次重复了试验。他们发现,NPAs得到了水平相当的癌症细胞死亡,表明了NPAs封装对于药物的有效性并没有负面的影响。
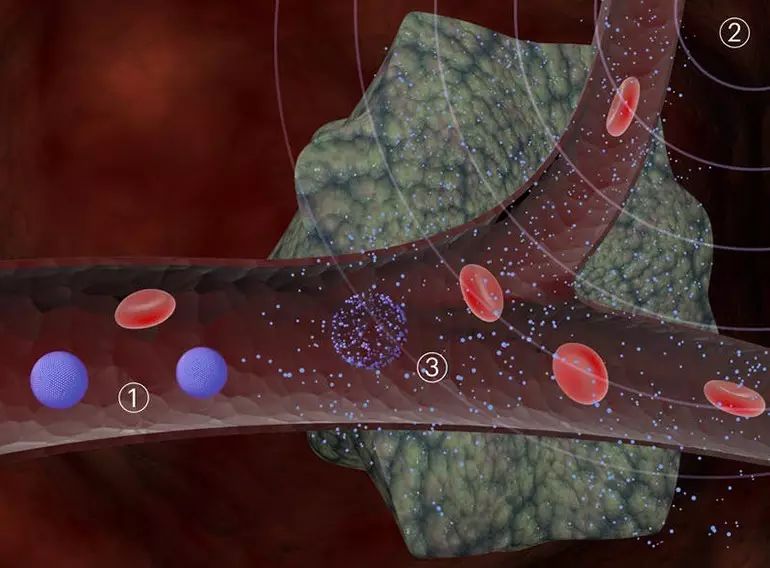
▲超声敏感的NPAs如何工作:1.将完整的NPAs引入血液中。2.超声波应用于肿瘤部位。 3. NPAs响应于超声波分解,释放纳米颗粒,使之将所负载的药物有效递送到肿瘤(图片来源:哈佛大学威斯研究所)
最后,为了能够观察NPAs是否能够在体内相比松散的纳米粒子也取得同样好的效果,两种形式的粒子都经由静脉注射,注射到了乳腺癌小鼠模型的体内。超声处理的NPAs相对于完整的NPAs能够递送近5倍量的纳米粒子到肿瘤所在位置,而松散的纳米粒子能够递送2-3倍。当纳米粒子装载了阿霉素,接受NPAs和超声治疗的小鼠相对于接受松散纳米粒子治疗的小鼠,体内的肿瘤收缩到了一半。至关重要的是,通过使用NPAs,研究人员可以仅使用常规剂量的十分之一就可以将肿瘤尺寸收缩到一半,而由于药物毒性而死亡的小鼠数量也从40%降低到了0%。
“将纳米粒子锁定到NPAs中,允许通过响应超声,将单个NPA中的纳米粒子大军直接递送到肿瘤,而且这很大限度的减低了血液对这些纳米粒子的稀释,”文章联合第一作者Anne-Laure Papa博士谈到:“此外,我们的超声引发NPAs在体内的分布模式与FDA已批准的PLGA纳米粒子聚合物相似,因而在我们的期望中NPAs具有同样的安全性。”
NPAs的另外一个优势是没有常规纳米粒子药物递送过程中会出现的“爆发性释放”现象,这种现象是大量的纳米粒子在注射后很短时间里就破碎并释放它们携带的药物,使得在注射区域内出现不利的响应也减低了能够到达肿瘤所在区域的药物剂量。当应用于体外癌细胞时,松散的纳米粒子在五分钟内就会释放25%的药物,而携带药物的完整NPAs仅释放了1.8%的药物。当超声开始使用时,NPAs会再额外释放出65%的药物,而与松散的纳米粒子相比,它们只释放额外的11%。
团队表示,关于超声敏感的NPAs如何进一步改善会再进行额外的研究,他们希望可以使得这个全新的药物递送平台更加安全、更加有效、更具有吸引力,成为一个更好的选择。与靶向肿瘤环境的多肽或者其他的靶向策略相结合,会使得这项新技术更进一步。Papa博士表示:“我们希望在未来,我们的触发积累技术能够与这些靶向策略相结合,取得更有效的治疗效果。”
参考资料:
[1] A mechanical trigger for toxic tumortherapy
[2] Ultrasound Activates NanoparticleAggregates for Selective Drug Delivery
[3] Ultrasound-sensitive nanoparticleaggregates for targeted drug delivery


















