约三成的复发或难治性AML患者会出现FLT3突变。体外试验显示,gilteritinib可对FLT3选择性抑制,但是还没有人体试验数据。6月20日在线发表于Lancet Oncology上的一篇文章表示,FLT3突变的复发或难治性AML患者中,gilteritinib的安全性特征良好,应答持续时间长,总体生存结局令人鼓舞。
背景和目的:
FLT3是AML最常见的突变基因,高达30%的患者会出现突变。FLT3突变发生在两个不同的区域:近膜结构域的内部串联重复突变和酪氨酸激酶结构域的点突变,其中点突变最常发生在Asp835密码子(D835)。临床上,FLT3的内部串联重复突变是化疗后出现快速复发和较差总体生存结局的强烈预测因素。
最初的FLT3抑制剂具有较差的生物利用度,有效性不充分,激酶特异性不足,实现应答者少,应答持续时间短。此外,治疗初始后的数周,一般会出现耐药情况。因此,开发出专门针对FLT3内部串联重复突变并克服其他FLT3靶向药物局限性的药物gilteritinib(一种口服FLT3和AXL抑制剂)。
在体外,gilteritinib已经表现出可对FLT3选择性抑制,对具有内部串联重复突变和酪氨酸激酶结构域突变的FLT3受体具有高度有效的活性。然而,还没有对gilteritinib进行过人体试验。美国约翰霍普金斯大学西德尼基梅尔肿瘤综合中心的Mark Levis教授及其研究团队进行了一项1~2期人体试验,旨在评估gilteritinib治疗复发或难治性AML的安全性和耐受性,并确定最大耐受剂量。此外,研究人员希望根据临床应答和体内FLT3抑制情况确定gilteritinib的最佳3期临床试验剂量,从而确定该药的药物代谢动力学特征。
方法:
研究设计和参与者:
这是一项在法国、德国、意大利和美国的28个地区进行的开放性1~2期剂量递增和剂量扩展国际研究。患者的入组标准为:18岁或以上,具有原发性或继发性AML,东部肿瘤协作组体力状态为2级或更低,至少一个周期的诱导化疗无效,或既往治疗实现缓解后疾病复发。虽然FLT3突变的存在并非入组标准,但是研究者仍在每个剂量组纳入了10例或更多的FLT3突变(FLT3mut+)患者。
分组:
患者分组到7个剂量递增队列:20mg/d、40mg/d、80mg/d、120mg/d、200mg/d、300mg/d、和450mg/d。基于gilteritinib的安全性和耐受性、FLT3抑制情况和抗白血病活性,研究人员对队列进行了扩展。
结局:
首要终点为gilteritinib的安全性、耐受性和药物代谢动力学特征。次要终点为gilteritinib的抗白血病活性、gilteritinib的药物相互作用、gilteritinib的药效学。
数据分析:
试验对3个数据集进行了分析。安全性分析数据集:分析安全性,由接受至少一次gilteritinib给药的患者组成;药物代谢动力学分析数据集(安全性分析数据集的子集);全分析数据集:评估抗白血病活性,由所有接受至少一次gilteritinib给药且具有至少一个治疗后数据的患者组成。
结果:
基线特征:
2013年10月15日~2015年8月27日,总共265例患者入组。2015年11月,234例患者(88%)停止治疗,31例患者(12%)继续治疗,中位治疗时间25.9周(IQR,15~50)。因未接受gilteritinib治疗,13例患者(5%)未纳入到安全性分析数据集中,因此,安全性分析数据集的患者数为252例患者(剂量递增队列23例,剂量扩展队列229例)。全分析数据集由249例患者组成,药物代谢动力学分析数据集由19例患者组成。
基线时,162例患者为FLT3的内部串联重复突变,13例患者具有D835密码子的点突变,16例患者具有两种类型的FLT3突变。患者分组情况见图1。
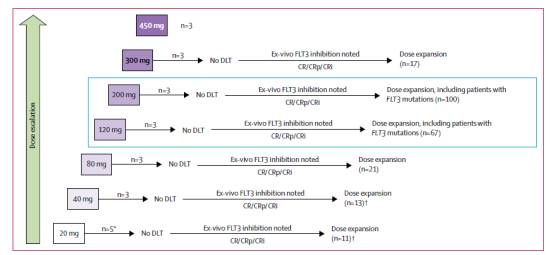
图1:试验分组情况
不良事件:
最常见的3~4级不良事件为发热性中性粒细胞减少(97例,39%)、贫血(61例,24%)、血小板减少(33例,13%)、脓毒症(28例,11%)和肺炎(27例,11%)。与gilteritinib相关的常见不良事件都与AML药物治疗中常出现的一致:腹泻、疲劳、天冬氨酸转氨酶偏高、丙氨酸转氨酶增加。安全性分析数据集中,25例患者(10%)需要降低剂量。与剂量降低相关的不良事件为腹泻(2例,1%)和疲劳(3例,1%)。
严重不良事件:
安全性分析数据集中,至少5%的患者发生的严重不良事件为:发热性中性粒细胞减少(98例,39%)、疾病进展(43例,17%)、脓毒症(36例,14%)、肺炎(27例,11%)、急性肾衰(25例,10%)、发热(21例,8%)、菌血症(14例,6%)、呼吸衰竭(14例,6%)。这些严重不良事件中,与gilteritinib相关的为:发热性中性粒细胞减少(5例,2%)、急性肾衰(5例,2%)、发热(3例,1%)、脓毒症(2例,1%)、菌血症(1例,<1%)。
造成停止治疗的所有不良事件中,疾病进展(15例,6%)和脓毒症(7例,3%)最常见。25例患者(10%)因药物相关不良事件而停药,最常见的为血肌酐磷酸激酶偏高(3例,1%)。
死亡:
安全性分析数据集中,95例患者死亡,其中可能与gilteritinib相关的7例死亡为肺栓塞(200mg/d组)、呼吸衰竭(120mg/d组)、咯血(80mg/d组)、颅内出血(20mg/d组)、心房纤颤(120mg/d组)、脓毒性休克(80mg/d组)和中性粒细胞减少(120mg/d组)。
有效性和耐受性:
Gilteritinib的最大耐受剂量为300mg/d。所有剂量水平都观察到了gilteritinib较强的抑制作用。血浆gilteritinib浓度增加时,FLT3磷酸化的抑制作用也增强:80mg或更高剂量组的多数患者在第8天时,至少90%的FLT3磷酸化受到抑制,见图2。
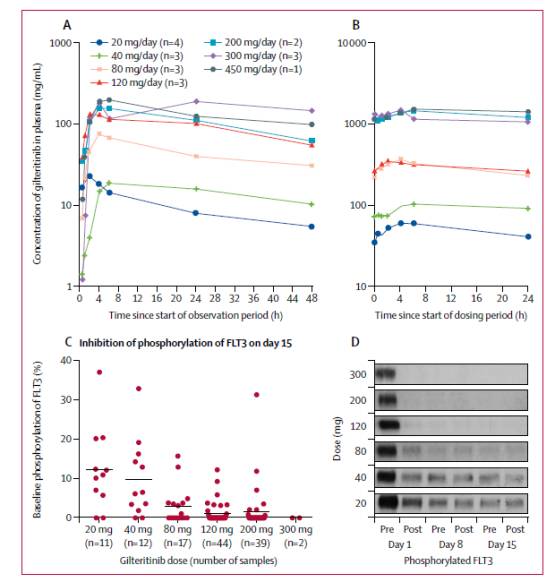
图2:Gilteritinib的药物代谢动力学和药效学特征
全分析数据集中,100例(40%)实现了应答,其中的19例(8%)完全缓解,10例(4%)完全缓解且血小板不完全恢复,46例(18%)完全缓解且血液学不完全恢复,25例(10%)部分缓解。应答持续的中位时间为17周(95% CI,14~29)。3例患者在少于1个周期的应答时间内复发,1例患者在复发前具有55周的持续应答时间。中位总生存期为25周(95% CI,20~30)。
全分析数据集中的191例FLT3mut+患者中,70例(37%)实现了应答,多数患者为80mg/d或更高的剂量组(见图3)。FLT3mut+患者中,80mg/d或更高的剂量与抗白血病活性相关,这在从未接受和既往接受过酪氨酸激酶抑制剂治疗的患者亚组中都是如此。
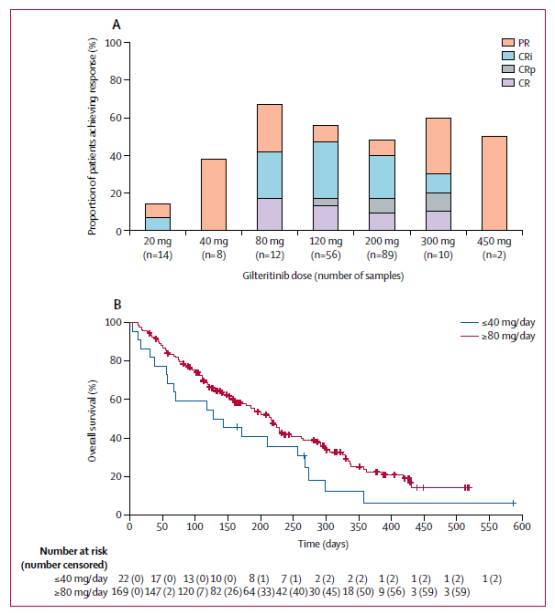
图3:FLT3mut+的复发或难治性AML患者对gilteritinib的临床应答
结论:
复发或难治性AML患者中,gilteritinib具有良好的安全性特征,并表现出对FLT3的抑制作用。
讨论:
此研究表明,在具有FLT3内部串联重复突变合并或不合并酪氨酸激酶结构域突变的复发或难治性AML患者中,gilteritinib具有高度特异的FLT3抑制活性和抗白血病活性。此外,药物代谢动力学特征表明,gilteritinib具有较长的清除半衰期,说明gilteritinib适合每天一次给药。
Gilteritinib不良事件的严重程度为中等,并都可在门诊中予以控制。
复发或难治性AML的FLT3mut+患者,对标准挽救性诱导化疗的应答较短,造成了长期存活者较少。此研究中,gilteritinib的临床应答和总体生存结局都好于标准化疗。此结果为gilteritinib作为复发或难治性AML的FLT3mut+患者单药治疗的3期试验提供了理论基础。
研究的主要局限性为不是随机单组开放性研究,且患者数量相当少,限制了研究结果推广到更广泛的AML患者人群中。
点评:
越来越多的靶向治疗为复发或难治性AML患者提供了希望。对传统的化疗方案,患者并不具有持久应答。此项研究证实,FLT3可作为具有较高价值的AML治疗靶点,并且研究结果也为比较gilteritinib和标准化疗或其他靶向药物的3期研究奠定基础。
Selective inhibition of FLT3 by gilteritinib in relapsed or refractory acute myeloid leukaemia: a multicentre, first-in-human, open-label, phase 1–2 study
http://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(17)30416-3/fulltext
19个肿瘤相关临床试验招募患者
点击下方图片即可查看详情





