
序
流化床制粒是制剂常用制备工艺,但是您知道,影响流化床制粒的关键参数有哪些吗?而这些关键参数又是怎样从小试放大到大生产呢?本文通过拉西地平案例,为您讲述制约流化床制粒的关键参数,并通过公式计算放大至大生产时所需的参数范围。
基于 QBD 理念的流化床工艺放大研究
摘要
本研究主要目的是基于 QBD 理念,提供一种难溶性抗高血压药口服制剂的稳健制备工艺,重点在于通过在中试研究阶段制定控制策略进行工艺放大研究,深入了解产品工艺,以防在大生产中放大失败。流化床制粒中,处方工艺、设备参数的筛选和优化,仅仅是成功将流化床工艺技术从小试向大生产放大,却未知其风险情况。因此,基于现有知识和原始试验数据,采用风险评估工具来辨识潜在影响工艺/产品关键质量属性 ( IP/DP CQAs ) 的参数和确定其范围, IP/DP CQAs 参数范围将会通过实验进一步准确确定,并结合 DOE 、数学模型或研究来确定个体变量和潜在相互作用的重要性,使仅是机械理解上升到更高层次的过程理解。本研究所推荐的设计空间是通过已证实可接受的关键工艺参数 ( CPPs) 和预先确定的失效边缘建立,并需要对其进行监管评估。CPPs在设计空间范围内不认为是变更,但当超出设计空间范围,将被认为是一种变更,并开始启动工艺变更批准监管流程。一旦有CPPs发生任何变更,将要求在变更批准后才能进行大生产。
关键词:
固体分散体 ( SD ) 、流化床工艺 ( FBP ) 、质量源于设计 ( QBD )、关键质量属性 ( CQA ) 、关键工艺参数 ( CPP ) 、失效模式与效果分析 ( FMEA ) 、放大
1.0 前言
在药物开发研究阶段,实验操作一般是在试验台或是小型设备上进行。由小试试验原始数据中形成的工艺认识仅仅是停留在小试阶段的,然而放大生产通常是不断扩大批量,直到生产出理想产品。一般认为,许多 NDAs 和 ANDAs 制剂都会有许多生产基地,且不存在能生产出完全一致的原料的生产基地,因此,需要对原料进行质量控制以保证最终产品的质量和重现性。此外,制备过程也应通过验证文件进行控制,而这些验证文件中需规定制备过程中的关键参数以及建立颗粒的可接受标准。可接受标准应包括粒度分析、水分、流动性、密度、均一性以及可压性等。在生产工艺得到控制和验证情况下,批量放大、生产场所变更、设备变更批准 ( 工作原理相同 ) 、处方微量调整等应根据所制备颗粒和最终产品的相似性来确定,同时还应通过适当的检测、说明书、工艺验证和加速稳定性比较试验或者在中试研究阶段通过 QBD 理念制定控制策略来保证。
流化床制粒过程包含三个步骤,即干混合、喷浆制粒和干燥,通过这个三个步骤制得所需颗粒大小和水分。从小试规模放大到生产规模取决于设备设计,而就设备尺寸大小和部件而言,存在可能或不可能放大的情况。颗粒质量取决于喷浆制粒阶段,在制粒阶段,粘合液溶剂快速蒸发,颗粒不断增大。作者发现影响颗粒特性的重要工艺因素有粘合剂喷入速度、粘合液雾化程度、进风温度和喷嘴高度。在大规模生产中,进风风量升高,流化床内温度随之升高,这加快了溶剂蒸发速度。保持与小试流化床一样干燥能力,才能使流化床内的温度与小试相似。通过增大喷液速度、进风温度、进风风量或者结合着这些变量可得到合适的结果。由于流化床深度与空气分配器的比例随设备大小而增加,流化速度可以通过增加进风风量来保持恒定。影响关键质量属性 ( CQAs ) 的重要关键工艺参数 ( ICPPs ) 已准确总结在 Figure 1 。
总之,在放大生产时,下列的工艺条件应与小试研究时的工艺条件相似:
1)工艺空气通过系统的流化速度;
2)制粒时喷液速率与进风风量干燥能力之比;
3)粘合剂喷液大小与雾化压力成正比;这些数值必须根据小试研究的结果计算出来,以通过 QBD 理念确定工艺参数的可接受操作范围。
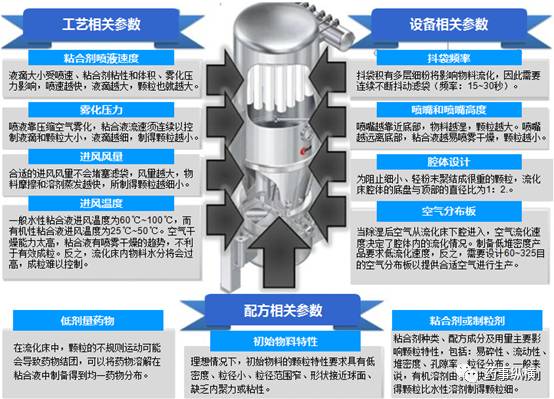
过去,通常是选择最佳工艺参数进行放大生产,如今的趋势是采用因子设计研究方法和校正因子设计研究方法。这类统计学设计实验方案可以得出自变量 ( 如工艺因素 ) 和因变量 ( 如产品特性 ) 之间的数学联系。本研究的主要目的是通过QBD理念,提供一个药物制剂的稳健制备工艺,重点在于根据产品工艺的 IRMA ( 初始风险的矩阵分析 ) 和 FMEA ( 失效模式效果分析 ) 方法研究了解涉及生产的风险知识,以及如何更好地通过试验设计 ( DOE ) 和多变量数据分析 ( MVDA ) 确定设计空间,以降低这些风险。并在中试研究阶段制定控制策略进行工艺开发和放大,深入了解产品和工艺,以防在大生产中放大失败。因此,基于现有知识和原始试验数据,采用风险评估工具辨识潜在影响工艺/产品关键质量属性 ( IP/DP CQAs ) 的参数和确定其范围, IP/DP CQAs 参数范围将会通过实验进一步准确确定,并结合 DOE 、数学模型或研究来确定个体变量和潜在相互作用的重要性,使仅是机械理解上升到更高层次的过程理解。
2.0材料和方法
2.1材料
拉西地平 ( 印度 Cadila 制药公司 )
聚维酮 k30 ( 美国 ISP 公司 )
乳糖 200 目 & 乳糖 DCL 11 ( 荷兰DMV公司 )
96.6% v/v 乙醇 ( 印度 CVKUSML 公司 )
硬脂酸镁 ( Ferro Synpro 公司 )
欧巴代薄膜包衣粉 ( 印度卡乐康公司 )
2.2试验方法
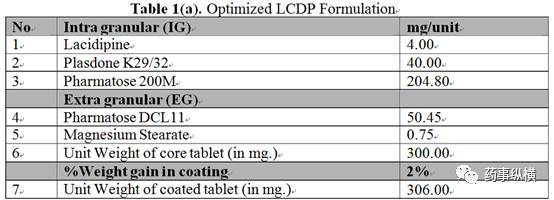
拉西地平 ( LCDP ) 是1,4-二氢吡啶衍生的“钙通道阻滞剂”类抗高血压药,起效缓慢,不产生反射性心动过速,具有长效作用和血管选择性高特点。每日口服一次即可。但是令人困扰的是, LCDP 是一种低剂量强效药物,具有低溶解度和高渗透特性,对制剂开发形成很大挑战。因此,选择流化床溶剂蒸发法作为固体分散体制备方法,该方法可提高润湿性,同时提高颗粒孔隙度和颗粒均匀分布性,从而达到含量均匀性要求。此外,它还能减少药物的晶体结构并促进其转化为更可溶的非晶态。具有理想的崩解时限和溶出速度的最佳处方是有 LCDP 、载体 ( PVP ) 、稀释剂和润滑剂组成,其中, LCDP 与载体的比例为 1:10 ,内加乳糖 ( 200目 ) 和外加乳糖 ( DCL 11 ) 的比例为 80:20 ,硬脂酸镁根据用量调整为 2% ,薄膜包衣粉用量也是 2% ,具体数值见 Table 1(a) 。此外,由于 LCDP 属于高变异药物,其受试者的生物利用度参数的变异性大于30%,因此,需要精确控制流化床工艺参数,根据预先确定的质量目标产品概况制备预期的稳健产品。
2.2.1 流化床制备固体分散体技术的开发
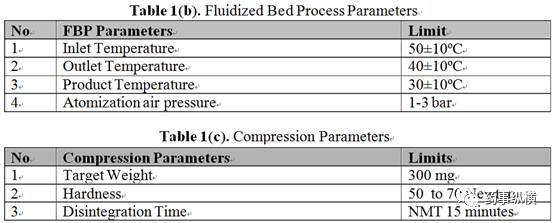
本研究在中试研究中,采用了 Glatt - GPCP5 流化床进行固体分散体的制备。首先,在缓慢的搅拌下将 LCDP 加入溶解于在乙醇 ( 99.6% v / v ) 中,直至溶液澄清;然后,边搅拌边缓慢加入 PVPk 30 ,直至得到澄清黄色药物溶液;接着采用顶喷制粒工艺,将一水乳糖 ( 200 目 )装载在流化床底部,喷入药物溶液润湿乳糖基质进行制粒。具体用量见 Table 1 ( a ) 。蠕动泵转速,喷速和雾化压力应缓慢地上升到最适合的参数,并每隔 10 分钟记录一次数值。完成制粒后,在同样的流化床参数下干燥,具体数值见 Table 1 ( b ) ,当 LOD 在 1.5% ~ 2.0% ,干燥完成。干颗粒过 20 目振荡筛整粒,然后将干颗粒与喷雾干燥乳糖 Pharmatose DCL - 11 ( 40 目过筛 ) 、硬脂酸镁 ( 60 目过筛 ) 一起加入双锥混合机,设置转速为 10 ± 2 RPM,进行总混,并采用 16 冲旋转压片机及 12.7 X 7.1 mm 椭圆形冲模压片,压片参数见 Table1 (c) 。包衣过程采用 Ganscoater® 包衣机,进风温度为 60 ± 10ºC,白色欧巴代为包衣液。
2.2.2 根据 QBD 理念优化流化床制备固体分散体 ( SD-FBP ) 的参数
ICH Q8 指导原则指出“质量不是检验出来的,质量是设计出来”。在任何情况下,产品的设计都是为了满足患者的需求和预期的产品质量和性能。开发一个更系统的强化版 QBD 方法,应在整个产品周期中结合现有知识、实验设计的研究结果 ( ICH Q8 ) 、质量风险管理 ( ICH Q9 ) 和知识管理 ( ICHQ10 ) 的应用。而对产品和生产工艺的深入了解将为制定更灵活的监管策略奠定基础。因此,通过强化版 QBD 来开发具有稳定性药物,应包括下列步骤:
2.2.2.1 描述目标产品质量概况
目标产品质量概况 ( QTPP ) 构成产品开发设计的基础,确定 QTPP 时,需要考虑预期产品的使用目的、给药途径、剂型、规格、包装、药代动力学特性、纯度和稳定性。
2.2.2.2 确定关键质量属性
关键质量属性 ( CQAs ) 是包括成品在内的产出物料的某种物理、化学、生物学或微生物学性质或特征,只有当这一性质或特征在一个适当的限度、范围或分布内,才能确保预期的产品质量。 CQAs 通常与原料、辅料、中间产品和成品有关。对于原料、辅料和中间产品, CQAs 还应包括那些影响成品 CQAs 的特性,如粒径分布,密度和流动性等。成品的潜在 CQAs 来源于 QTPP 和/或现有知识,并被用于指导产品工艺开发。对于口服固体制剂药物,其CQAs通常是指影响产品的纯度,规格,药物释放和稳定性。在处方研究和生产过程中,随着对产品知识和工艺了解的增加,潜在 CQAs 将会被修改。而相关的 CQAs 将会通过质量风险管理 ( QRM )和试验的迭代过程确定和优先化,以评估其变化对药物产品质量的影响程度。
2.2.2.3 采用QRM对CPPs进行关键质量风险分析
风险评估是质量风险管理 ( QRM ) 中有价值的、基于科学的一个过程 ( ICH Q9 ) ,有助于确定哪些物料属性和工艺参数可能对产品 CQAs 产生影响。风险评估通常是在开发阶段早期进行,并且随着获取到更多信息和更多知识而被重复进行。基于现有知识和原始实验数据,风险评估工具,即矩阵分析和失效模式和影响分析 ( FMEA ) 被简单用于辨识潜在影响 IP / DP CQAs 的参数,并确定其范围。风险分析是对已确认危害的相关风险的估计。风险评估是一种将发生的可能性和危害的严重程度联系起来的一种定性或定量过程。风险评估是根据所给的风险标准对所确认的和所分析的风险进行比较,而对危害的检测能力将影响风险评估。IP/DP CQAs 参数范围将会通过实验进一步准确确定,同时将结合 DOE 实验、数学模型或研究来确定个体变量和潜在相互作用的重要性,使仅是机械理解上升到更高层次的过程理解。
2.2.2.4 工艺参数的优化和设计空间的建立
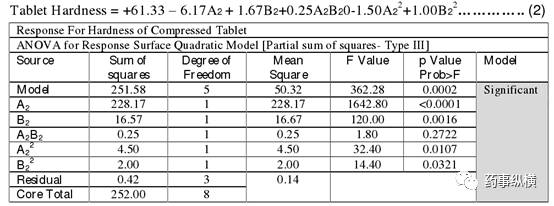
根据 IRMA 和 FMEA 分析结果,在超过 15 个工序中,将流化床制粒和压片确定为高风险工艺,并优先进行工艺了解试验,包括试验设计 ( DOE ) 和多元数据分析 ( MVDA ) 。为进行试验设计,对与产品质量紧密联系的每一独立的 CPPs 都进行了分析(如平均颗粒大小和片剂硬度)。并通过及时测定那些保证产品质量的原料和中间产品关键质量属性来安排、分析和控制生产。这里,因为32全因子设计分析法适用于构建二阶多项式模型的二次响应面,本研究采用该方法进行确定 CPPs 设计空间,这样,就能够优化喷液速度和雾化压力来达到所需的平均颗粒粒径(如 ≤ 400 um 且不结团),就能在最佳转台速度基础上,确定要求的硬度范围以达到符合溶出的预期硬度。本实验采用 Design-Expert® 软件 ( Version 8.0 ) 实施响应曲面法 ( RSM ) ,换算系数已包含在试验设计中,以适用于多种不同生产规模的换算。而各生产规模数值也在试验设计的描述中体现。
2.2.3基于已有的中试研究 QBD 的关键批放大
在制药工业中,流化床工艺从小试规模放大到大生产规模是一项持续的工作。产品开发的传统方法包括有限的开发和放大工作,最终确认通过核查 3 批次的关键规模。此外,最坏的情况就是“市场召回”和“产能利用不足”,表示放大失败。然而,在中试研究阶段,通过 QBD 理念监控和深入了解产品工艺后,所有关键步骤均会有纠正和预防措施,以防在更大规模生产中放大失败。从此,可接受质量的产品就会得到“无召回”保证,产能最大化。流化床放大结合了数学运算、工程学和个人判断。设备变量 ( 如设备的型号和大小 ) 和关键工艺变量 ( 如喷液速度、雾化压力和进风温度 ) 都会影响产品的质量属性。在大生产中,通过控制这些参数生产质量均一的产品,从而构建成功的放大策略。当然,所购买的原材料 ( 如原料药和辅料 ) 的质量一致性也是很重要的。
在流化床制粒 ( 干混合、喷液制粒和干燥 ) 的三个步骤中,喷液制粒是最关键阶段,也是最需要进行监测。颗粒的成型与长大、散开及溶剂的蒸发均会在这一阶段发生。因此,根据 QBD 理念,将在中试研究阶段制定的控制策略考虑与放大相关的风险,利用 QRM 工具去最大化提高在大规模生产的有效性,从而指导实际的生产活动。所推荐的设计空间需要进行监测评估,若参数在设计空间范围内不认为是变更,但当超出设计空间范围,将被认为是一种变更,并开始启动工艺变更批准监管流程。一旦有 CPPs 发生任何变更,将要求在变更批准后才能进行大生产。从小试或中试研究开发的设计空间到拟议的生产规模制造工艺的相关性已经被证明合理,对放大生产中潜在风险和工艺参数和物料特性的预设失效边缘也进行了讨论,一旦超出预设失效边缘将被认为是不符合要求的。
3.0 结果与讨论
3.1 根据 QBD 优化中试研究工艺参数
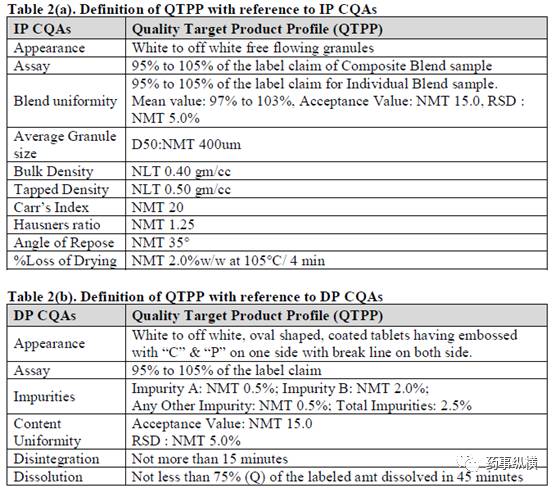
3.1.1 参照 IP/DP CQAs 定义 QTPP
参照 IP CQA 和 DP CQA 定义了与质量、安全和有效性息息相关的 QTPP 。给药途径、剂型、生物利用度和稳定性详见 Table 2 。
3.1.2影响 CQAs 的处方变量的确定
Table 3 中概括总结了所确定的影响产品质量 API 和辅料的 CQA ,以便对产品特性进行研究和控制。其中,红色表示影响风险高,绿色为影响风险低。在API所有理化性质中,与其他理化性质相比,晶型、溶解度、稳定性和纯度对最终产品质量的影响风险均为高。而辅料中,乳糖 ( 内加和外加 ) 作为底物,其粒径大小和制备固体分散体所需的API与PVP的比例是最关键的参数,对最终产品质量的影响最显著。当然,溶剂的选择对成品中杂质的产生起主要作用。
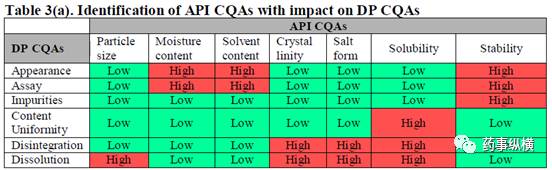
绿色代表对成品 CQAs 影响风险低,红色代表对成品成品 CQAs 影响风险高。根据初始矩阵分析得出,API的溶解度和稳定性对成品质量的影响风险为高。
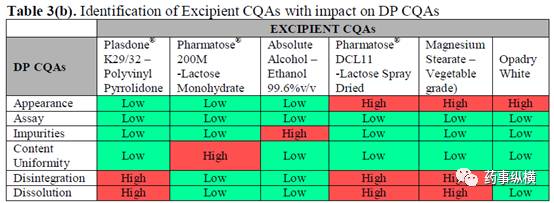
绿色代表对成品 CQAs 影响风险低,红色代表对成品成品 CQAs 影响风险高。根据初始矩阵分析得出, PVPk 30 和喷雾干燥乳糖 ( Pharmatose® DCL 11 ) 对成品质量的影响风险为高。
3.1.3通过 IRMA 和 FMEA 分析,对影响 IP/DPCQAs 的工序进行确定和质量风险分析
Table 4 列出了所确定的生产工序和通过现有知识和风险评估工具确定的关键工艺参数 ( CPPs ),所采用的风险评估工具为初始风险矩阵分析 ( IRMA ) 和失效模式和效果分析 ( FMEA ) 。包含危害严重性、发生率和监测能力在内的风险,其对产品质量的风险大小因为风险管理有所变化。
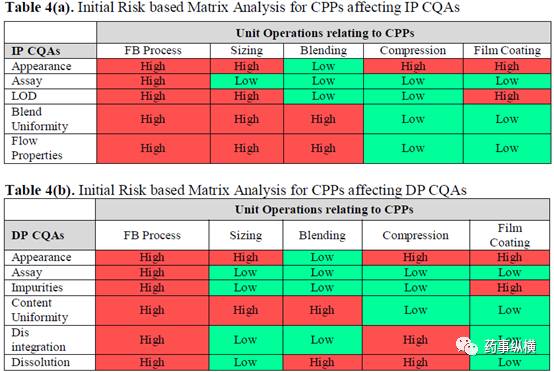
绿色代表对成品 CQAs 影响风险低,红色代表对成品成品 CQAs 影响风险高。根据初始矩阵分析得出,流化床制粒和压片工序对成品质量的影响风险为高。
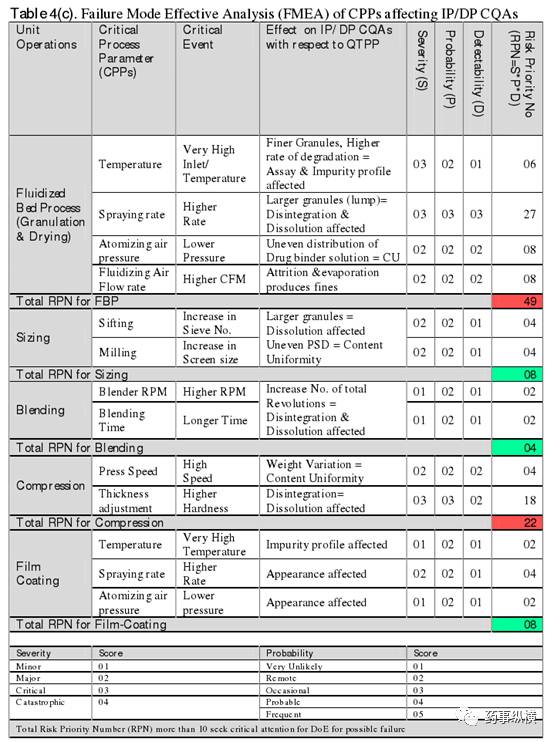
3.1.4通过 DOE 和 MVDA 进行工艺参数的筛选和优化
根据IRMA和FMEA分析结果,在超过 15 个工序中,将流化床制粒和压片确定为高风险工艺,并优先进行工艺了解试验,包括试验设计 ( DOE ) 和多元数据分析 (MVDA)。为了进行试验设计,对与产品质量紧密联系的每一独立的 CPPs 都进行了分析 ( 如平均颗粒大小和片剂硬度 ) 。并通过及时测定那些保证产品质量的原料和中间产品关键质量属性来安排、分析和控制生产。具体的 DOE 试验和 MVTD 分析详见 Table5 。
3.1.5设计空间的建立
设计空间阐述了工艺变量和关键质量属性之间的联系。
3.1.5.1 变量选择
风险评估和工艺研究实验能够了解工艺参数和原料属性对产品 CQAs 的联系和影响,并帮助确定实现质量均一性的变量及其范围。
3.1.5.2 设计空间VS经验证的可接受范围
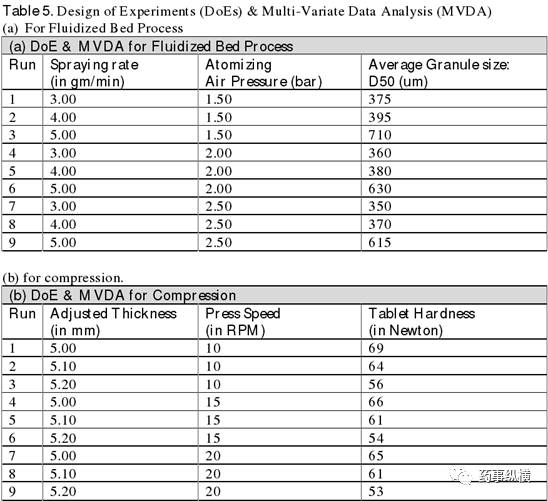
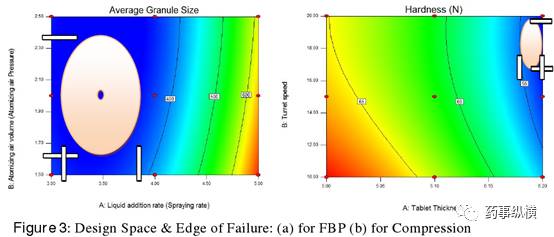
经验证的可接受范围并不能作为设计空间。基于多变量实验的经证实的可接受范围提供了有关工艺参数的有用知识,即 Figure 2 的白色区域,处于 3D 七彩曲面图中代表风险最低的紫色区域内。 3D 曲面图中,红色代表风险最高,也代表了 CPPs 的风险边缘。
当CPPs在设计空间范围内不认为是变更,但当超出设计空间范围,将被认为是一种变更,并开始启动工艺变更批准监管流程。一旦有 CPPs 发生任何变更,将要求在变更批准后才能进行大生产。
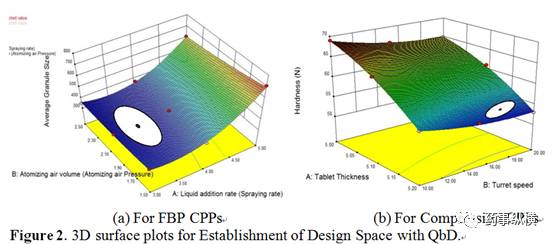
根据流化床工序编码因子得出设计空间的最终公式为:
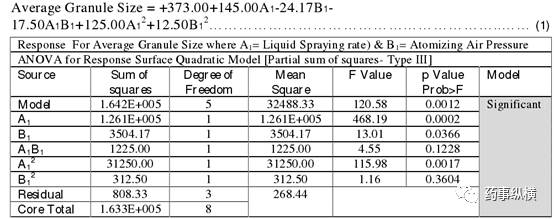
根据压片工序编码因子得出设计空间的最终公式为:
由公式 1 可知,喷液速度 ( A1 ) 对平均颗粒大小有正相关作用,而雾化压力 ( B1 ) 却有负相关作用。当增大喷液速度时,平均颗粒大小增大,但当增大雾化压力时,平均颗粒大小减小。 F 值为 120.58 ,表明流化床工序的设计空间模型有显著意义,而由于噪音影响,模型F值出现这么大的几率仅为 0.12% 。当 A1 、 B1 和 A12 的 Prob > F 值小于 0.05 时,说明模型有显著意义。但当 Prob > F 值大于0.1时,说明模型没有显著意义。
由公式 2 可知,厚度 ( A2 ) 对片剂硬度有负相关作用,而转盘转速 ( B2 ) 却有正相关作用。 F 值为 362.28 ,表明压片工序的设计空间有显著意义,而由于噪音影响,模型F值出现这么大的几率仅为 0.02% 。当 A2 、 B2 和 A22 B22的 Prob > F 值小于 0.05 时,说明模型有显著意义。但当 Prob > F值大于 0.1 时,说明模型没有显著意义。
3.1.5.3 设计空间和失效边缘
从经精确分析而得的 CPPs 二维等值线图可知,在七彩图中,紫色代表经验证的可接受范围,红色代表失效边缘,两者在图中均有明确边界线标出。详见 Figure3 。
3.1.6 控制策略的概述
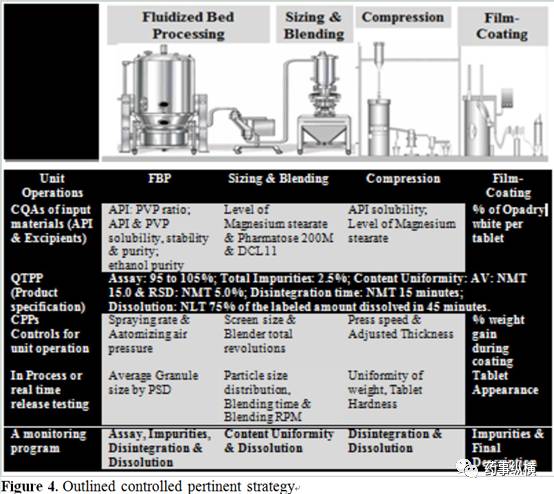
基于 QBD 理念的全面开发,需要构思控制策略以保证采用所确定的工艺能够生产出质量一致的产品,并能成功放大生产。控制策略描述和论证了工艺过程控制、以及对起始物料(原料和辅料)、中间产品和成品包装的控制是怎样有利于最终产品质量。而这些控制策略是基于对产品、处方和工艺的理解,至少包含关键工艺参数和物料属性两方面的理解。同时也应对影响产品质量的物料来源变化进行确定、适当了解和控制。了解物料来源变化及其对后处理工艺、中间产品和成品的影响将利于调整控制策略及将所需进行产品试验降低到最少。
最终控制策略包括下列内容,同时也在 Figure 4 中列出。
1. 影响工艺和产品质量的起始物料 ( 如原料、辅料、内包材 ) 控制管理;
2. 产品说明书;
3. 影响后续工艺或产品质量的工序控制管理;
4. 过程监测或实时监测代替最终产品监测;
5. 验证多变量预测模型的监控方案;
3.2 基于已有的中试研究 QBD 的关键批放大
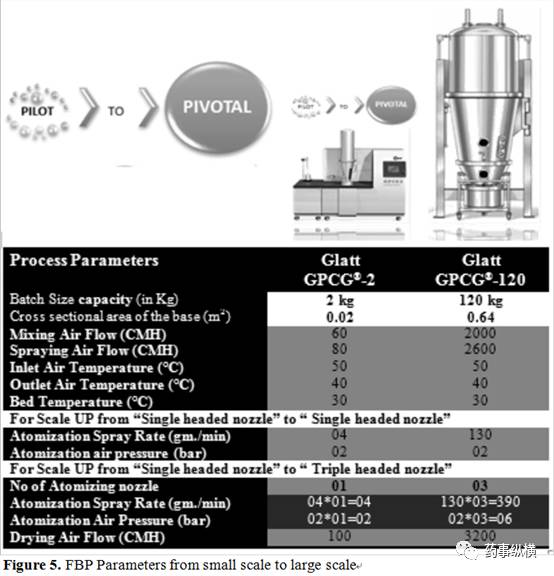
下列内容阐述了通过 Glatt® 流化床,如何将产品从 5 kg 放大到 120 kg。放大参数详见 Figure 5 。
3.2.1 批量大小和设备选择
如果采用同样的流化床设备,从小试研究放大到生产中将会容易很多。但是,由于进风流速、流化床腔体、喷嘴等与小试不一样,工艺参数调整实验还是需要做的。对于本研究所采用顶喷流化床设备,其最小和最大批量按照公式 ( 1 ) 和公式 ( 2 ) 可以估算而得。

3.2.2 流化床进风风量放大
为保证同样的流化速度,根据流化床进风量装载产品腔体的横切面面积,在大生产中,进风风量应增大。本研究中大生产所用的容器的横截面积为 0.64m2 ,小试研究所用的容器横截面面积为 0.02 m2 ,按照公式3可以计算得到正确的进风风量。

3.2.3 喷速和雾化压力的放大
喷速放大取决于设备干燥能力而不是随着批量增大,而设备干燥能力与空气分布板的横切面面积成正比。当雾化压力和进风风量不变,改变液体喷雾速度直接影响液滴大小进而影响粒子聚集,也有可能导致结团。根据空气分布板的横切面面积,按照公式(4)计算,可得到合适的放大喷液速度。

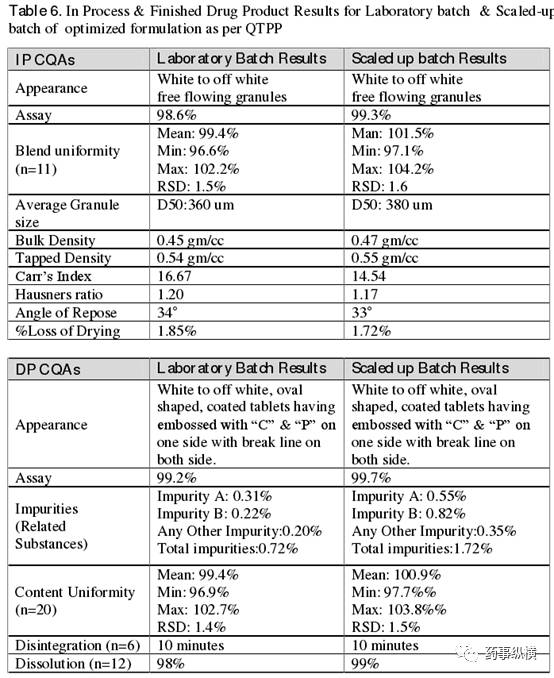
为得到同样大小的颗粒,在同样的雾化压力下,放大生产中的三头喷嘴可做到与中试研究一样的喷液速度。但是,这样将会大大延长制粒时间。其实,此次放大生产中,还有另一种方法可得到相似的液滴大小以制备出 400 μm 的颗粒,那就是通过保持喷液速度和雾化压力的均衡性。将雾化压力增大至 2* ( 3 ) = 6 bar ,喷液速度增大至 130* ( 3 ) = 390 ~ 400 g/min ( 3 表示喷头的数量 ) ,以保证喷出同样的液滴大小,最终得到符合 IP CQAs 和 DP CQAs 要求的理想颗粒。小试批和放大批的 IP CQAs 和 DP CQAs 结果详见 Table 6 。
4.0 讨论
通过试验设备、操作条件和辅料质量的筛选, SD-FBP 技术已实现了从小试研究放大到大生产。流化床工序中,采用了 QBD 理念完成处方工艺的研究,并对所有 CQAs 和 CPPs 进行了关键风险分析,最终制得质量极好的颗粒。
根据详细的FMEA风险分析,对于难溶性和高生物变异药物 LCDP ,流化床制粒和压片两个工序是实现 QTPP 的最大风险障碍。因此,对这两个工序的进行了深入研究,并根据经验证的可接受范围和预设失效边缘确定了影响 IP/DP CQAs 的 CPPs 设计空间。统计分析中,为实现所预测的 QTPP ,采用了 32 全因子试验和优化技术成功开发了 SD - FEP 的稳健制备工艺。流化床工艺的执行进需要进行监控,以确保其按照预期进行工作,从而实现设计空间所预测的产品质量属性。监控内容应包括生产过程的趋势分析和日常生产中其他试验。对于采用数学模型的设计空间,需要定期维护,以保证模型性能。模型维护采用内部质量系统来管理的示例,并提供设计空间不变性。因此,在中试研究阶段,了解物料来源变化以及其对后续工艺、中间产品质量和成品质量的影响,可为将进行性关键批生产阶段的控制调整提供灵活性,并在大生产中能将所需进行产品试验次数最小化和放大成功率最大化。
原文名称:Development and Scale-Up of SD-FBP Formulation Technology in line with parametric QbD;
作者:Amit Mukharya ect.;
出版杂志:Research Journal in Pharmaceutical Sciences
更多干货尽在药事纵横网站,我们的网址:www.pharmaguider.cn ,欢迎广大朋友访问我们的网站,可以点击原文链接,一键直达。

药事纵横是一个开放,由自愿者组成的团体,现有成员14名,分别为Voyager88,雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,蓝色枫叶,ISAL,海角边,冯姝婷,yhqqqqq,陈小牛,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711679














