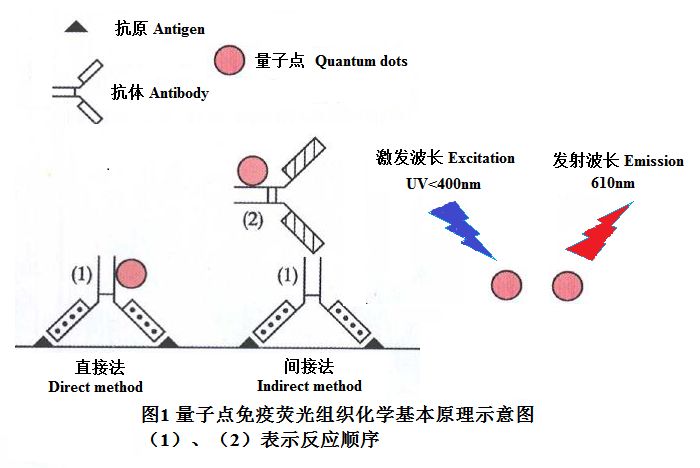
量子点免疫荧光组织化学(
Quantum Dots based Immunohistochemistry, QD-IHC
)又称量子点免疫荧光细胞化学,是根据抗原
—
抗体特异性结合的原理,用量子点标记特异性抗体作为探针,检测组织或细胞中抗原性物质的一种技术。量子点免疫荧光组化技术主要有直接法和间接法:直接法是以量子点标记一抗孵育标本以检测其中的抗原成分;间接法则先后加入一抗和量子点标记二抗,形成抗原
—
一抗
—
二抗复合体以达到检测该抗原的目的,该法因二抗的放大作用而具有更高的敏感性。
量子点,又称为纳米晶,是一种由
II
-
VI
族或
III
-
V
族元素组成的
纳米颗粒
,其粒径介于
1
~
10nm
之间。由于电子和
空穴
被量子限域,连续的
能带结构
变成具有分子特性的分立能级结构,受激后可发射
荧光
。它具有以下主要性质:
(l)
量子点的
发射光谱
可通过改变量子点的尺寸和化学组分来控制,波长覆盖整个可见光区;
(2)
量子点具有很好的光稳定性,与最常用的有机荧光材料
“
罗丹明
6G”
相比,其荧光强度高
20
倍,稳定性高
100
倍以上;
(3)
量子点具有宽的激发谱和窄的发射谱,可以实现一元激发,多元发射,且多色量子点间不出现
光谱
交叠;
(4)
量子点具有较大的
斯托克斯位移
,可以避免发射光谱与
激发光谱
的重叠;
(5)
生物相容性好,量子点经过各种
化学修饰
之后,可以进行特异性标记;
(6)
量子点的荧光寿命长。有机
荧光染料
的
荧光寿命
一般仅为几纳秒
(
这与很多生物样本的自发荧光衰减的时间相当),而量子点的荧光寿命可持续数十纳秒(
20ns
∽
50ns)
,这使得光激发后,大多数生物自发荧光已经衰变,而量子点荧光仍然存在,此时即可得到无背景干扰的荧光信号。
与传统的染料分子相比,量子点具有多种优势,是一种理想的荧光探针。比如可承受多次激发和光发射;持久的稳定性可以让研究人员更长时间地观测细胞和组织;量子点色彩丰富,可观察生物体系的复杂性。量子点特殊的光学性质使得它在
生物化学
、
分子生物学
、
细胞生物学
、
基因组学
、
蛋白质组学
、
药物筛选
、
生物大分子
相互作用
等研究中有极大的应用前景。
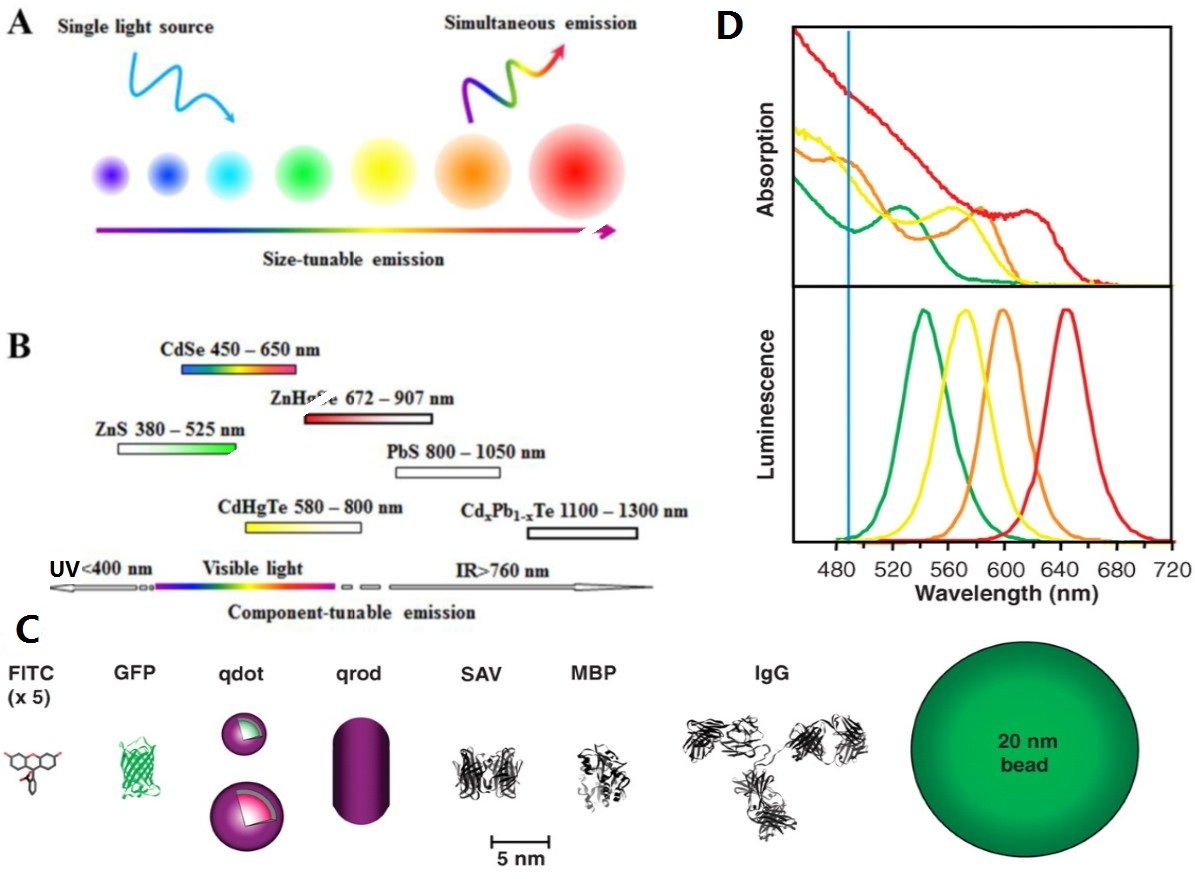
图
2
量子点的组成及其性质
1.
标本准备
①石蜡包埋组织切片:由病理室常规处理
②冰冻组织切片:由病理室常规处理
③细胞爬片:将无菌盖玻片置于六孔板中,接种细胞,待细胞生长达到
60
%以上后取出玻片,
4%
多聚甲醛固定
2 h
。
2.
试剂准备
①抗体选择
单克隆抗体针对单一表位,具有较高的特异性,但在该表位破坏后将得不到阳性结果;多克隆抗体表位针对多个表位,可避免单克隆抗体的缺点,但是可能出现非特异性杂交。因此,不论选择单克隆还是多克隆抗体,最好同时购买两个货号的抗体,购买抗体时一定要明确是能够做
IHC
的抗体,抗体说明书上必须有
IHC
测试结果。如果该分子文献报道较多,可选择文献上常用的经典抗体。
②一抗与二抗
通常一抗有小鼠、大鼠、兔、人和豚鼠等动物源性;常规二抗包括羊抗鼠、羊抗兔、羊抗人、兔抗鼠、兔抗人等。
③量子点
QD
610nm
QD
610nm
激发波长为
UV<400nm
;发射波长
610nm
。
④其他试剂
二甲苯、无水乙醇、苏木素、中性封片树脂、柠檬酸钠
3.
抗体特异性验证
所有免疫组化抗体均须
Western blot
验证抗体特异性,并需免疫荧光实验验证抗原定位。
4.
耗材准备
免疫组化笔或者蜡笔、盖玻片、载玻片
5.
溶液配制
①磷酸盐缓冲液(
PBS
)
10×PBS
母液配制
NaCl 72 g
Na
2
HPO
4
·12H
2
O 37.3 g
KH
2
PO
4
4.3g
加蒸馏水至
1000 ml
,充分混匀贮存。
使用时用蒸馏水
10
倍稀释,调整
pH
值至
7.3—7.4
。
②柠檬酸抗原修复液
抗原修复使用柠檬酸
-
磷酸氢二钠缓冲液,配方如下:
称取柠檬酸
10.5 g
,溶于
500 ml
蒸馏水;称取
Na
2
HPO
4
·12H
2
O 57.3g
,溶于
800 ml
蒸馏水。分别量取
358 ml
柠檬酸溶液和
642 ml Na
2
HPO
4
溶液,充分混匀后调整
pH
值至
6.0
,即得
2×
母液,贮存备用。
③
1%
盐酸酒精
浓盐酸与
75%
酒精按照
1:99
比例混合,充分混匀。
1.
组织片脱蜡水化
①将组织片依次放入
3
个装有二甲苯溶液的玻璃缸中浸泡,每缸
15 min
。
②依次放入
2
个装有无水乙醇的玻璃缸,每缸
5 min
。
③依次放入
2
个装有
95%
乙醇的玻璃缸,每缸
5 min
。
④依次放入
90
%乙醇、
85
%乙醇、
75%
乙醇的玻璃缸,每缸
2 min
,取出。
⑤放入自来水、蒸馏水的玻璃缸中清洗,重复
3
次。
2.
抗原修复
将切片浸入
1×
柠檬酸
-
磷酸氢二钠缓冲液中,高压煮沸后继续加热
2 min
,然后停止加热让切片自然冷却。
注意:抗原修复过度或不足,均会影响最终染色结果。切片骤冷可致脱片,必须自然冷却!
3.
封闭内源性过氧化氢酶
①放入
3% H
2
O
2
溶液的玻璃缸中,浸泡
15 min
。
②放入蒸馏水的玻璃缸中清洗,重复
3
次。
③放入
PBS
缓冲液的玻璃缸中,浸泡
5 min
。
4.
抗原抗体反应
①甩去
PBS
余液,将组织片平辅在湿盒中,加正常山羊血清
1
滴
20 µl
(根据组织大小调整用量),
28
℃放置
20 min
,甩干。
②直接法:加稀释好的量子点标记一抗;间接法:加稀释好的一抗
1
滴(
20~50 µl
,根据组织块大小进行调整),置于湿盒
4
℃过夜。
③置
PBS
缓冲液的玻璃缸中,缓慢振荡清洗
5 min
,更换
PBS
缓冲液,同法操作
4
次,甩干。
④间接法:量子点标记的二抗
20~50 µl
(根据组织块大小进行调整),放置湿盒,
37
℃放置
20 min
。
⑤置
PBS
缓冲液的玻璃缸中,缓慢振荡清洗
5 min
,更换
PBS
缓冲液,同法操作
3
次,甩干。
5.
荧光显微镜下进行观察
将直接法与间接法荧光染色的切片至于荧光显微镜下观察,选择激发波长为












