犹他大学的基因工程研究员Dana Carroll说:“这项研究是一项壮举,我也许没有这种勇气去尝试他们所做的事情,我要向David Liu致敬。”

本周两个研究小组宣布了CRISPR技术的重大突破:他们研发出了能精确靶向RNA和DNA的新CRISPR技术,这种方法与原始的CRISPR基因编辑系统不同,后者是一种虽然可以剪切大部分DNA,但相对来说不可预测,且不是十分锋利的“分子剪刀”,而新技术系统则能重写单个碱基,这一改变单一碱基的能力意味着研究人员现在可以一半以上的人类遗传疾病了。
这两大成果分别公布在Science和Nature杂志上,由CRISPR技术先驱张锋研究组,以及David Liu研究组完成。
C•G → T•A
生物学课本告诉我们,核酸中的含氮碱称碱基,包括嘌呤和嘧啶两类。嘌呤主要有腺嘌呤(adenine,A)和鸟嘌呤(guanine,G);嘧啶主要有胞嘧啶(cytosine,C)、尿嘧啶(uracil,U)和胸腺嘧啶(thymine,T)。在DNA中,碱基A和T配对,C和G配对,就像字母一样,编写了人类的遗传信息。在人类的疾病中
,由鸟嘌呤(G)向腺嘌呤(A)的突变极为常见 。类似的突变能在罹患局灶性癫痫(focal epilepsy) 、杜氏肌营养不良 、或是帕金森病的患者体内找到
。因此如果能逆转这一常见突变 ,把A矫正回G,就有望从根源上治疗这些疾病 。
到目前为止,CRISPR-Cas9基因组编辑方法一直依赖于称作为同源介导修复(Homology-directed repair,
HDR)的细胞机制,DNA双链断裂可以触发HDR。研究人员提供给细胞一个包含所需序列的模板,用Cas9酶造成靶向双链断裂,随后等待看HDR是否能够整合进这一模板重新连接DNA链。不幸地是,这种方法低效,且往往会以随机核苷酸插入或缺失形式在断裂点周围导入一些新的错误,使得它无法适用于治疗纠正点突变。
去年,David
Liu研究组构建出了一种新型的“碱基编辑器”,能够在人类和小鼠细胞系中以低出错率永久及高效地将胞嘧啶(C)转化成胸腺嘧啶(T)碱基。
具体来说,他们首先失活了Cas9的一部分,使得它无法造成双链断裂。随后他们将Cas9与胞苷脱氨酶连接在一起,无需切割DNA胞苷脱氨酶能够直接催化C转换为U。将这一机器送入到细胞内可在靶点处造成错配的碱基对,靶DNA上包含新导入的U,反义链上为原始的鸟嘌呤(G)碱基。
这一方法无需切割基因组的双螺旋,就能将靶标DNA碱基进行更换,因此被广泛应用于校正真菌,植物,鱼和小鼠中的基因,甚至在携带可导致血液病症的缺陷基因人类胚胎中也得以使用。但是这种编辑方法只能实现两种化学转化:将胞嘧啶(C)转化成胸腺嘧啶(T)或鸟嘌呤(G)转化为腺嘌呤(A)。
A•T → G•C
最新发表于Nature上的研究(Programmable base editing of A•T to G•C in genomic DNA
without DNA
cleavage)实现了上述的反方向,也就是将腺嘌呤(A)或胸腺嘧啶(T)转化为胞嘧啶(C)或鸟嘌呤(G),这样就可以消除最常见的“点突变”类型。
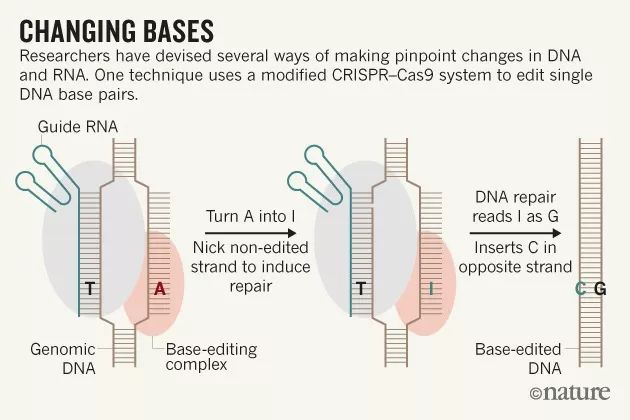
研究证实,
在人胚胎肾细胞和骨癌细胞中,这种技术能以约50%的效率进行校正,而且几乎没有可检测到的副产物。相比之下,更传统的基于CRISPR的方法,只能达到小于5%的效率,并且经常会导致未预料的大块DNA插入或缺失。
首尔国立大学分子遗传学家Jin-Soo
Kim点评道:“这是基因组编辑领域的重大突破。”





