作者 l Armstrong
编辑
l 小卒子
基石药业的全人源PD-L1抗体药物CS1001由药明生物合作研发,于2016年7月提交IND,2017年7月获批临床。2017年9月,药明生物PD-L1抗体制剂专利201710431179 .X公开,该专利即CS1001的制剂专利。小编特此梳理CS1001的制剂开发过程和制剂处方。
分析依据
201710431179 .X专利中所述制剂研究的活性成分主要是PD-L1抗体:1.14.4抗体。小编在前文“
基石药业PD-L1抗体药物CS1001研究报告
”中已经分析过,1.14.4克隆很大程度可以确定是CS1001最终选用的克隆号。制剂专利涉及的其他克隆号也与CS1001专利中克隆号一致。
从时间上看,201710431179 .X专利中三批制剂稳定性的批号分别是20151002、20151103、20151104,说明三批制剂的灌装时间在2015年底,一般在药品申报时需要提交6个月初步稳定性研究,而CS1001的IND申请时间是2016年7月,时间上基本符合,也说明项目进度较为顺利和迅速。
综上,小编分析认为专利201710431179 .X为CS1001的制剂专利。专利中给出了12个月稳定性研究数据,根据时间分析,基本上也可以确定为CS1001的相关制剂开发过程和制剂处方。
CS1001制剂处方
根据201710431179 .X中的处方筛选过程,和稳定性选用的处方,判断CS1001的处方为其中的配方13:
-
30mg/ml PD-L1抗体;
-
20mM 组氨酸-盐酸组氨酸盐缓冲液;
-
150mM 甘露醇;
-
55mM 氯化钠;
-
0.01% 聚山梨酯80;
-
pH=5.5.
CS1001制剂处方和已上市PD-L1抗体药物的处方对比如下:

CS1001制剂开发过程
CS1001的
制
剂处方筛选采用单因素
/
正交试验方法来确定,筛选过程如下:
第一轮处方筛选:缓冲液体系和
pH
优化
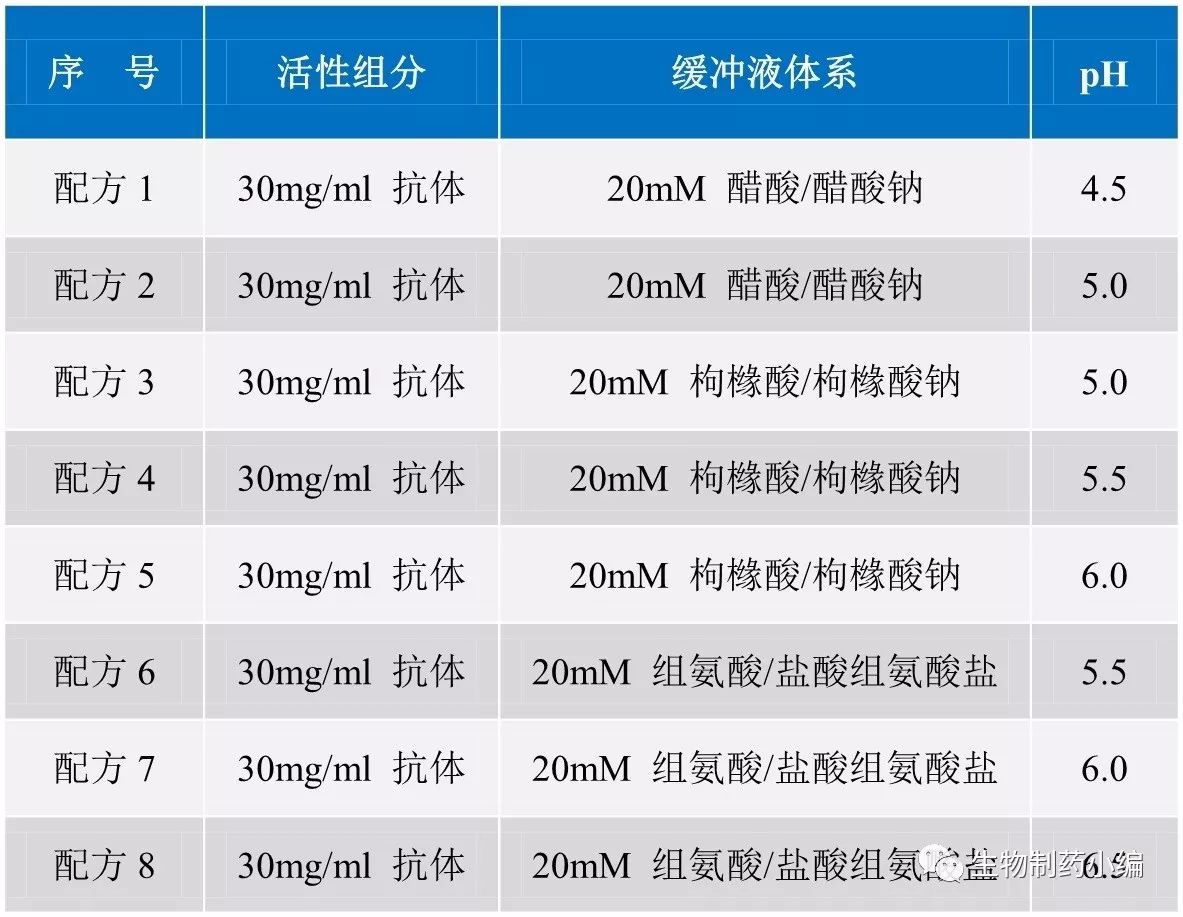
2-8℃、40℃加速条件下分别保存,0周、2周、4周时CEX-HPLC检测样品。
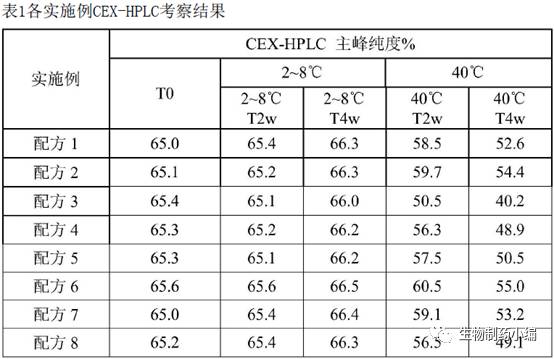
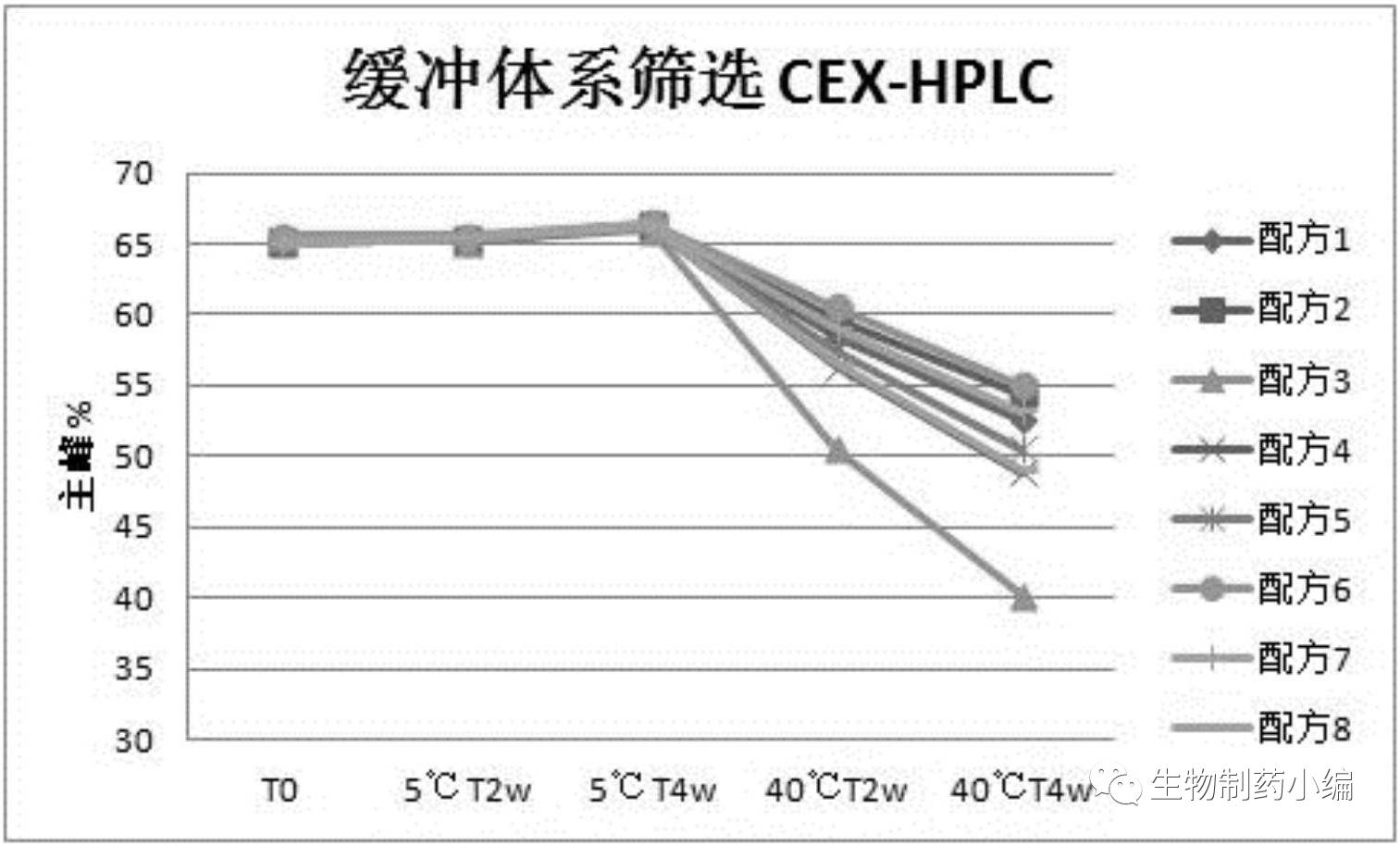
确定配方
6
为最佳缓冲液体系和
pH
值。
第二轮处方筛选:辅料筛选
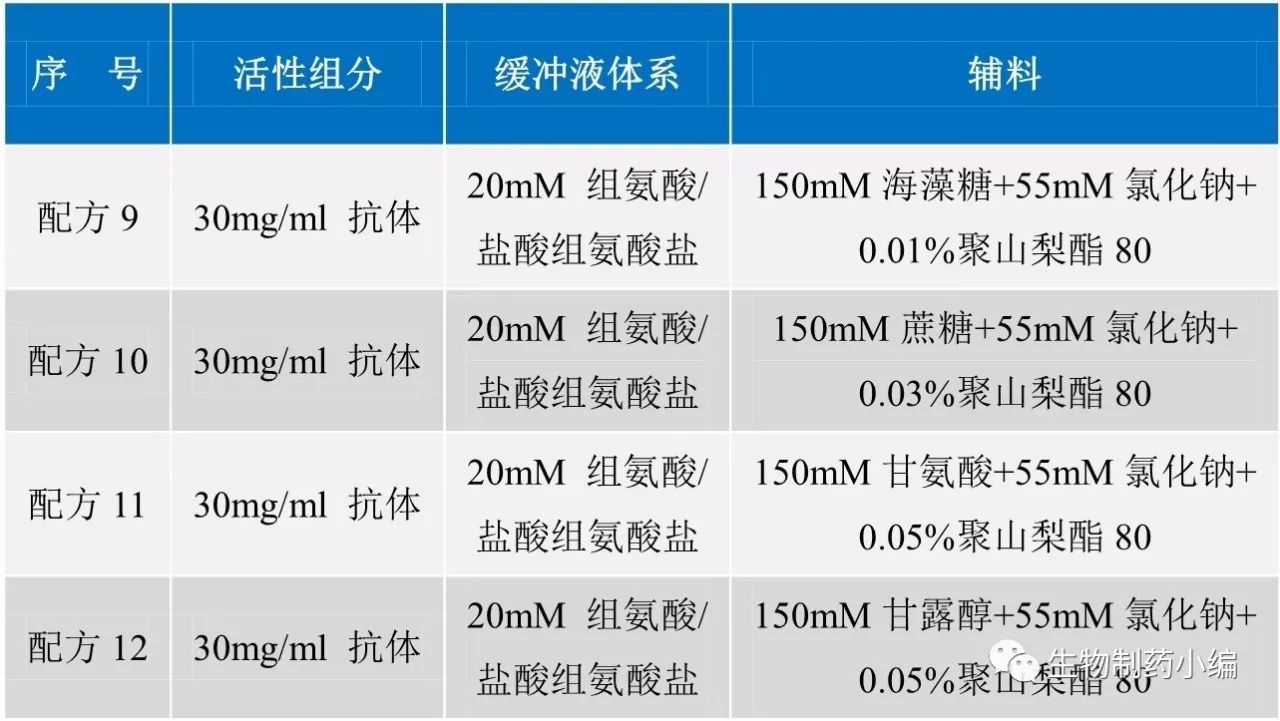
2-8℃、40℃加速条件下分别保存,0周、2周、4周时CEX-HPLC检测样品。
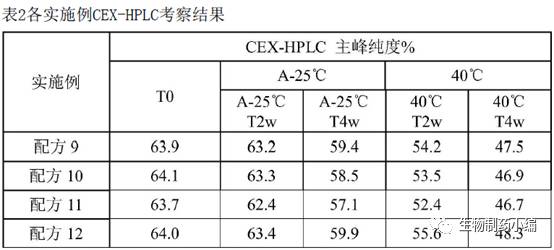
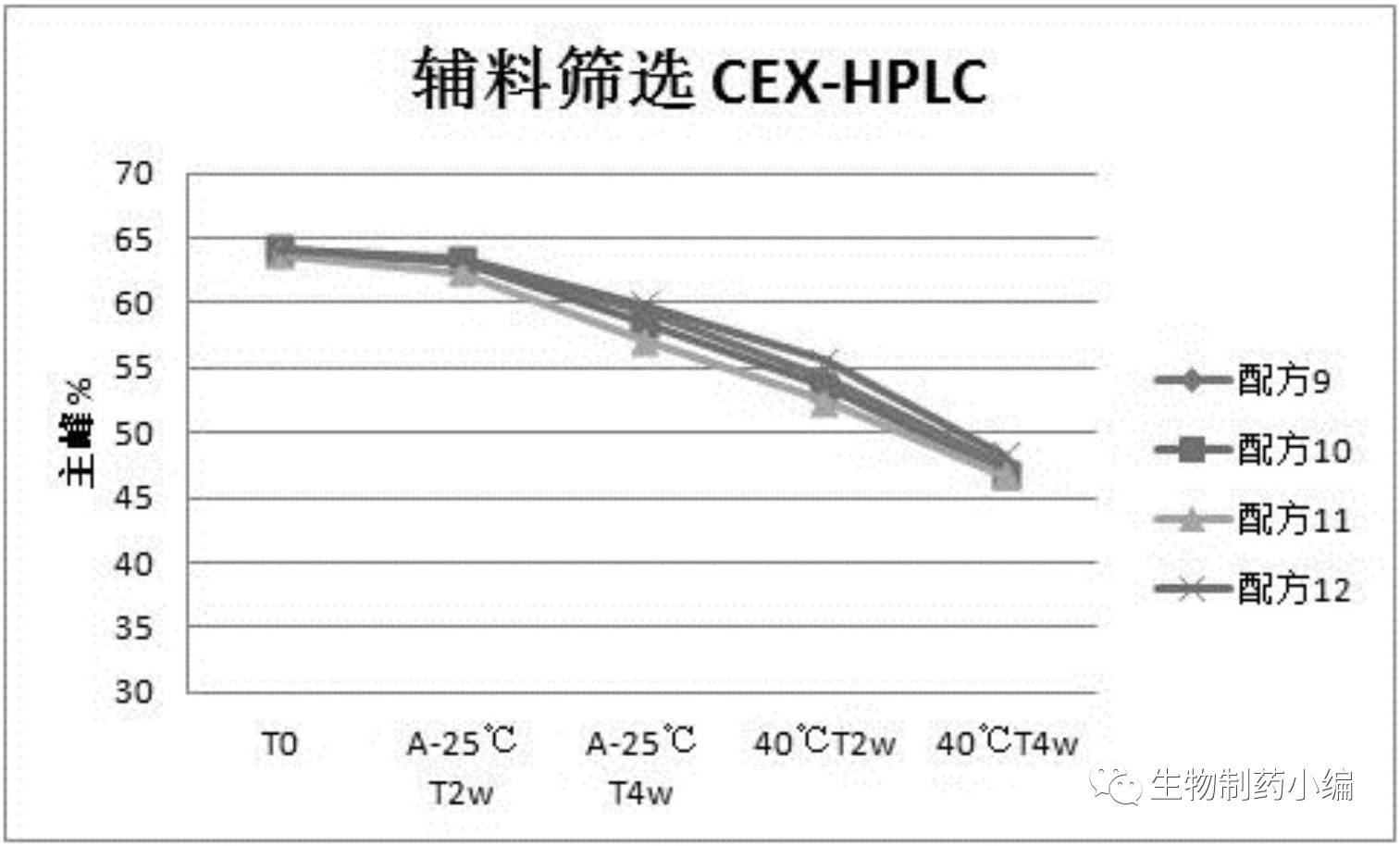
确定配方
12
为最佳辅料。
第三轮处方筛选:表面活性剂
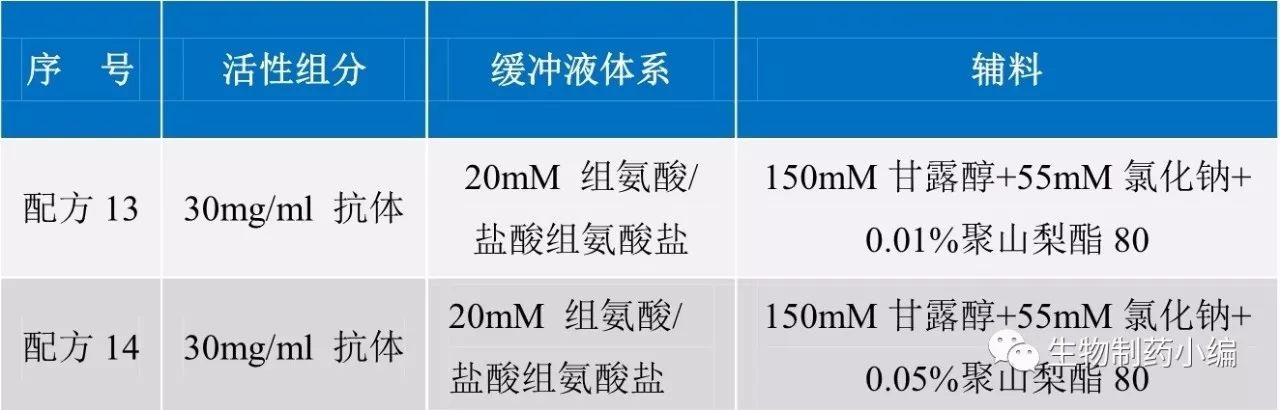
2-8℃、40℃加速条件下分别保存,0周、2周、4周时CEX-HPLC检测样品。
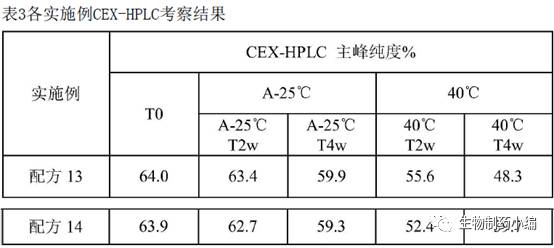
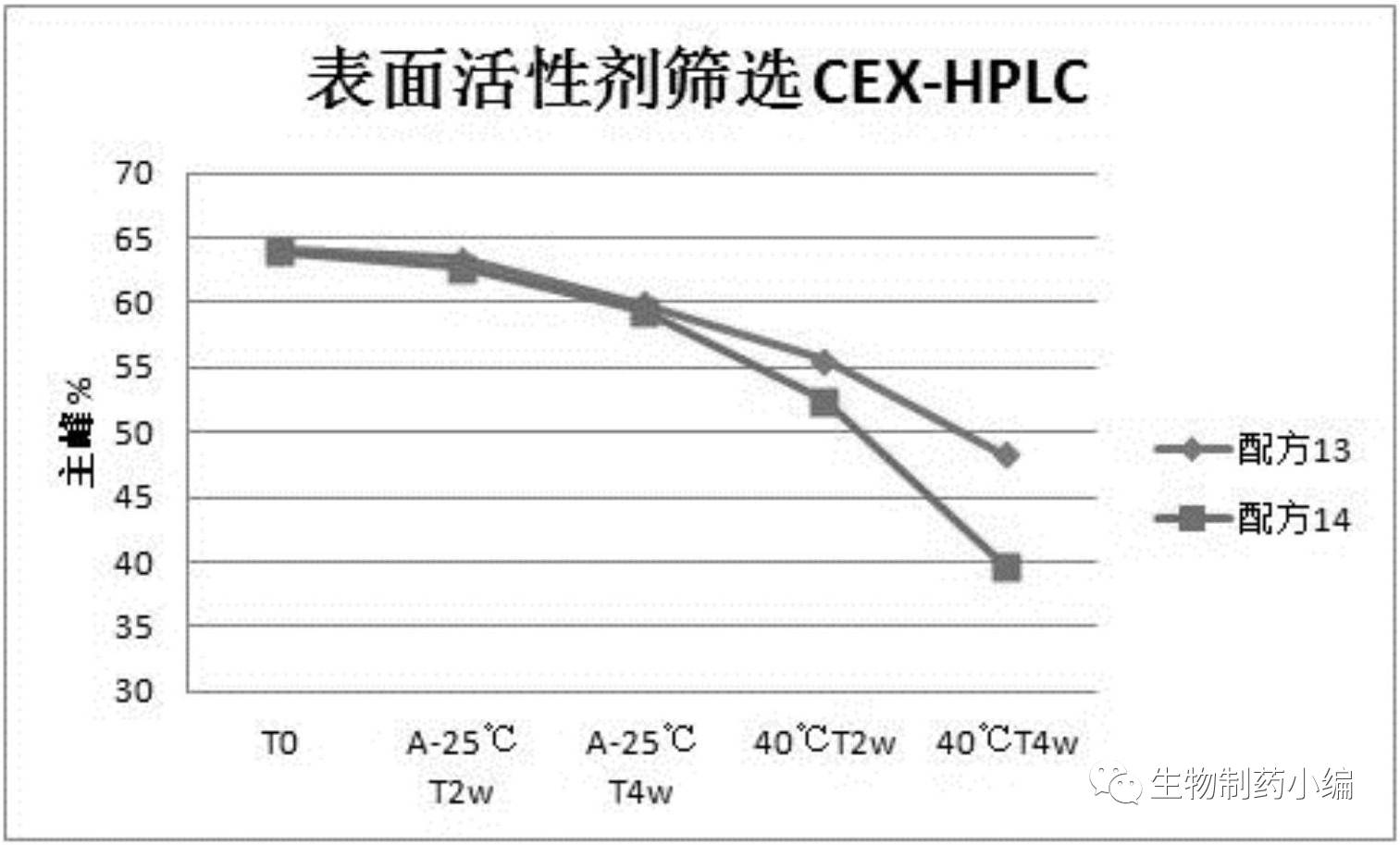
确定配方
13
为最佳表面活性剂。
最终,用配方
13
作为制剂处方,配制
3
批制剂,
2-8
℃
12
个月稳定性研究、室温
25
±
2
℃
6
个月稳定性研究数据如下。
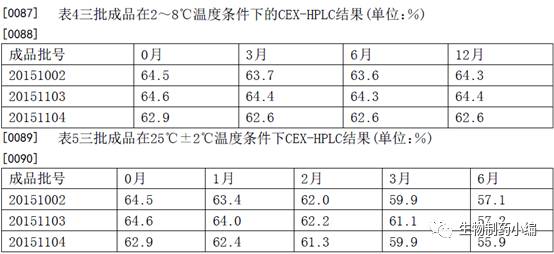
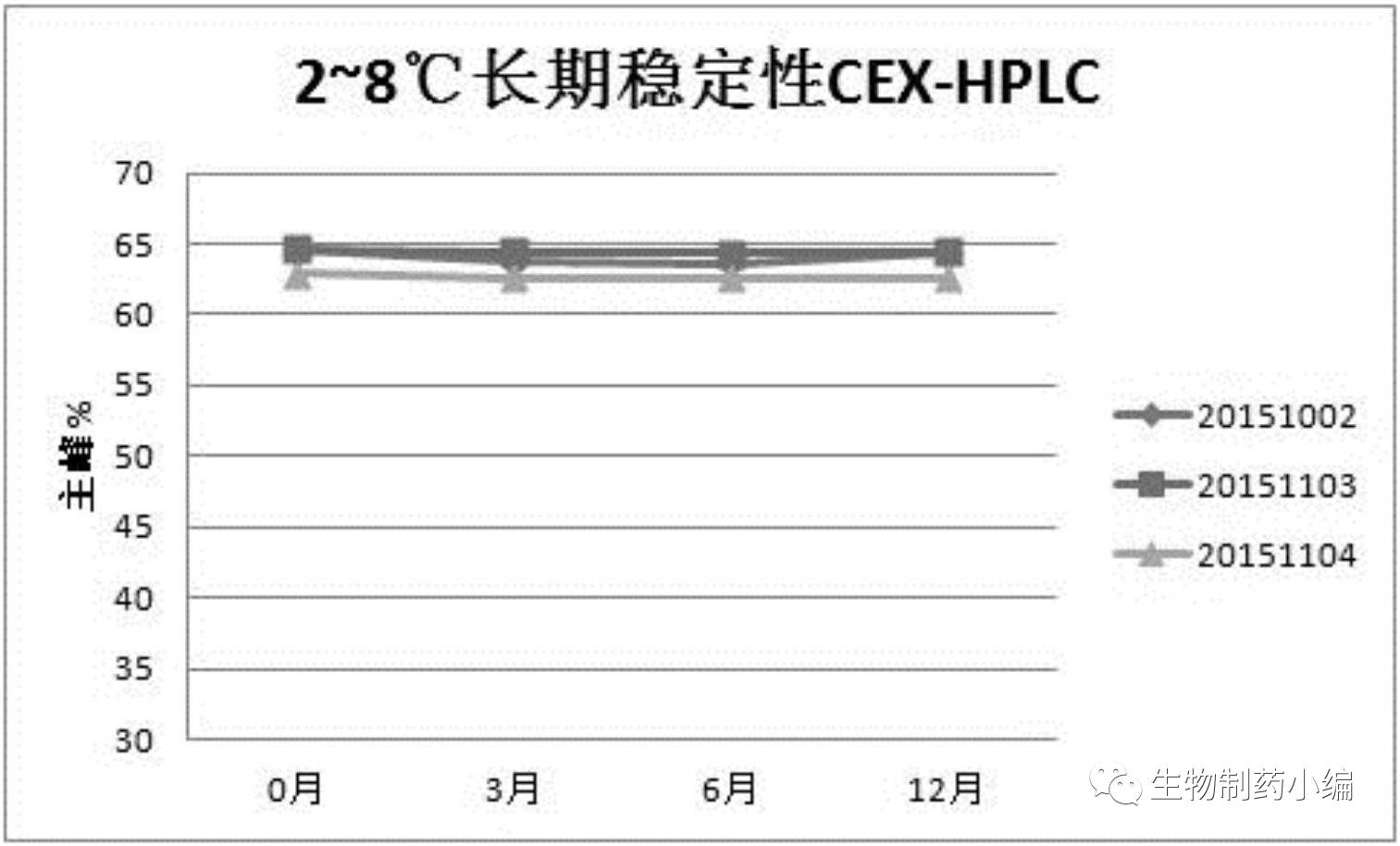
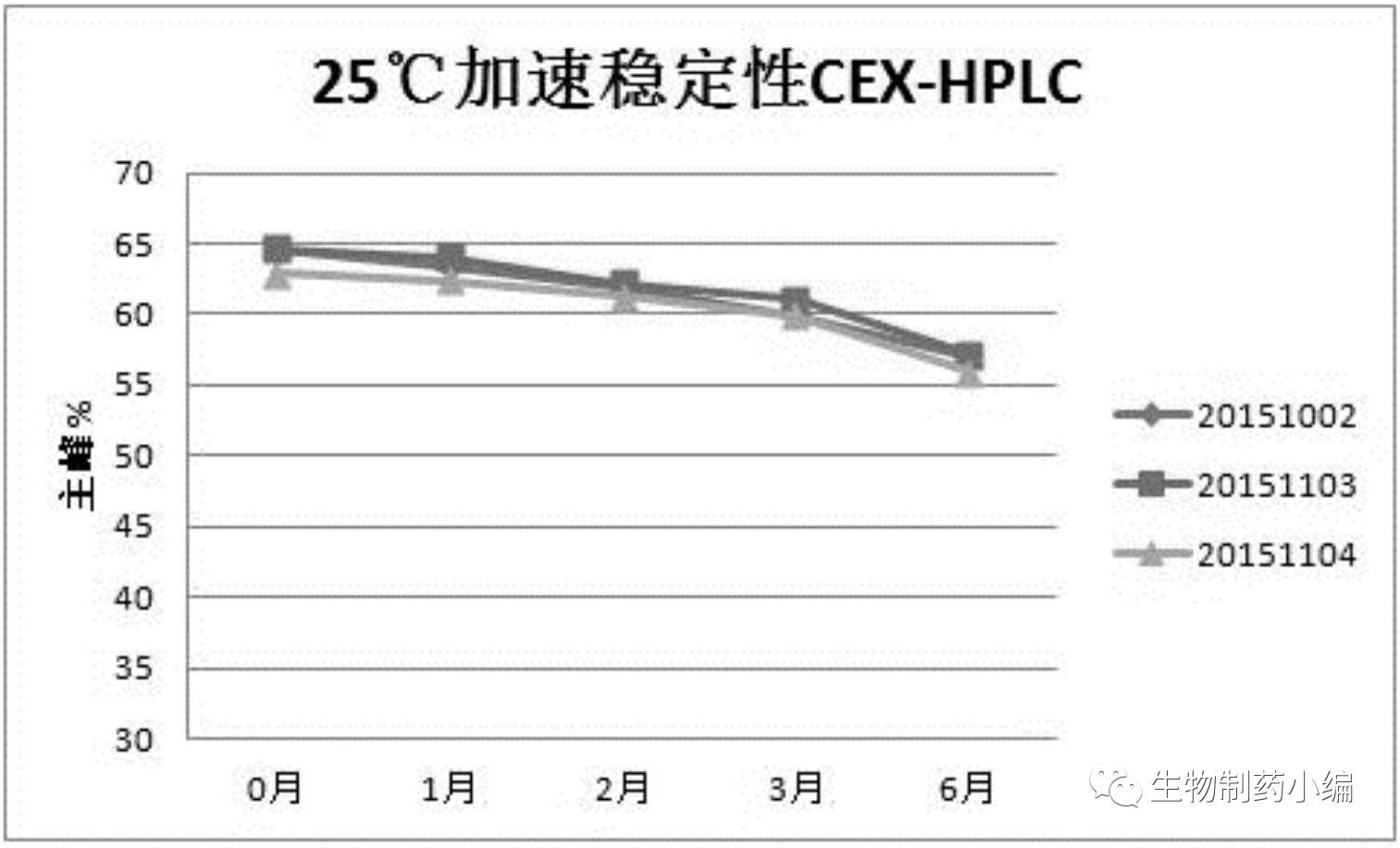
根据稳定性研究结果
,
CEX-HPLC
主峰纯度维持在
50%
以上,证明该制剂处方可以在
2-8
℃稳定保存至少
12
个月,在
25
±
2
℃可稳定保存至少
6
个月。IND申报一般需要6个月初步稳定性数据,由时间推算,该三批稳定性研究即为申报数据。
小编总结
PD-L1抗体药物CS1001的制剂开发采用单因素/正交试验方式,先后确定了缓冲液体系/pH值、辅料、表面活性剂,确定了最终的制剂处方。专利中实例可能并不完全,但从给出的实例基本可以判断制剂开发过程和最终的制剂处方。
参考资料
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注
生物制药小编
投稿信箱:[email protected]
小编团队现有15位成员:
Armstrong、医药局外人、Fairy、
Jone、东胜西牛、Alpharesearcher、MT、百草、Irene、北望、蛋白工人、At.Zhou、Julia、游方和尚、Grand
欢迎有共同兴趣的朋友加入




