很多时候生信文章水平上不去原因是,许多实验结果是为了分析而分析。
这种情况在
非肿瘤类
生信文章中尤其常见。
可能尝试过非肿瘤生信分析的同学都有类似的感觉:
非肿瘤生信,既不涉及免疫浸润,又没有生存数据,想放多点图却又要什么没什么,只能看看别人的文章有什么分析,沾上边的能搬都搬过来,看看能不能冲高分一点。
结果出来的就是一篇生搬硬套堆砌而成的文章,被拒稿也不足为奇。
还有一点就是,随着越来越多人意识到生信文章这块“短、平、快”的香饽饽存在,涌入进来的人们逐渐摸索出了成熟的写作模板,最常见的就是“干实验分析+湿实验验证”。这样的文章越多,水涨船高后,文章能上到的水平肯定越低。
今天要介绍的是一篇Cell的文章,来自全球最顶级的研究机构,斯坦福大学。同样是单细胞测序,同样是挖掘GEO数据库联合分析,在这篇文章里你完全感受不到任何干/湿实验间的生硬切换,每一张图都在展示着什么叫优雅。

文章标题:
The single-cell epigenomic and transcriptional landscape of immunity to influenza vaccination [1]
流感疫苗免疫的单细胞表观基因组和转录景观
D
OI
:
https://doi.org/10.1016/j.cell.2021.05.039
疫苗是现代医学中预防和对抗疾病的重要手段。然而,为什么同样的疫苗对某些人有效,对某些人却完全不起作用呢?2021年6月25日,斯坦福大学医学院 Bali Pulendran教授通讯在国际顶级期刊Cell在线发表题为“The single-cell epigenomic and transcriptional landscape of immunity to influenza vaccination”的研究文章。该研究利用EpiTOF、scATAC-seq、scRNA-seq多种单细胞测序技术,通过对表观基因组和转录景观的研究揭示了疫苗接种对人类先天免疫系统的刺激与重塑作用。

Prof. Bali Pulendran
(图片来源:Bali Pulendran's Profile |
Stanford Profiles)
Prof. Bali Pulendran是斯坦福医学院病理学、微生物学和免疫学教授。此前,他是亚特兰大埃默里大学埃默里疫苗中心的查尔斯霍华德坎德勒病理学和实验室医学教授,先天免疫计划和 NIH U19 系统疫苗学中心的主任。Prof. Bali Pulendran主要研究先天免疫系统调节适应性免疫的机制,并在设计针对全球大流行的新型疫苗时利用这些机制。其研究结果发表在《自然》、《科学》、《细胞》、《自然免疫学》和《实验医学杂志》等一线期刊上[2]。
想要更好地读懂这篇文章,我们必须先来复习一下造血干细胞的分化。
造血干细胞(Hematopoietic stem cells, HSCs)是一种具有“多潜能性”的干细胞,位于骨髓内,能分化为
造血祖细胞
(Hematopoietic progenitor cells)。造血干细胞能自我更新,而
造血祖细胞
的自我跟新能力有限。造血祖细胞进一步分化,分化为
【淋巴系祖细胞(
common lymphoid progenitor
,
C
LP
)】
和
【髓系祖细胞
(common myeloid progenitor
,
CMP)
】
。所有由淋巴系祖细胞分化而成的细胞构成
淋巴群系(
lymphoid lineage
)
,包括单核细胞、颗粒白细胞等。而髓系祖细胞分化而来的细胞构成
骨髓群系(
myeloid lineage
)
,包括自然杀手细胞、T细胞、B细胞等。
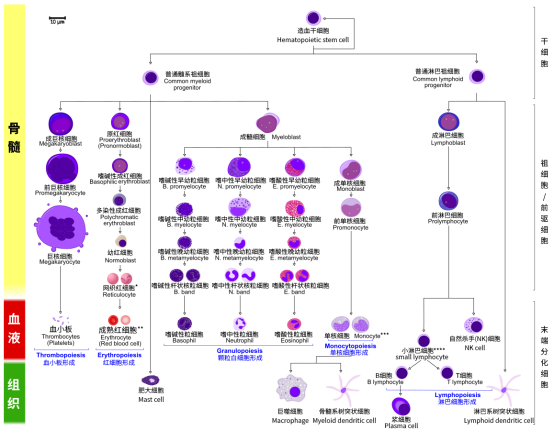
图片来源:维基百科[造血干细胞]
免疫系统中,T淋巴细胞免疫记忆和免疫枯竭现象的产生都跟表观基因组事件有关。研究表明, 单核细胞、自然杀手细胞上表观基因组的改变印刻出了先天免疫系统的免疫记忆。
当谈到疫苗接种,先天免疫系统中的表观遗传印记有着重要地位。研究表明,接种减活的卡介苗会诱导单核细胞发生表观遗传变化,并且这种变化会持续激活免疫系统。
但问题是,用卡介苗疫苗接种观察到的这种表观基因组印记,在多大程度上反映出这是一种存在于其他疫苗的普遍现象?而且,又有哪些关键因素决定着疫苗接种诱导出的表观基因组印记?
这一切尚不清楚。
虽然目前已有研究揭示出单核细胞群、树突状细胞群在转录水平和蛋白水平都具有异质性,但在单细胞水平上,我们对免疫应答中的人类表观基因组景观缺乏一个综合的生物学评估。
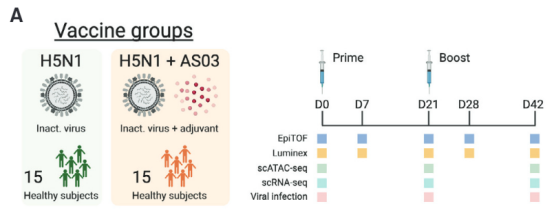
本研究中,作者使用了包括EpiTOF、scATAC-seq、scRNA-seq在内的多种单细胞技术,以研究人类对季节性和大流行性流感疫苗接种免疫的表观基因组和转录景观。
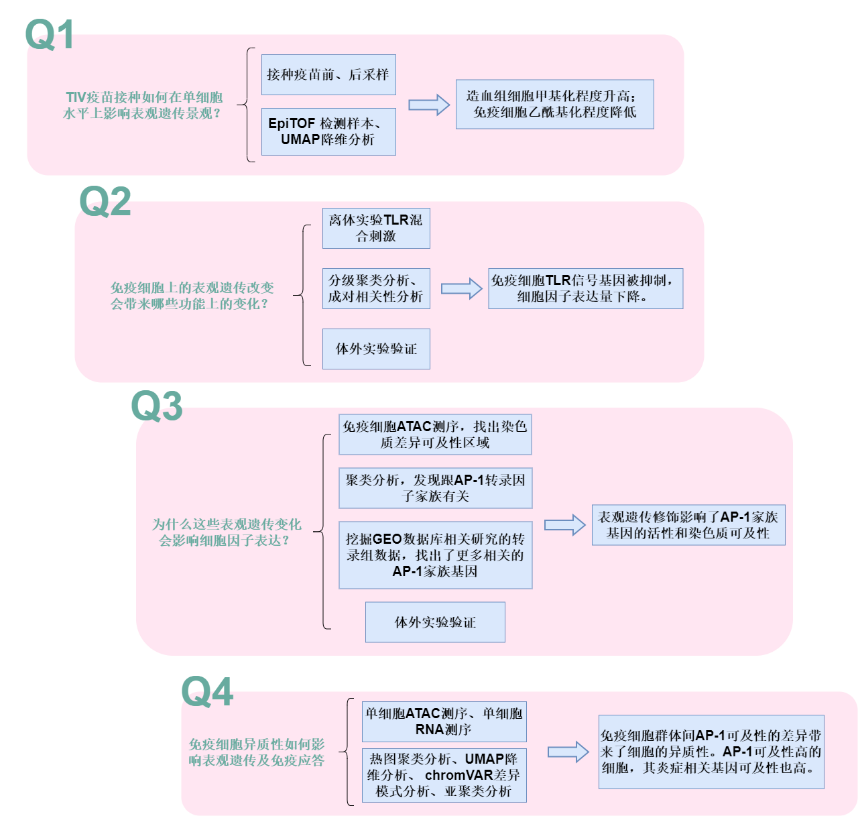
为了确定TIV(三价灭活季节性流感疫苗)如何在单细胞层面影响免疫系统的表观遗传景观,本实验一共招募了21名健康的志愿者,其中10名志愿者在接种前3天至接种1天后这段时间内每天施用新霉素、万古霉素、和甲硝唑。所有的志愿者在接种TIV前和接种TIV后均抽取样本进行EpiTOF质谱流式细胞测定(epigenetic landscape profiling using cytometry by timeof-flight)。
接种
TIV
后免疫细胞亚群的全局表观基因组重会经历重塑
实验结果表明,有些志愿者接种疫苗后骨髓群系细胞的比例有下降趋势,而有些服用抗生素的志愿者浆内体的细胞样树突状细胞(pDC)比例在注射疫苗当天至第二天有上升趋势。
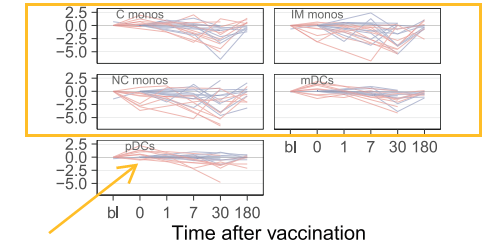
对数据进行UMAP分析(统一流形逼近与投影,Uniform Manifold Approximation and Projection)后发现,淋巴群系细胞与骨髓群系细胞大致上是分开的。
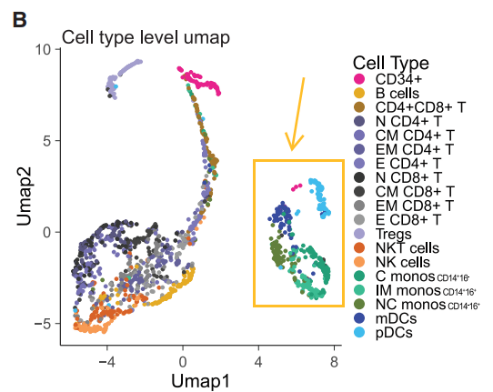
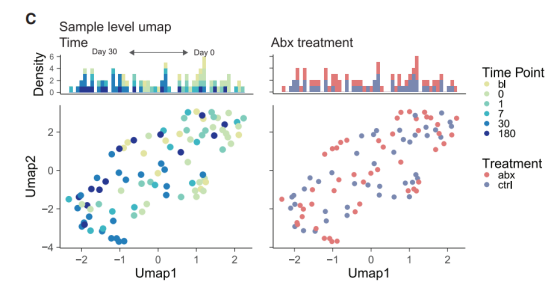
当我们进行样本级UMAP分析可以发现,接种疫苗前跟接种疫苗一个月后的样品倾向于分布在UMAP图的两侧,而是否施用抗生素则不会带来显著差别。
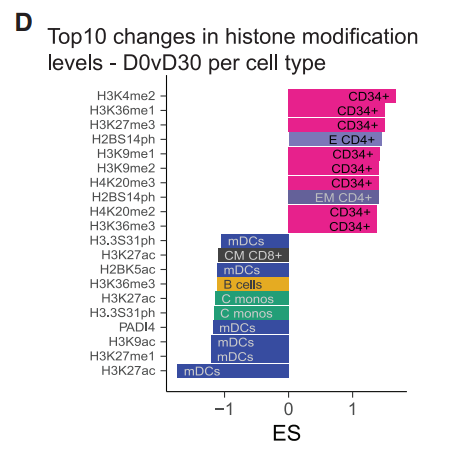
具体来说,刚接种疫苗与接种疫苗一个月后相比,造血祖细胞有着更多的组蛋白甲基化修饰,而骨髓群系细胞内的乙酰基化修饰则变少。
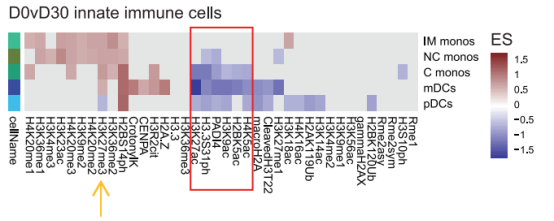
骨髓群系细胞会经历重塑,并且这种重塑的影响是长时间持续的
可以看到,单核细胞(monos)和骨髓树突状细胞(mDCs)中的H2BK5ac、H3K9ac、 H3K27ac、H4K5ac、PADI4全部被抑制。从时间轴纵向来分析,这些组蛋白修饰基因在注射疫苗后第30天表达量下降到最低值;注射疫苗六个月后逐渐回到正常水平。
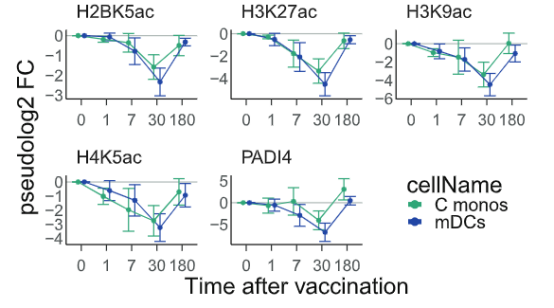
志愿者血液的转录组学分析显示,接种TIV疫苗后一周内,组蛋白乙酰基转移酶CREBBP/CBP和KAT6A的转录量同样被下调。而作为H3K25ac的拮抗基因,H3K27me3的转录水平和赖氨酸组蛋白甲基转移酶EZH2在单核细胞和骨髓树突状细胞内都同时得到了提升。

综合起来就是说,
接种了
TIV
疫苗后,人体内的骨髓群系细胞会进入一种被抑制的低乙酰化状态
。这种状态与PADI4水平的下降有强烈的正相关,
最终影响单核细胞(骨髓群系细胞)的发育与炎症反应
。
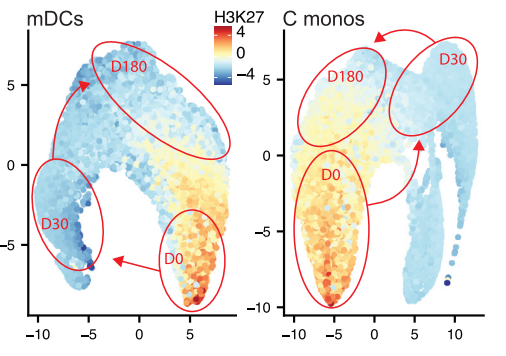
在得知了TIV疫苗接种会对骨髓群系细胞的影响后,作者聚焦到单细胞层面的骨髓群系细胞,分析TIV疫苗的接种到底带来了哪些表观遗传改变。通过使用H3K27ac、H2BK5ac、H4K5ac、H3K9ac 和 PADI4 标记对骨髓树突状细胞核和单核细胞进行亚聚类和基于UMAP的降维分析,作者构建了单细胞组蛋白修饰图谱。
可以看到,接种TIV疫苗后第0天和第1天的细胞聚集在二维空间的一侧,第30天的细胞占据另一侧,而第180天的细胞处于前两者之间,并没有完全回归基态。这说明,就算在接种疫苗6个月后,免疫细胞发生的表观遗传改变依然能被检测到。
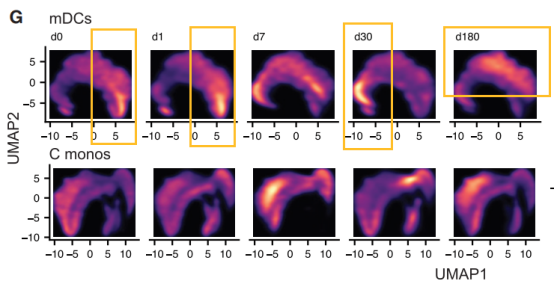
于是新的问题产生了:单核细胞和骨髓树突状细胞的周转周期(turnover)通常少于7天,那为什么上面提到的表观遗传改变在6个月后仍能被检测到?
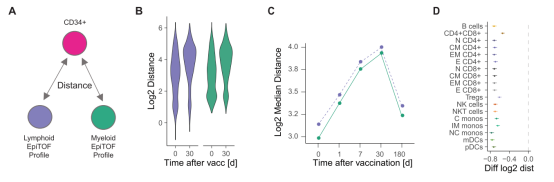
答案就在于造血干细胞和造血祖细胞。
CD34是人类造血干细胞的标志物,常用于分离造血干细胞和造血祖细胞 [3,4]。作者分析了CD34+细胞与其他已分化的免疫细胞的距离。可以看到,这些带有CD34标志物的细胞在接种疫苗后于其他分化细胞的差异随着时间在扩大。到达第180天时,这一差异基本回复到接种疫苗前的水平。这一切说明,
T
IV
疫苗的接种会造成造血干细胞表型的改变,从而给骨髓群系细胞带来持续的表观遗传改变
。
T
IV
疫苗接种会带给免疫细胞持续的功能改变
现在我们知道了TIV疫苗的接种会导致免疫细胞表观遗传上的改变,那这些表观遗传改变又会对免疫细胞造成什么功能上的变化呢?
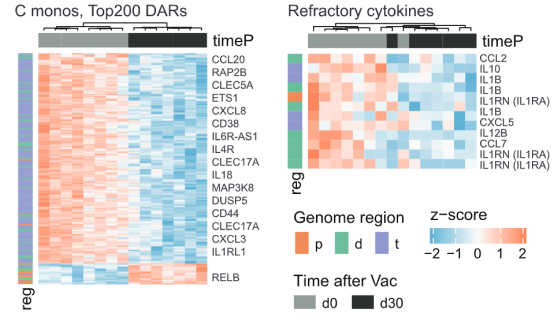
为了解答这一问题,作者收集了接种疫苗前和接种疫苗后志愿者的外周血单个核细胞(PBMC),施予两组混合的TLR激动剂。第一组TLR激动剂由脂多糖LPS、鞭毛蛋白和P3C组成,用于模拟细菌感染。第二组TLR激动剂由pI:C和R848组成,用于模拟病毒感染。这些外周血单个核细胞分别与两组TLR激动剂孵育24小时,然后测量细胞内62种细胞因子的表达量。
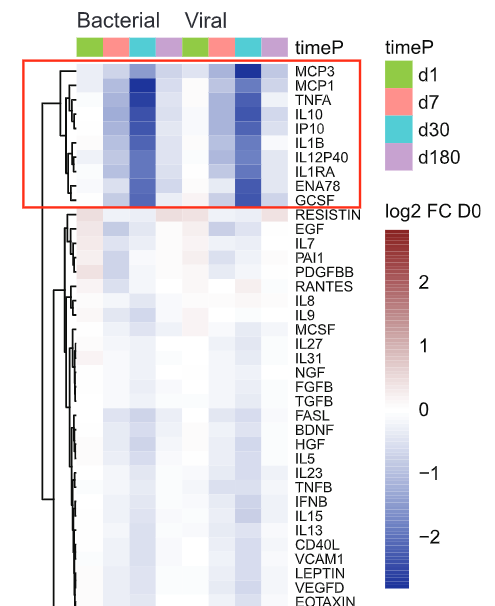
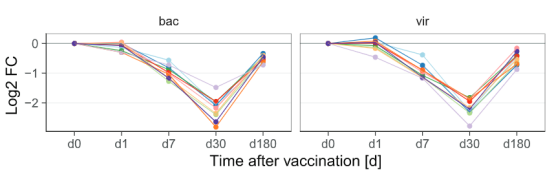
分级聚类结果表明,多种细胞因子的表达量在接种疫苗30天后显著下降,而且在第30天下降到最低水平,随后逐渐回归基态。
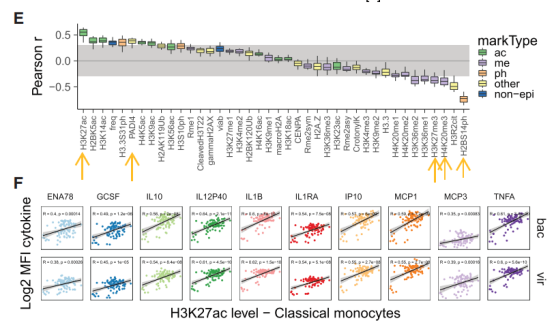
那这些细胞因子表达量的下降与前面提到的免疫细胞组蛋白修饰有什么关系呢?成对相关性分析表明,组蛋白乙酰基化标记与细胞因子的表达正相关,甲基化标记与细胞因子的表达负相关。由此说明,
接种
TIV
疫苗后,免疫细胞进入低乙酰基化状态,导致细胞因子表达量下降
。
为了验证这一观点,作者分别向外周血单个核细胞加入组蛋白乙酰基转移酶抑制剂A-485和PADI4抑制剂Cl
-
Amidine。结果表明LPS和R848带来的IL-1b和TNFa促进作用几乎被完全消除。
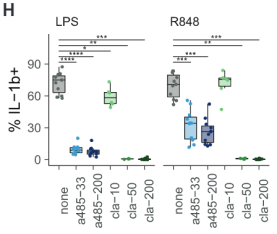
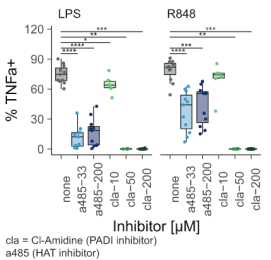

TIV
诱导
骨髓群系
细胞中
AP-1
靶向位点的染色质可及性降低
新的问题产生了,为什么免疫细胞进入了低乙酰基状态,会影响细胞因子的表达呢?或者说,为什么免疫细胞上的这些表观遗传修饰会影响细胞因子的表达呢?为了解答这一问题,作者用FACS技术(fluorescence-activated cell sorting,荧光激活细胞分选)纯化出接种疫苗前和接种疫苗后的免疫细胞,再对其进行ATAC测序(ATAC-Seq,染色质转座酶可及性测序分析)。
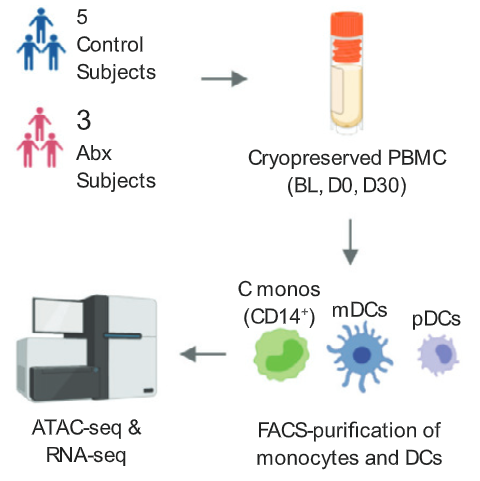
从结果可以看到,单核细胞上出现了超过一万个染色质可及性发生差异的区域,DAR(differentially accessible region,差异可及性区域),而骨髓树突状细胞上有大约4500个DAR。具体来说,单核细胞和骨髓树突状细胞染色质上很大一部分区域的可及性在接种疫苗30天后降低了。
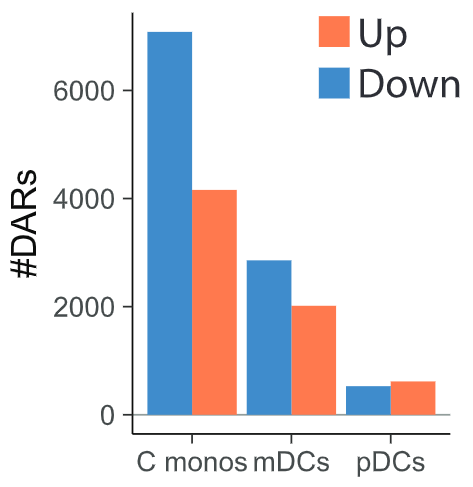
用热图聚类分析这些DAR,发现单核细胞上众多与免疫相关的基因其染色质可及性都发生了下降。这些基因包括一些细胞因子/趋化因子及其相应受体的基因、病原体识别受体基因、粘附分子基因等。更重要的是,前面提到的加入混合TLR激动剂后PBMC表达下降的10种细胞因子里,7种细胞因子基因的可及性在接种疫苗后都下降了。
对单核细胞所有包含DAR的基因进行聚类分析后发现,这些基因主要跟两个生物学主题相关。一是TLR和细胞因子信号通路,二是基因组重排。而对于TLR和细胞因子信号通路相关的基因来说,它们大部分基因的染色质可及性都在接种疫苗后下降了。
综合起来就是说,
在接种
TIV
疫苗后,众多
TLR
和细胞因子信号通路相关基因的可及性被抑制,因此影响了相应细胞因子的表达
。
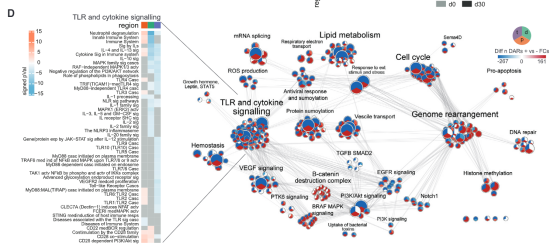
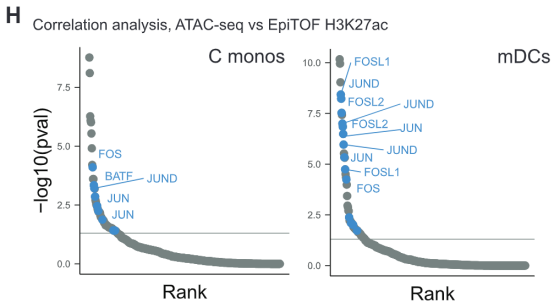
接下来要确定的是这些基因的调控模式。聚类分析结果显示,每种细胞中的DAR都富集了AP-1转录因子家族的众多成员。而再联通别的TIV研究中的转录组数据进行分析,确证了c-Jun、JUND、ATF3、FOS、FOSL2和FOSB这些AP-1转录因子家族成员的表达量在接种TIV疫苗后全部下降。
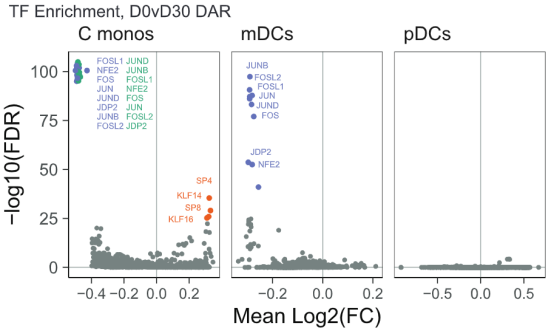
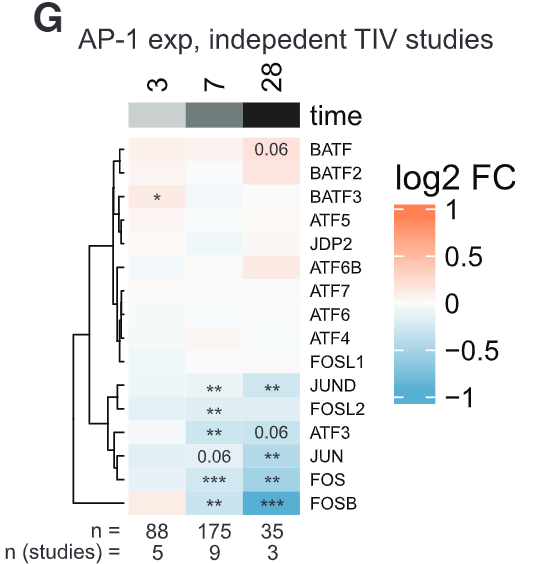
接着,对全基因组区域标准化后的可及性和之前提到的组蛋白标记进行关联性分析,结果显示c-Fos和c-Jun等众多AP-1家族成员在目标基因有着显著富集。这说明组蛋白乙酰化/PADI4降低与AP-1可及性降低之间可能存在因果关系。
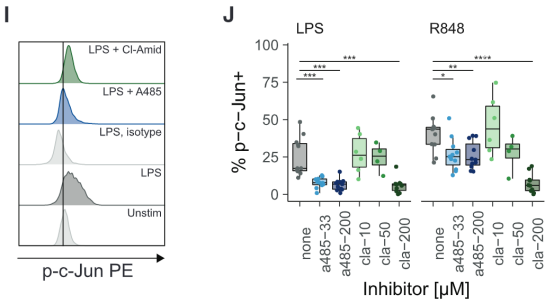
在体外实验中,PBMC细胞若提前加入A-485或Cl
-
Amidine,会导致细胞内的组蛋白乙酰基化水平下降,然后完全抑制LPS或R848带来的c-Jun激活效果。
所有数据串联起来说明,
T
IV
疫苗的接种会导致免疫细胞染色质可及性的下降。这些可及性下降的区域主要包括
T
LR
和细胞因子信号通路相关基因、以及
A
P-1
转录因子家族成员相关基因。同时,
T
IV
疫苗接种带来的免疫细胞低乙酰基化状态会进一步抑制
A
P-1
转录因子家族基因的活性。
A
P-1
转录因子家族基因的活性和表达量显著下降,最终导致
T
LR
刺激条件下众多细胞因子表达量的下降
。
TIV
接种下免疫细胞的异质性
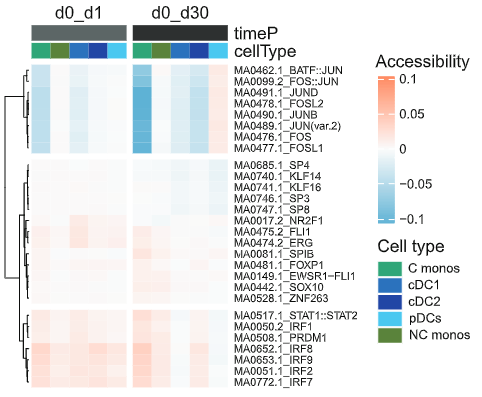
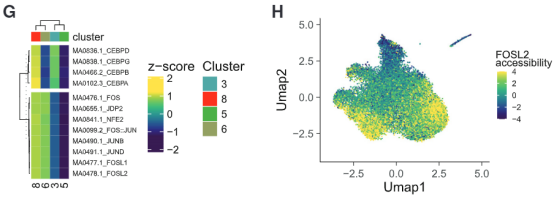
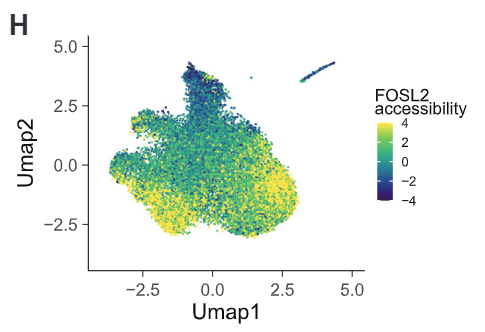
作者从已接种TIV疫苗的志愿者身上提取外周血单个核细胞,并进行scATAT-seq和scRNA-seq单细胞测序,构建单细胞水平的表观遗传景观和转录景观。利用R语言的chromVAR包分析可以看出,单核细胞和骨髓树突状细胞中AP-1家族基因的可及性在接种疫苗1天后开始下降,接种30天后下降非常显著。这说明TIV接种引发的表观遗传重塑是在疫苗应答的急性期刻印在细胞上的。
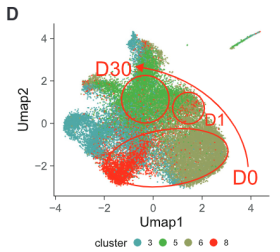
基于不同时间模式下单核细胞染色质可及性的亚聚类分析可以看出,单核细胞中大概可以分成4个群体。而单核细胞不同群体中的这一异质性正式由AP-1和CEBP的可及性造成的。有着高AP-1可及性的细胞组成Day 0群体;低AP-1可及性的细胞构成Day 30群体。
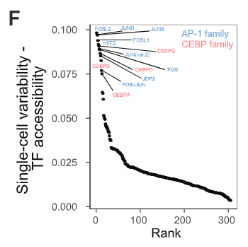
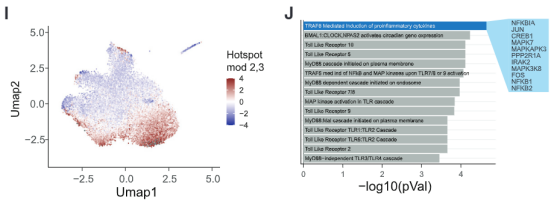
用热点(Hotspot)分析可以看出,我们观测到的异质性跟一组与促炎症因子和TLR通路相关的基因区域有关。AP-1可及性高的细胞,其编码炎症相关基因的区域的可及性也高。
AS03-
佐药的
H
5N1
流感疫苗诱导骨髓细胞
A
P-1
染色质可及性的下降
上面的结果告诉我们,接种TIV疫苗会导致AP-1位点的染色质可及性下降、H3K27ac水平下降、以及TLR刺激的不应性。这些结果出乎了作者的意料,因为别的文献曾报道减毒的卡介苗可以增强先天免疫。于是作者就在想,这些效果到底是TIV疫苗独有的呢,还是说是因为接种TIV疫苗时缺乏佐药呢?于是,作者用另一种流感疫苗进行测试。这种疫苗叫做H5N1流感疫苗,接种时需要配上AS03作为佐药(AS03是一种基于角鲨烯的佐药,含有 α-生育酚,可诱导强烈的先天性和适应性免疫反应)。
作者假设向灭活的流感疫苗加入佐药可以诱发增强的、持续性的先天免疫应答。于是作者向15名志愿者单独注射H5N1疫苗,15名志愿者注射H5N1+AS03,并在不同时间段分别采样。最后对采集到的细胞做scATAC-seq、scRNA-seq等分析。
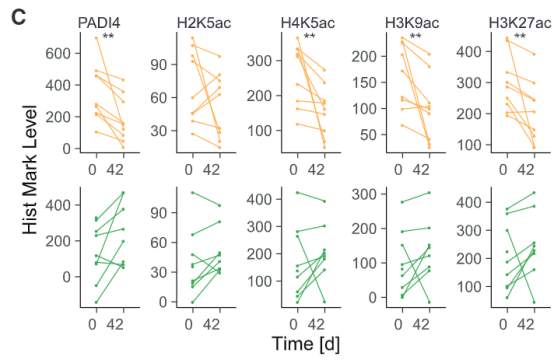
结果同样出乎作者意料,混合注入H5N1疫苗+AS03的志愿者的单核细胞中H3K27ac、H4K5ac、H3K9ac、PADI4同样被抑制(正如接种了TIV疫苗那样),而在单独接种H5N1的志愿者里却没有这一现象。同样的,混合接种H5N1+AS03的组里先天应答细胞因子和趋化因子的表达都被抑制了,单独接种H5N1的组却没有。
scATAC-seq单细胞测序的结果显示,AP-1转录因子家族的染色质可及性也发生了下降,但IRF和STAT家族的染色质可及性却有所增加。这说明,接种疫苗后免疫细胞的抗病毒反应可能有所增强。
综合所有的实验结果,本研究表明TIV疫苗和带有AS03佐药的H5N1疫苗能诱导血液中的骨髓群系细胞发生深刻而持久的全局性表观基因组变化,并且这些表观遗传变化还会对细胞功能带来影响。
具体来说,
接种
T
IV
疫苗后造血祖细胞会带有更多的甲基化修饰。其分化出来的免疫细胞会进入低乙酰基化状态,同时
D
API4
表达量会下降。此外,免疫细胞染色质上会出现大量的差异可及性区域
D
AR
。这些下调的
D
AR
有的分布在
T
LR
信号通路基因上,有的分布在
A
P-1
转录因子家族基因上。最后加上低乙酰基化状态对
A
P-1
活性的抑制,最终的结果是免疫细胞对
T
LR
刺激的应答程度下降
。这就是TIV疫苗接种所带来的免疫细胞表观基因组重塑。
文献来源
1. Wimmers, F.
et al.
(2021) The single-cell epigenomic and transcriptional landscape of immunity to influenza vaccination.
Cell
DOI: 10.1016/j.cell.2021.05.039
2. Bali Pulendran, PhD | Parker Institute for Cancer Immunotherapy. [Online]. Available: https://www.parkerici.org/person/bali-pulendran-phd/. [Accessed: 29-Jun-2021]
3. AbuSamra, D.B.
et al.
(2017) Not just a marker: CD34 on human hematopoietic stem/progenitor cells dominates vascular selectin binding along with CD44.
Blood Adv.
1, 2799–2816
4. Pei, X. (1999) Who is hematopoietic stem cell: CD34+ or CD34-?
Int J Hematol
70, 213–215
欢迎扫描加入我们的分学科新社群





