2020年12月4日,Nature Communications在线发表了来自中科院上海植物逆境中心(中科院分子植物科学卓越创新中心)的段成国、朱健康研究员团队和南方科技大学杜嘉木教授团队合作完成的题为“Coupling of H3K27me3 recognition with transcriptional repression through the BAH-PHD-CPL2 complex in Arabidopsis”的研究论文。该研究发现了一个新的组蛋白H3K27me3阅读器,并揭示了该阅读器抑制转录的一种新的分子机制:通过抑制Pol II末端磷酸化抑制转录的起始。组蛋白的翻译后修饰(Post-translational modification,PTM)在生物进程的各个方面都发挥着重要作用。其中, H3第27位赖氨酸的三甲基化修饰(H3K27me3)是一类重要的转录抑制性组蛋白PTM。传统观点认为,多梳抑制复合体2(Polycomb Repressive Complex 2,PRC2)负责催化并维持H3K27me3,而PRC1复合体负责识别H3K27me3并催化组蛋白H2Aub修饰,促进染色质凝集,抑制转录起始复合物的招募,从而抑制转录1。然而近些年的研究挑战了这一观点,认为除了PRC1复合物之外,生物体还有多种识别H3K27me3并调控靶位点沉默的机制2-6。作者通过质谱筛选在拟南芥中鉴定到一个由含有BAH结构域蛋白AIPP3,含有PHD结构域的同源蛋白AIPP2和PAIPP2,以及植物特异的RNA Pol II磷酸酶CPL2组成的蛋白复合体(BAH-PHD-CPL2复合体,BPC复合体)。通过酵母双杂,双分子荧光互补以及凝胶过滤层析实验,作者确认了该复合体组分之间的互作模式:PHD蛋白分别与BAH蛋白和CPL2相互作用形成复合体。表型分析表明,BPC复合体的突变体呈现不依赖于光周期的早花表型和严重的发育缺陷,表明该复合体对于植物的正常发育和开花是必须的。遗传学证据表明,BPC复合体主要通过抑制开花节点基因FT的表达调控开花(Fig. 1),在BPC突变体中,FT的表达呈现组成型上调。Fig. 1 BAH蛋白AIPP3,PHD蛋白AIPP2或PAIPP2以及Pol II磷酸酶CPL2形成复合体调控植物开花和发育。BAH结构域是一类与组蛋白识别有关的结构域。在本研究中,作者通过组蛋白修饰芯片、Pull-down以及ITC等实验证据发现AIPP3能够特异的识别结合H3K27me1/2/3修饰,对H3K27me3的结合活性最高。作者通过结构生物学的手段进一步解析了AIPP3-BAH结合H3K27me3的复合体结构,证明AIPP3-BAH是一个H3K27me3阅读器。与BAH类似,PHD结构域也是一个与组蛋白识别有关的结构域。在本研究中,作者通过ITC和结构模拟发现AIPP2和PAIPP2的PHD结构域特异性识别结合未修饰的H3K4(Fig. 2)。因此,AIPP3与AIPP2/PAIPP2互作形成一个识别H3K27me3/H3K4me0双修饰的组蛋白阅读器模块BAH-PHD。Fig. 2 AIPP3-BAH与PAIPP2-PHD结构域分别识别H3K27me3与未甲基化的H3K4。通过mRNA-seq分析,作者发现BPC复合体突变后主要造成大量基因表达的上调,显示该复合体是一个转录抑制复合体。与结构生物学的结论一致,从mRNA-seq中上调的差异基因以及ChIP实验,作者发现BAH-PHD分子模块可以靶向基因组上富含有H3K27me3-H3K4me0修饰的基因,并抑制mRNA的产生。有意思的是,当BPC复合体被破坏时,部分靶点在不丢失H3K27me3的情况下,呈现出表达激活的状态,暗示了BPC复合体作为H3K27me3维持途径的下游,抑制基因转录 (Fig. 3)。通过ChIP-seq和ChIP-qPCR分析,发现BPC复合物特异结合在一类H3K27me3/H3K4me0标记的基因上。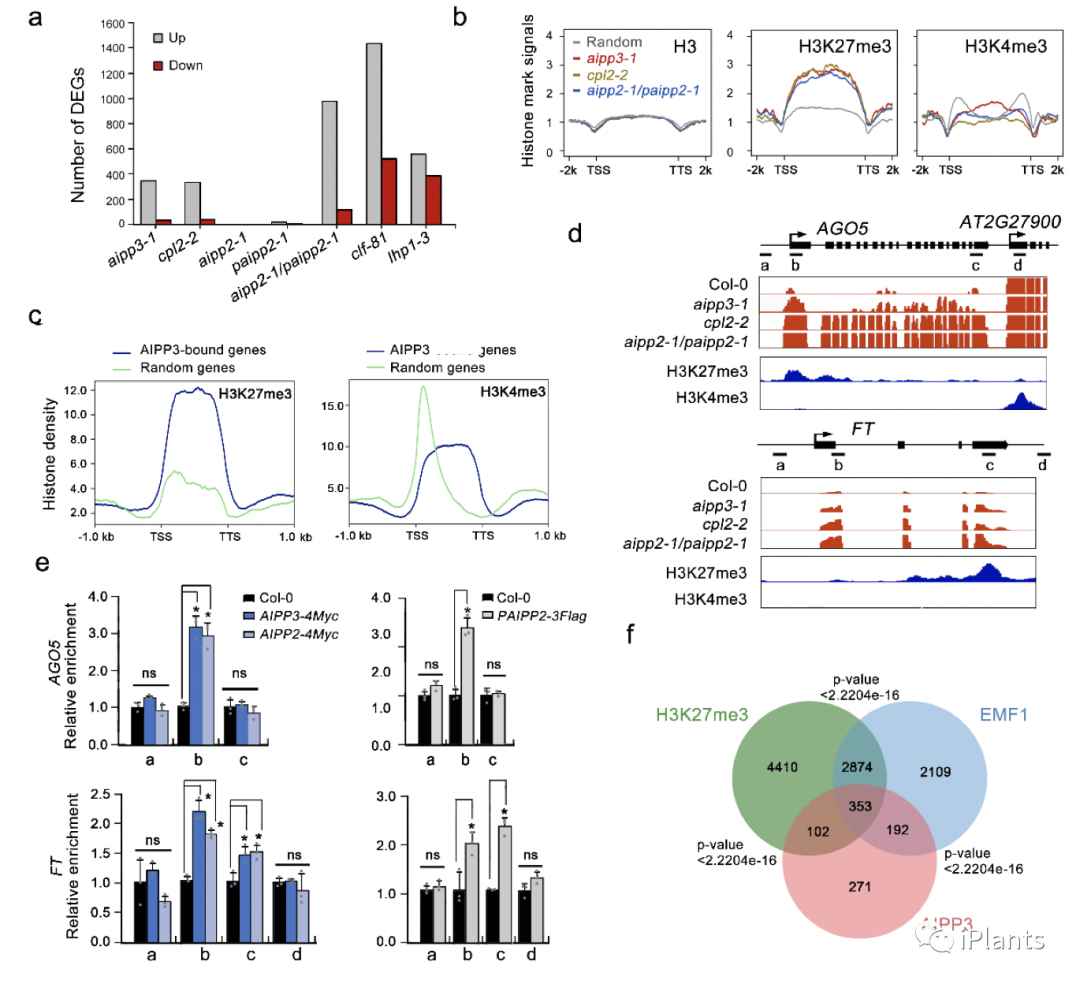
Fig. 3 BPC复合体是一个转录抑制复合物,特异结合H3K27me3/H3K4me0标记的基因。在BPC复合体中,含有一个已知的植物特异的Pol II磷酸酶CPL2,被报道可以去除Pol II最大亚基C末端结构域(CTD)五号位丝氨酸磷酸化(ser5P)。通过Pol II ChIP-qPCR已发表的Pol II NET-seq数据7,作者发现BPC复合体的靶基因转录起始位点富含末端未磷酸化的Pol II,但是Ser5P-Pol II和Ser2P-Pol II的水平几乎检测不到,说明BPC复合体不影响Pol II的招募,有可能影响了Pol II转录的起始。而在BPC复合体的突变体中,靶位点Ser5P-Pol II水平显著上调。我们发现BAH-PHD组蛋白阅读器模块可以招募CPL2到被H3K27me3/H3K4me0标记的靶基因,通过去磷酸化Ser5P-Pol II抑制转录。一旦BAH-PHD模块被破坏,CPL2无法在靶点富集(Fig. 4)。Fig. 4 BAH-PHD分子模块通过招募CPL2去磷酸化Pol II,抑制基因转录。这篇文章首次将H3K27me3的识别直接与Pol II CTD的磷酸化调控相偶联,表明植物体内存在独立于经典PRC2/PRC1-H2AKub1的非典型H3K27me3表观沉默机制(Fig. 5)。虽然CPL2是一类植物特有的磷酸酶,但是这种组蛋白修饰与Pol II PTM的协同机制,可能广泛存在于真核生物中。近些年已经有多个课题组报道了BAH-H3K27me3调控模式存在于植物,动物和真菌系统中。植物中,EBS和SHL通过其BAH结构域识别H3K27me3,并和植物特异的PRC1组分EMF1物理互作,同另一种H3K27me3阅读器蛋白LHP1一起,参与经典的PRC2-PRC1途径中4。有趣的是,在动物中,最近的一项研究发现BAHD1以及BAHCC1(BAHD2)蛋白同样含有识别H3K27me3的BAH结构域,但功能有所不同。BAHD1可以和PRC2物理互作,而BAHCC1与组蛋白去乙酰化组分形成复合体,同PRC1共同抑制H3K27me3位点的基因表达2,8。以上这些研究表明生物体通过H3K27me3调控转录沉默的机制远比之前所设想的复杂。Fig. 5 BAH-PHD-CPL2转录抑制复合体的工作模型。中国科学院上海植物逆境生物学研究中心的段成国研究员、朱健康研究员和南方科技大学的杜嘉木教授为该论文的共同通讯作者,博士研究生张以哲、袁建龙和博士后张玲瑞为该论文的共同第一作者。该研究得到了中科院先导B项目和国家自然科学基金项目等经费的资助。参考文献
1. Blackledge, N.P., Rose, N.R. & Klose, R.J. Targeting Polycomb systems to regulate gene expression: modifications to a complex story. Nat Rev Mol Cell Biol 16, 643-649 (2015).
2.Fan, H. et al. BAHCC1 binds H3K27me3 via a conserved BAH module to mediate gene silencing and oncogenesis. Nat Genet 52, 1384-1396 (2020).
3. Wiles, E.T. et al. Evolutionarily ancient BAH-PHD protein mediates Polycomb silencing. Proc Natl Acad Sci U S A 117, 11614-11623 (2020).
4. Li, Z., Fu, X., Wang, Y., Liu, R. & He, Y. Polycomb-mediated gene silencing by the BAH–EMF1 complex in plants. Nature Genetics 50, 1254-1261 (2018).
5. Yang, Z. et al. EBS is a bivalent histone reader that regulates floral phase transition in Arabidopsis. Nature Genetics 50, 1247-1253 (2018).
6.Zhao, D. et al. The BAH domain of BAHD1 is a histone H3K27me3 reader. Protein Cell 7, 222-6 (2016).
7. Zhu, J., Liu, M., Liu, X. & Dong, Z. RNA polymerase II activity revealed by GRO-seq and pNET-seq in Arabidopsis. Nat Plants 4, 1112-1123 (2018).
8.Xu, P. et al. FBXO11-Mediated Proteolysis of BAHD1 Relieves PRC2-dependent Transcriptional Repression in Erythropoiesis. Blood (2020).
iPlants专注于全球植物科学前沿研究报道,已有二十万多学者关注。现已组建了22个500人/群的植物科学研究的研究生/教授的实名认证交流群,其都来自全球各大高校和研究所的同学和老师。欢迎从事植物科学相关研究的同学和老师加入我们,一起讨论学术和梦想。温馨提示:加iPlants助手微信号(ID: iplants-1)或长按下面二维码时进群时,请备注一下学校+专业+学生/老师,以便我们能拉你进相应的交流群,否则不予通过)















