

如果您喜欢药智网推送的这篇文章
欢迎点赞和转发哦~


如果您喜欢药智网推送的这篇文章
欢迎点赞和转发哦~


如果您喜欢药智网推送的这篇文章
欢迎点赞和转发哦~
| 固体制剂处方工艺研究及试验设计(DoE)研讨会 |
| 参会企业名单 |
| 编号 | 单位名称 | 职务 |
| 1 | 保诺科技(北京) | 总监 |
| 2 | 保诺科技(北京) | 研究员 |
| 3 | 保诺科技(北京) | 研究员 |
| 4 | 北京安森博 | 业务经理 |
| 5 | 北京安森博 | 业务经理 |
| 6 | 北京德立福瑞 | 项目负责人 |
| 7 | 北京海泰天正 | 制剂部经理 |
| 8 | 北京海泰天正 | 合成部经理 |
| 9 | 北京海泰天正 | 分析部经理 |
| 10 | 北京韩美药品 | 主管 |
| 11 | 北京科林臻和 | 董事长 |
| 12 | 北京罗诺强施 | 首席运营官 |
| 13 | 北京罗诺强施 | 制剂研究员 |
| 14 | 北京罗诺强施 | 总经理 |
| 15 | 北京麦康科技 | 经理 |
| 16 | 北京麦康科技 | 经理 |
| 17 | 北京麦康科技 | 经理 |
| 18 | 北京茗泽中和药物研究 | 总经理 |
| 19 | 北京茗泽中和药物研究 | 分析组长 |
| 20 | 北京茗泽中和药物研究 | 制剂组长 |
| 21 | 北京茗泽中和药物研究 | 制剂组长 |
| 22 | 北京茗泽中和药物研究 | 制剂组长 |
| 23 | 北京茗泽中和药物研究 | 制剂组长 |
| 24 | 北京茗泽中和药物研究 | 合成组长 |
| 25 | 北京诺康达 | 项目经理 |
| 26 | 北京诺康达 | 制剂组长 |
| 27 | 北京诺康达 | 项目经理 |
| 28 | 北京培优创新 | 科学总监 |
| 29 | 北京赛思源生物 | 制剂经理 |
| 30 | 北京首儿药厂 | 质量保证部 |
| 31 | 北京首儿药厂 | 制造部 |
| 32 | 北京首儿药厂 | 质量保证部 |
| 33 | 北京斯利安药业 | 研究员 |
| 34 | 北京泰德制药 | 项目经理 |
| 35 | 北京万辉双鹤药业 | 研究员 |
| 36 | 北京万辉双鹤药业 | 研究员 |
| 37 | 北京万辉双鹤药业 | 研究员 |
| 38 | 北京沃邦 | 研究员 |
| 39 | 北京沃邦 | 研究员 |
| 40 | 北京沃邦 | 主管 |
| 41 | 北京协和制药二厂 | 待定 |
| 42 | 北京阳光诺和 | 制剂经理 |
| 43 | 北京阳光诺和 | 制剂经理 |
| 44 | 北京阳光诺和 | 分析经理 |
| 45 | 北京药检所 | 所长助理 |
| 46 | 北京亦度正康 | 临床经理 |
| 47 | 北京元延 | 主管 |
| 48 | 北京中汇康鸿 | 研发总监 |
| 49 | 北京中汇康鸿 | 制剂主管 |
| 50 | 北京中汇康鸿 | 制剂主管 |
| 51 | 博诺康源(北京) | 职员 |
| 52 | 博诺康源(北京) | 部门经理 |
| 53 | 博诺康源(北京) | 部门经理 |
| 54 | 辰欣 | 国际研发部经理 |
| 55 | 辰欣 | 工艺技术部部长 |
| 56 | 辰欣 | 项目负责人 |
| 57 | 成都苑东生物 | 课题组长 |
| 58 | 成都苑东生物 | 课题组长 |
| 59 | 成都苑东生物 | 经理 |
| 60 | 大道隆达(北京) | 主任 |
| 61 | 大道隆达(北京) | 项目管理 |
| 62 | 大道隆达(北京) | 副总经理 |
| 63 | 大连美罗药业 | 高级研究员 |
| 64 | 佛山市隆信 | 制剂研发总监 |
| 65 | 富垚机电 | 制剂 |
| 66 | 富垚机电 | 总经理 |
| 67 | 谷川(湖南) | 项目经理 |
| 68 | 谷川(湖南) | 项目经理 |
| 69 | 谷川(湖南) | 项目经理 |
| 70 | 广州艾格生物科技 | 制剂组长 |
| 71 | 广州惠沣德 | 经理 |
| 72 | 澳大利亚minitab | 开发经理 |
| 73 | 澳大利亚minitab | 业务经理 |
| 74 | 广州科的信医药技术 | 经理 |
| 75 | 广州科锐特 | 研究员 |
| 76 | 广州科锐特 | 工程师 |
| 77 | 广州科锐特 | 工程师 |
| 78 | 海口药检所 | 检验专技 |
| 79 | 海思科医药 | 副经理 |
| 80 | 杭州和泽 | 制剂经理 |
| 81 | 杭州和泽 | 研究员 |
| 82 | 杭州和泽 | 研发总监 |
| 83 | 河北凯威制药 | 副经理 |
| 84 | 河北凯威制药 | 经理 |
| 85 | 河北凯威制药 | 厂长 |
| 86 | 河北科技大学 | 教授 |
| 87 | 河北亚诺生物 | 研究员 |
| 88 | 河北亚诺生物 | 研究员 |
| 89 | 河北亚诺生物 | 研究员 |
| 90 | 湖北恒安芙林 | 研发负责人 |
| 91 | 湖北恒安芙林 | 主任 |
| 92 | 湖北恒安芙林 | 工艺研究员 |
| 93 | 湖北生物医药 | 项目经理 |
| 94 | 湖北生物医药 | 研究员 |
| 95 | 湖北生物医药 | 制剂研究员 |
| 96 | 华润赛科药业 | 制剂 |
| 97 | 华润赛科药业 | 制剂 |
| 98 | 华润赛科药业 | 质量 |
| 99 | 华润双鹤 | 经理级 |
| 100 | 华润双鹤 | 工艺管理专员 |
| 101 | 华润双鹤 | 工艺经理 |
| 102 | 华润双鹤 | 研发人员 |
| 103 | 华润双鹤 | 研发人员 |
| 104 | 华润双鹤 | 研发人员 |
| 105 | 华润紫竹药业 | 主管 |
| 106 | 华润紫竹药业 | 主管 |
| 107 | 华润紫竹药业 | 主管 |
| 108 | 惠氏制药 | TS Engineer |
| 109 | 惠氏制药 | 技术服务工程师 |
| 110 | 惠氏制药 | 技术服务工程师 |
| 111 | 嘉实(湖南) | 总监 |
| 112 | 嘉实(湖南) | 高级项目经理 |
| 113 | 嘉实(湖南) | 制剂研究员 |
| 114 | SAS (中国) | 讲师 |
| 115 | SAS (中国) | 讲师 |
| 116 | 江苏恩华 | 研发员 |
| 117 | 江苏恩华 | 主任助理 |
| 118 | 江苏恩华 | 研发员 |
| 119 | 江苏恩华 | 首席科学家 |
| 120 | 江西杏林白马药业 | 研发人员 |
| 121 | 江西杏林白马药业 | 研发人员 |
| 122 | 江西杏林白马药业 | 研发人员 |
| 123 | 京新药业 | 待定 |
| 124 | 京新药业 | 待定 |
| 125 | 京新药业 | 待定 |
| 126 | 科文斯医药 | 科学总监 |
| 127 | 昆明积大制药 | 制剂研究员 |
| 128 | 丽珠集团丽珠医药 | 主管 |
| 129 | 丽珠集团丽珠制药厂 | 技术主管 |
| 130 | 丽珠集团丽珠制药厂 | 高级工程师 |
| 131 | 丽珠集团丽珠制药厂 | 技术主管 |
| 132 | 丽珠医药集团 | 制剂研究员 |
| 133 | 丽珠医药集团 | 分析员 |
| 134 | 丽珠医药集团 | 制剂部长 |
| 135 | 丽珠医药集团 | 助理研究员 |
| 136 | 丽珠医药集团 | 研究员 |
| 137 | 鲁南贝特制药 | 实验 |
| 138 | 鲁南贝特制药 | 实验 |
| 139 | 鲁南贝特制药 | 实验 |
| 140 | 青岛天马皇子贸易 | 董事 |
| 141 | 山东京卫制药 | 技术员 |
| 142 | 山东京卫制药 | 技术员 |
| 143 | 山东京卫制药 | 技术员 |
| 144 | 上海安必生制药技术 | 部长 |
| 145 | 上海安必生制药技术 | 制剂科学家 |
| 146 | 上海安必生制药技术 | 制剂研究员 |
| 147 | 上海复旦张江生物 | 技术支持工程师 |
| 148 | 上海复旦张江生物 | 技术支持工程师 |
| 149 | 上海复旦张江生物 | 技术支持工程师 |
| 150 | 上海复旦张江生物 | 工艺工程师 |
| 151 | 上海华拓发展 | 制剂部经理 |
| 152 | 上海现代哈森 | 主任 |
| 153 | 上海雅兴生物科技 | 制剂主管 |
| 154 | 上海药明康德新药开发 | 副主任 |
| 155 | 上海药明康德新药开发 | Group Leader |
| 156 | 深圳市信宜特科技 | 副总监 |
| 157 | 沈阳药科大学 | 教授 |
| 158 | 石家庄杏林锐步 | 项目经理 |
| 159 | 石家庄以岭 | 副院长 |
| 160 | 石家庄以岭 | 研发主管 |
| 161 | 石家庄以岭 | 制剂主管 |
| 162 | 苏州晶云药物研究 | 制剂研究员 |
| 163 | 苏州晶云药物研究 | 高级研究员 |
| 164 | 苏州晶云药物研究 | CEO |
| 165 | 天津红日 | 部长 |
| 166 | 天津市医药集团 | 总经理助理 |
| 167 | 天津市医药集团 | 主任助理 |
| 168 | 天津市医药集团 | 主任助理 |
| 169 | 天津太平洋制药 | 副总经理 |
| 170 | 天津药物研究院 | 制剂研发 |
| 171 | 天士力医药集团 | 制剂工程师 |
| 172 | 天士力医药集团 | PAT技术经理 |
| 173 | 天士力医药集团 | 产品工程师 |
| 174 | 天士力医药集团 | 提取研究员 |
| 175 | 天士力医药集团 | 提取研究员 |
| 176 | 天士力医药集团 | 制造技术经理 |
| 177 | 天士力医药集团 | 制剂工程师 |
| 178 | 天士力医药集团 | 制剂研究经理 |
| 179 | 通化东宝 | 部长 |
| 180 | 通化东宝 | 分析组长 |
| 181 | 通化东宝 | 待定 |
| 182 | 无限极(营口) | 技术工程师 |
| 183 | 西藏晨泰 | 经理 |
| 184 | 香港澳美制药 | Senior Scientist |
| 185 | 香港澳美制药 | Research Scientist |
| 186 | 香港澳美制药 | Research Scientist |
| 187 | 亚什兰(中国)投资 | 技术支持 |
| 188 | 亚什兰中国投资 | 技术支持 |
| 189 | 亚什兰中国投资 | 工程师 |
| 190 | 扬子江药业集团 | 课题组长 |
| 191 | 扬子江药业集团 | 所长 |
| 192 | 扬子江药业集团 | 制剂项目经理 |
| 193 | 药渡 | 经理 |
| 194 | 药渡 | 经理 |
| 195 | 誉衡药业 | 副总经理 |
| 196 | 远大医药(中国) | 制剂总监 |
| 197 | 远大医药(中国) | 制剂主管(分公司一) |
| 198 | 远大医药(中国) | 制剂主管(分公司一) |
| 199 | 远大医药(中国) | 制剂主管(分公司一) |
| 200 | 远大医药(中国) | 制剂主管(分公司二) |
| 201 | 远大医药(中国) | 制剂主管(分公司二) |
| 202 | 远大医药(中国) | 制剂主管(分公司二) |
| 203 | 远大医药(中国) | 制剂主管(分公司三) |
| 204 | 远大医药(中国) | 制剂主管(分公司三) |
| 205 | 远大医药(中国) | 制剂主管(分公司三) |
| 206 | 远大医药(中国) | 制剂主管(分公司三) |
| 207 | 浙江京新 | 参会人待定 |
| 208 | 中国医学科学院 | 技术员 |
| 209 | 中国医学科学院 | 技术员 |
| 210 | 中国医学科学院 | 学生 |
| 211 | 中国医学科学院 | 王老师 |
| 212 | 中国医学科学院 | 新药研发 |
| 213 | 黄冈动物药品厂 | 部门经理 |
| 214 | 重庆科技学院 | 研究员 |
| 215 | 重庆科技学院 | 研究员 |
| 216 | 重庆科技学院 | 戴老师 |
| 217 | 重庆科瑞制药(集团) | 制剂研究员 |
| 218 | 持续报名中。。。 |
|

固体制剂处方工艺研究及
试验设计(DoE)研讨大会
时间:2017年11月17-19日(三天)
地点:北京锦江富园大酒店(五星)
邀请辞
本次研讨班以处方工艺研究为中心,并由魏世峰博士、邱怡虹博士、崔福德教授、陈敏华博士、陈洪博士、毕吕存博士等10多位专家老师分别从试验设计(DoE)、晶型研究、反向工程、难溶性药物研究、专利研究、质量研究及BE研究等10个方面进行系统深入的培训。其中DoE将是本次培训的重中之重,本部分授课时间为一天半。
目前世界主要医药发达国家均要求将QbD理念融入药品研发环节,而DoE正是解决这一问题的有效、关键工具,是处方工艺研究必不可少的一环,唯有采用DoE才能更加科学、准确的确定CMA、CPP等关键参数。目前我国药品研发技术整体不够发达,除部分走向欧美的制药企业对DoE运用比较娴熟外,其他国内大多数企业均不擅长。很多制剂人员在进行处方工艺研究时仍只采用最古老的单因素试验法和纯经验式研发模式,处方筛选存在跳跃式、过于经验式的研究模式,致使研究不够充分和科学。最终研究结果存在一定的不确定性,在生产放大以及上市后存在重大隐患。因此,应广大制剂同仁要求我单位特以科学、高效的教学模式举办“固体制剂处方工艺研究及试验设计(DoE)”研讨大会。
---刁刁

国际制药项目管理协会(IPPM)
药研
天津凯博思科技有限公司
蒲公英
Minitab HK Ltd
SAS(中国)JMP事业部
北京茗泽中和药物研究有限公司
北京科林臻和医药科技有限公司
富垚机电科技发展(上海)有限公司
科文斯医药研发(上海)有限公司
北京罗诺强施医药技术研发中心有限公司
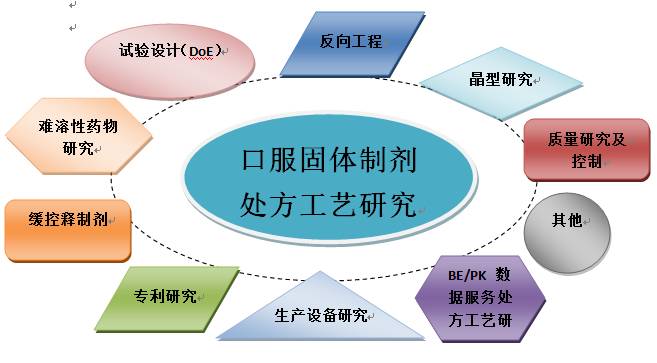
本次培训以固体制剂处方工艺研究为中心,围绕该中心依次从试验设计(DoE)、难溶性药物研究、反向工程、多晶型研究、专利研究、生产设备研究、参比制剂BE/PK数据在处方工艺开发中的应用、处方工艺开发中的质量研究和控制等诸多方面展开培训,尤其是试验设计(DoE)主题,我们不仅邀请国际知名药剂专家邱怡虹博士担任主讲,还要请了国际顶级DoE软件商Minitab和JMP的高级工程师来华授课,其主旨为多角度、全方位提升制剂研究人员研发水平。
本次培训共3天,培训结构如下图所示:
蒲公英
药研 晶云药物
新浪医药 药渡网 药智网
巍信 新药汇 培优联盟 健点子ihealth
药物一致性评价 药江湖 健识局 药时代
在一项针对约50名高级制剂研发人员(其中多为国内外知名制剂专家、FDA OGD前审评官、国内知名企业制剂总监、主任等)参加的调查发现,DoE在处方工艺研究中发挥着极其重要的作用,以下是调查问卷中的三个问题及调查结果:
1、您认为试验设计(DoE)在处方工艺研究中是否有必要?
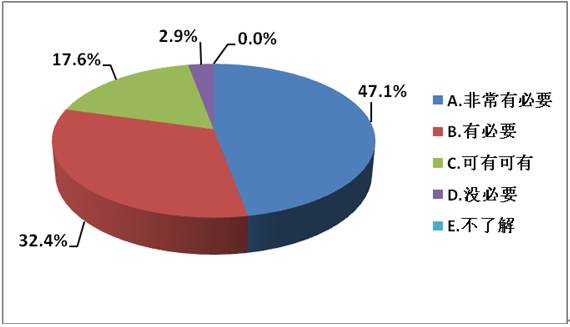
分析: DoE在制剂研发领域是极其重要的,从调查问卷中可以知道, “非常有必要”和 “有必要”总计约为80%,而认为“可有可无”和“没必要”总计只有20.5%。
2、您工作中是否使用此类软件?
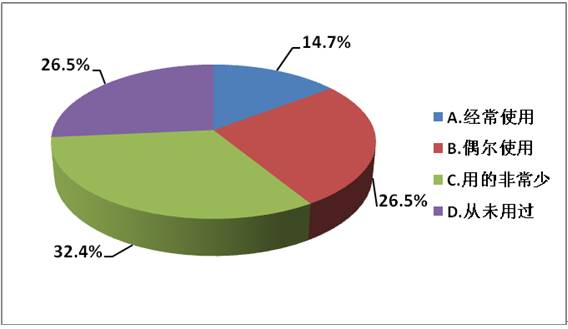
分析:国内已有部分企业可以正常使用DoE,但约58.9%的专业研发人员并未有效使用DoE,而“经常使用”和“偶尔使用”的人员多来自制剂海归人士、国内一流制药企业等。
3、如您使用过,您认为以下哪款最好用?
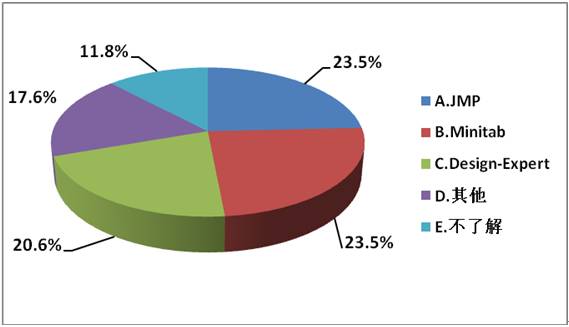
分析:作为国际一流的DoE软件品牌,JMP、Minitab和Design-Expert 3家约占有近70%的市场,且三者几乎不分秋色。因此,我们邀请最受欢迎的JMP和Minitab厂家高级工程师前来授课(Minitab更是从澳大利亚总部派遣一流的工程师来华授课),从软件开发者的角度为我们进行深度剖析软件的功能及其使用。由于在国内并未发现Design-Expert有分支机构,因此,此次培训暂未邀请该厂家。
制药企业和研发机构从事药品研发、制剂研发、质量研究、QA、QC、专利研究、立项、注册申报人员和法规人员;大专院校、科研院所的老师和学生;药监体系审评/检查人员等。
博士、资深科学家、原美国强生主任科学家、诺华制药资深院士,现为北京罗诺强施联合创始人、总经理
魏世峰博士曾先后于美国罗氏制药公司任资深科学家、美国强生公司任主任科学家、诺华制药公司任资深院士、美国尼克美公司任资深研发总监、美国瑞复健制药公司任研发副总裁、苏州豫源生物医药任总经理。曾任美中药物开发协会(SAPA)1996-1997年会长。具有二十多年在美国跨国制药公司和药物技术公司研发药物制剂创新产品和经营管理的丰富经验。
魏世峰博士是公认的美国制药工业界专家。参与了美国FDA制定的行业标准,例如缓控释制剂药品生产变更指南SUPAC-MR。做为世界卫生组织(WHO)的制药工业顾问,给东盟国家的药监局官员培训生产工艺验证。SAPA在20多年来为科技部、北京、上海科委、以及各地方政府举办的各种重要生物医药活动中提供重要支持。魏世峰博士也曾是科技部、北京市科委、上海市科委海外新药研发顾问委员会委员。魏世峰获得北京大学药学院(原北京医科大学药学专业)学士,美国明尼苏达大学药物制剂学博士。魏世峰博士领导公司技术团队开发了药物制剂十个产业化技术平台,并申报了15个专利包括国际专利。公司的产品线包括了创新制剂产品和高技术壁垒仿制药,进入中国和国际市场。案例包括以专利技术开发一个治疗心血管疾病的缓释制剂产品。协助合作公司在原研药专利没有过期时提前申报了美国的Paragraph IV ANDA,并通过了美国FDA的PAI-批准前核查。领导开发出多个重大原创药产品。其中数个重大产品成为相关治疗领域的金指标。
博士、艾伯维制药资深高级研究员(资深总监)
1992 年获美国爱荷华大学(Iowa)药剂学博士学位,进入雅培制药,邱博士拥有制剂产品开发全过程的研发经验和技术技能,包括处方前物理药剂研究、生物药剂、药动、药物传递技术、制剂处方工艺设计、开发、放大、优化及验证, 解决产品生产中的质量和工艺问题,产品的生命周期管理,尤其是美欧产品 CMC 注册申报法规,质量及管理规范,产品商机的技术和法规评估,知识产权及其战略和开发。拥有30多项新制剂和药物传递技术的授权专利和专利申请。
邱博士发表过论文和章节共60余篇,2014年与FDA合作发表的有关复杂缓释制剂体内外相关性的论文被评为最具原创和最重要的科学发现之一。其作为第一主编的《Developing Oral Dosage Forms: Pharmaceutical Theory and Practice.》,Elsevier美国Academic Press于2009年出版,2016年新版发行,被众多工业界、大学研究生和FDA等药品监管机构人士视为权威参考。中国化工出版社于2013年发行中文版本。
美国药典专家委员会委员,长江学者计划特聘海外评委,是许多国际专业杂志审委。
沈阳药科大学教授、博士、博士生导师,人民卫生出版社第五、六、七版《药剂学》主编
1969年毕业于沈阳药科大学,留校任教,于1996年在日本岐阜药科大学取得药学博士学位。1996年晋升为《药剂学》教授,博士生导师,2008年被评为国家教学名师,2011年退休。退休前为沈阳药科大学-国家重点学科《药剂学》的学科带头人,国家精品课程《药剂学》课程的课程负责人,国家级《药剂学》教学团队负责人以及省级学科、课程、团队负责人,创办亚洲药物制剂科学杂志(AJPS),并任第一任主编(2006-2011)。主编国家规划教材《药剂学》《药剂学实验》等9部,主译1部,参编教材和参考书等6部。荣获辽宁省教学成果一等奖3项,国家教学成果二等奖1项。荣获全国高等医药优秀教材二等奖1个。
主要研究方向是药物制剂新技术与新剂型的研究。几年来进行了“难溶性药物球晶造粒技术的研究”, “胰岛素口服纳米粒的研究”,“难溶性药物纳米尺寸对纳米混悬剂稳定性的影响”等国家自然基金项目,国家攻关项目等国家级项目9项。申报中国发明专利21项,其中授权专利15项,获得新药证书3项,临床批件5项,发表研究论文200多篇,SCI收载论文80多篇,国内外邀请讲学40余次。培养博士43人,培养硕士44人,其中2名博士先后荣获辽宁省优秀博士毕业论文,其中1名为国家优秀博士论文提名奖。连续三年(2014-2016)在Elservier SCI高被引论文榜上有名。
主要社会学术兼职有:中国颗粒学会常务理事,中国颗粒学会-生物颗粒专委会主任委员。国际药剂学杂志(IJP)编委,亚洲药物制剂科学杂志的名誉主编,先后组织国际会议3次,国内会议3次。目前作为企业的高级制剂技术顾问从事新药研发工作。
博士,国家“千人计划”特聘专家,苏州晶云药物科技有限公司共同创始人及CEO。
北京大学化学系毕业后获全额奖学金赴美留学,并获得化学博士学位。2002-2010年间在美国默克制药公司从事新药研发工作,期间参与了超过50多个新药的研发工作,在国际学术期刊上发表学术文章20多篇。2010年回国创办苏州晶云药物科技有限公司,2015年9月16日,苏州晶云药物科技有限公司宣传完成1000万美元的A轮融资,苏州晶云是国内首家专注于药物晶型开发和产业化的公司。陈博士领导晶云团队凭借专业的服务和快速的反应,高质高效的专业服务,已与全球超过300家制药企业建立合作,为1000多个新药候选化合物提供了药物晶型研发的专业技术方案。晶云作为全球制药企业国际化及高端药物研发合作伙伴将会不断一如既往秉持客户至上的服务理念,力求为越来越多的客户提供优质的药物固态研发方案及药学CMC服务,帮助其降低临床开发风险,缩短研发周期,提高药物申报通过率以及建立全面的专利保护壁垒。
博士、以岭药业研究院副院长
1991年赴美国留学,后获得了美国克利夫兰州立大学分析化学专业博士学位,被美国克利夫兰医学中心聘为生物医药专业博士后研究员。自1998年开始到2015年3月一直在美国从事药物研发工作。他先后在新一代制药公司、强生制药和梯瓦制药公司等国际知名制药企业的研发部门担任分析研发高级总监等职务,他领导和主持开发的药物有10个通过FDA批准上市,还有10个品种在FDA的审评过程中。在化药研发方面,他具有深厚的理论知识及实践,具有丰富的国际化药研发和科研管理经验。
澳大利亚Minitab Pty Ltd公司技术及业务开发经理、高级工程师
拥有新南威尔士大学计算机科学硕士学位和麦考瑞大学应用统计硕士学位,在生物信息学数据研究领域发表过一系列论文。自2007年Minitab Pty Ltd公司成立以来,一直致力于为Minitab客户服务。董先生曾在澳大利亚麦考瑞大学担任统计研究员,并在东芝公司、Ozemail公司和新加坡国立计算系统担任过软件工程师和项目协调员。
河北科技大学教授 药智网首席科学家
曾任河北科技大学科技信息研究院所所长,理学院应用化学专业硕士生导师、化学制药研究所所长。从事医药化工领域的研究开发工作20多年,完成科研课题20余项,为企业提供技术服务10余项;申请专利6项,均已授权;发表论文50余篇。在进行医药化工专业的科研和教学工作的同时,对情报检索、信息咨询和信息资源建设有浓厚的兴趣,曾兼任多家医药、化工及IT企业的研发咨询顾问,承担专业文献检索、翻译,专题或单品种技术情报调研,企业技术人员情报技能培训,企业研发工作信息支撑系统构建,企业产品开发目标的筛选论证等信息咨询服务。今年9月8日-10日,由药智网和中国药房杂志社联合主办的《2017中国医药创新高峰论坛•暨医药企业研发实力百强榜发布》在重庆隆重举办,侯钰教授将作为本次大会的演讲嘉宾,以“整合药品专利信息,助力药品研发创新”为题和大家一起探讨专利和药品研发之间密不可分的关系。
博士、医学博士后、资深临床试验专家
主任药师、医学博士后、北京世桥生物副总裁、/北京科林臻和医药科技有限公司董事长,国家首批GCP核查专家,湖南省肿瘤医院药物临床试验机构创始人。从事GCP工作20多年来,具有在医院、企业、科研单位和政府部门工作经历,组织和完成了102个项目的临床试验;承担国家自然科学基金及省部级项目9项;发表论文20余篇,参编专著11部,省级成果2项。曾任CSCO执委、湖南省临床药理专业委员会秘书长等、现为中国博士后科学基金评审专家,北京市科委评审专家,北京化工大学特聘教授、硕士生导师。
南加州大学药物学博士、前FDA审评官
毕吕存博士从南加州大学获得药物学博士,并在药物研发分析领域工作了20多年,先后在Marion Merrill Dow(现在的Sanofi),3M pharmaceutics从事生物分析及药代方面的工作。毕博曾在美国FDA作为临床药理评审员工作1年。毕博于2009年回国加入科文斯上海,现担任科文斯上海分析实验室科学总监,主要负责小分子药物生物分析,并领导建立了毒代和临床药代动力学分析团队.
在毕博的领导下,科文斯生物分析部门完成了多个高难度的并具有很大影响力的项目,建立了多肽类药物,GLP-1 类似物,甘静胰岛素,偶联抗体,多糖药物,小核苷酸药物等液质方法学,近年来完成紫杉醇白蛋白和氯吡格雷生物等效性实验,和利培酮505B2美国申报及国内申报。毕吕存博士是中国生物分析协会(CBF)的成员。活跃在国内GLP/GCP药物分析领域,经常在CBF和临床分析(CPSA)会议上交流。
资深制剂和制剂设备专家
曾就职于法国 Ethypharm和美国 Noveon公司。曾担任挪威 Yessamin和德国 JRS的技术顾问;曾任华海药业制剂生产技术顾问近4年,独立承担了浙江华海药业某些ANDA项目,并申请了国际专利。已有近 20 年制剂开发经验,并累计承担了 60 多个项目的制剂研究开发及中试产业化,,擅长领域为固体制剂(口腔崩解片、缓释骨架片、控缓释微丸等)。现为富垚机电科技发展(上海)有限公司总经理。
 徐湛
徐湛清华大学工程硕士、中国食品药品检定研究院、礼来制药(Lilly)DoE培训讲师
曾为中国食品药品检定研究院、礼来制药(Lilly)、康龙化成(PHARMARON)、诺维信(Novozymes)、华北制药、应用材料(Applied Materials)、京东方和北方华创等众多医药和科技企业进行过DOE现场培训。
加入JMP中国前,曾先后就职于BOEOT、RFMD 、ENN Solar 公司,精通高科技行业六西格玛管理理念与实践,擅长探索性数据分析、实验设计、回归建模、生存与可靠性分析、统计过程控制等统计分析方法在实际工作中的应用,在新奥光伏工作的8年时间里,作为公司研发部副主任,成功完成了多个跨部门合作的六西格玛项目,涵盖电池产品转换率提升、新产品导入、量产良品率提升、过程质量控制等各个领域。尤其是通过引入先进的实验设计方法,降低产品研发成本,提高新产品开发效率,持续将最新研发成果转换为实际生产力并在多个行业学术会议上予以发表 。
1、时间长:本次培训总计10多位制药界不同细分领域的专家老师从不同角度授课,为保证学习质量,一般两天的培训我们增加到3天,业内少有。
2、实操:DoE主题培训,两个DoE软件商均安排理论+实操模式,先进行理论授课1小时,再进行实操2小时,学员自带电脑,现场每人提供试用版软件,培训模式为业内首次。
3、优惠:本次培训会期3天,凡报名2人免费赠送1个参会名额,优惠幅度之大,业内少见。
1、培训费:汇款2800元/人,现场缴费:3200元/人
2、优惠指南:每单位凡报名2人,赠送1个免费参会名额
本次培训名额有限,目前名额所剩不多,想要参会的朋友请及早报名!
报名采用蒲公英网上报名系统,微信识别下方二维码即可报名:

汇款方式
户名:天津凯博思科技有限公司
账号:0302 0475 0930 0049 778
开户行:中国工商银行天津市黄纬路支行
请尽量采用对公账户,个人账户请微信/支付宝付至
159 1117 2616
汇款时备注参会人姓名
报名咨询
刁老师:15911172616 微信:15911172616
盛老师:17316561718 微信:ak0369
入群
微信添加刁刁拉您入此次培训群(须备注单位姓名)

招募合作赞助单位,提供企业展位、形象展示等,可致电详谈。
会议酒店:
北京锦江富园大酒店(一层大宴会厅)
酒店住宿:标间、大床房,480元/晚(协议价)
酒店电话:010-67800531(说明参加国际制药项目管理协会会议即可享受协议价)
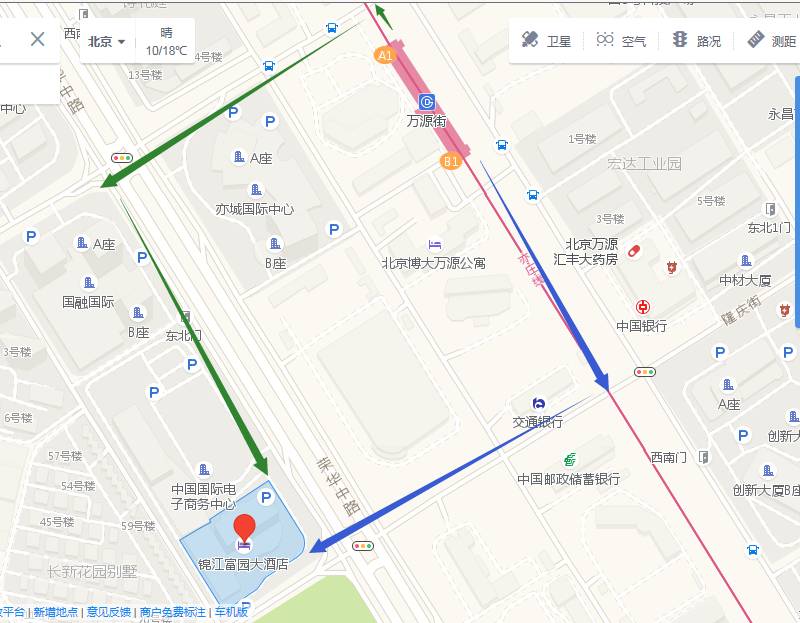
地址:北京经济技术开发区荣华中路11号(亦庄),地铁亦庄线万源街站下车步行约700米即到。请出发前规划好乘车路线,对北京不熟悉的参会人员建议乘坐出租车或滴滴。
乘车路线:
北京南站
1、北京南站南广场乘坐652路公交车至天华北街东口站下车---步行500米即到;
2、北京南站南广场乘坐665路公交车至博大大厦站下车---步行800米即到;
3、北京南站地铁站乘坐地铁4号线至角门西站---换乘地铁10号线至宋家庄站---换乘地铁亦庄线至万源街站下车---步行700米即到;
4、打车约47元。
北京西站
1、北京西站地铁站乘坐地铁7号线至磁器口站---换乘地铁5号线至宋家庄站---换乘地铁亦庄线至万源街站下车---步行700米即到;
2、北京西站南广场乘坐997路公交车至亦庄北环西路站下车,步行约900米即到;
3、打车约80元。
北京站
1、北京站乘坐地铁2号线至崇文门站---换乘地铁5号线至宋家庄站---换乘地铁亦庄线至万源街站下车---步行700米即到;
2、打车约50元。
首都国际机场
1、乘坐机场线至三元桥地铁站---换乘地铁10号线至宋家庄站---换乘亦庄线至万源街站下车---步行700米即到;
2、打车约124元。
附近酒店(1公里范围内)
备注:以下价格为网上(如微信)团购价格,无协议价,会议酒店附近还有其他众多不同等级酒店,临近元旦酒店紧俏,请及早预定。
1、格林豪泰(北京亦庄万源街地铁站商务酒店)
价格:约220元/晚,预订电话:010-67850998
地址:北京大兴区亦庄经济技术开发区荣华中路甲14号(距离会议酒店700米,距离万源街地铁站700米)
2、7天连锁酒店(北京亦庄万源街地铁站店)
价格:约200元/晚,预定电话:010-67873677
地址:北京大兴区亦庄经济开发区天华北街5号(汉阳生活娱乐广场院内)(距离会议酒店700米,距离万源街地铁站600米)
3、辰季酒店(北京亦庄店)
价格:约260元/晚,预定电话:010-67884848
地址:北京大兴区亦庄经济技术开发区永昌北路9号西门(距离会议酒店1000米,距离万源街地铁站700米)
致歉及说明:尊敬的各位学员,由于会期临近元旦,北京各大四、五星酒店会场非常紧张,尤其是市内四五星酒店几乎都被预订一空,我方工作人员提前一个多月进行酒店选址,咨询、考察近20家酒店,直至近日才最终确定,如给您带来不便,请多多理解,谢谢!
温馨提示: | 本次会议涉及DoE软件使用,为了更好的达到培训效果,建议参会人员自带电脑,我方提供软件,人手一份,会场指导安装、使用。用到电脑时间为第二天和第三天下午,各2~3小时,请提前充好电。 |
11月17日(星期五) 第一天 |
8:30-8:40 (10分钟) | 大会致辞,刁刁 |
8:40-10:10 (90分钟) | 题目:制剂处方工艺及难溶性药物研究 一、序言 (一)难溶性药物制剂的研究难点 (二)提高难溶性药物固体制剂溶出度的制剂技术 二、处方前研究 (一)API理化性质的研究 (二)生物学性质研究 (三)药物溶解性的影响因素 (四)药物的稳定性(物理化学、粉体学) (五)分析方法的研究 三、处方工艺研究 (一)正确选择适宜制备工艺和适宜辅料(处方) 重点关注:粒径、固体形态(晶型、无定形)对药物溶出和稳定性的影响; 影响产品关键质量属性CQA的关键物料属性CMA、关键工艺参数CPP进行优化
(二)介绍常用制备技术与设备 纳米粒的制备技术(Top-down,Bottom up) 固体分散体的制备技术(溶剂挥发法、熔融法、球晶制粒法) (三)比较不同制备技术的优缺点 主讲人:崔福德沈阳药科大学教授、博士、博士生导师,人民卫生出版社第五、六、七版《药剂学》主编 |
10:10-10:30 (20分钟) | 茶歇 |
10:30-12:00 (90分钟) | 题目:仿制药开发中的晶型研究 一、FDA及CFDA对晶型研究的法规要求; 1、仿制药研发在多晶型方面的考虑 2、什么时候需要制定晶型控制标准? 二、仿制药开发中晶型研究的意义; 1、晶型对药物性质的影响 2、不同温度下晶型转变的研究 3、不同湿度下水合物的相互转变 4、湿法制粒过程中的晶型变化 三、晶型对原料药及制剂性质的影响; 四、晶型研究及晶型专利无效典型案例分享 1、案例1 2、案例2 ...... 主讲人:陈敏华博士、国家“千人计划”特聘专家、苏州晶云共同创始人及CEO |
12:00-13:30 (90分钟) | 午餐(午餐后回会场分发软件) |
13:30-14:20 (50分钟) | 反向工程应用三个阶段: 1、项目研发初期了解参比制剂, 2、中试后BE结果不理想,进行调查 3、申报材料的有力说明,有利于证明研发路径的逻辑性以及处方和工艺的合理性。 反向工程技术手段: 1、近红外(NIR) 2、拉曼(Raman)光谱技术 3、其他 反向工程应用: 1、解析原研药的组成、 2、原料药处理工艺 3、原料药的无定型、结晶度变化 4、应用案例 5、开发高技术壁垒仿制药:包括缓控释制剂、难溶药、药物不稳定性等,涉及知识产权策略、技术和工艺成熟度、注册法规等因素。 主讲人:魏世峰 博士、资深科学家,北京罗诺强施联合创始人、CEO |
14:20-15:20 (60分钟) | 题目:实验设计(DoE)及Minitab在DoE中的应用(本次重点) 一、Minitab features 1.Sample size calculation 2.sample Equivalence test 3. sample t vs paired t test 二、DOE How to choose Fractional Factorial Designs and understand confounding structure How to analyse a factorial design Multiple Response Optimizer 主讲人:董鸣强澳大利亚Minitab Pty Ltd公司技术及业务开发经理、高级工程师(采用中文授课) |
15:20-15:40 (20分钟) | 茶歇 |
15:40-17:10 (90分钟) | 三、Case Study When a pharmaceutical company developed a new drug to reduce the level of certain proteins found in blood, they turned to Minitab to: 1.Evaluate their measurement system using Gage R&R 2.Determine required dosage to achieve the expected protein reduction using regression analysis 3.Use DOE tools to minimize tablet moisture level 4.Establish the process capability to produce a drug within specification of active ingredient limits 主讲人:董鸣强 Minitab Pty Ltd公司技术及业务开发经理、高级工程师(采用中文授课)
|
17:10-17:30 (20分钟) | 答疑 |
11月18日(星期六) 第二天 |
8:30-10:00 (90分钟) | 题目:助力仿制药研发工作的专利信息检索分析(电脑实操) 一、药品专利保护的五个特点 二、药品专利信息的网络来源 (一)国内的专利检索网站 1、国家知识产权局网站 2、中国专利信息网界面 3、中国知识产权网 (二)国外的专利检索网站 1、世界知识产权组织网站 2、欧洲专利局数据库(EPO) 3、美国专利商标局专利数据库 4、日本特许厅专利数据库 5、加拿大专利数据库 6、PCT国际专利数据库 (三)专利检索的其它途径 三、药品原始专利的检索途径 四、药品专利检索方法与技巧 1、药品专利检索的一般方法 2、EPO 与 FPO 专利文献收录范围比较 3、EPO 与 FPO 检索功能的比较 4、FPO数据库布尔逻辑式检索示例 5、EPO数据库高级检索(表格检索)示例 6、药品专利说明书的检索和下载 7、与药品治疗活性相关的IPC类别 五、药品专利保护的实例分析 1、专利文献分析调研的重点内容 2、专利的有效期限 3、美国专利权有效期限的推算 4、已上市药品专利权到期日的确定 5、药品专利保护链的检索与分析 6、Supplementary Protection Certificate Search 页面图例 7、药品专利权到期日个案分析 8、药品专利地域保护范围的确定 9、药品专利技术保护范围的确定 主讲人:侯钰河北科技大学教授药智网首席科学家 |
10:00-10:20 (20分钟) | 茶歇 |
10:20-11:50 (90分钟) | 题目:固体制剂的处方工艺如何从实验室走向商业化生产 1、固体制剂从实验室走向商业化生产经常遇到的问题分析 2、谋事在“人”:如何建立一个没有“猪”队友的技术转移团队? 3、磨刀不误砍柴工:如何识别“装备”设计性能差异这个大坑? 4、万事俱备,只欠东风:如何借东风?(设计理想的工艺放大参数) 5、成事在天:非战之罪也!(谈谈导致BE失败的非药学因素) 主讲人:王红喜资深制剂和制剂设备专家 |
11:50-12:00 (10分钟) | 答疑 |
12:00-13:30 (90分钟) | 午餐(午餐后回会场分发软件) |
13:30-14:30 (60分钟) | 题目:生物等效性预试验需要考量的问题 1、开展预试验之前需要获得的药学信息 2、预试验的目的 3、预试验例数的确定 4、预试验采血点和清洗期
5、预试验结果初步分析 主讲人:刘亚利博士、资深临床试验专家 |
14:30-15:30 (60分钟) | 题目:先进实验设计方法助力医药工艺研发(本次重点) 一、统计分析软件JMP介绍 (一)JMP是什么 (二)交互式、可视化的探索性数据分析 二、实验设计基础 (一)实验设计总体介绍 (二)实验设计的实施步骤 (三)实验设计的核心技术 三、实验设计的核心技术之实验数据的分析 (一)回归的基本原理 (二)多元回归建模及模型诊断过程 主讲人:徐湛清华大学工程硕士、中国食品药品检定研究院、礼来制药(Lilly)DoE培训讲师 |
15:30-15:50 (20分钟) | 茶歇 |
15:50-17:20 (90分钟) | 四、实验设计的核心技术之实验方案的制定 (一)经典实验设计案例 1、完全析因设计 2、(多元)响应曲面设计 (一)高级实验设计案例 1、定制设计 2、扩充设计 主讲人:徐湛清华大学工程硕士、中国食品药品检定研究院、礼来制药(Lilly)DoE培训讲师 |
17:20-17:30 (10分钟) | 答疑 |
11月19日(星期日) 第三天 |
8:30-10:00 (90分钟) | Basics of Experimental Approach and Design (本次重点) 一、Introduction 二、Experimental Approaches 三、Design of Experiments (DOE) and Product Development 1.DOE and applications 2.Types: Full factorial, fractional factorial, Plackett-Burman, Response surface (central composite, Box-Behnken), Mixture 3.Important concepts 4.Design process 四、Important Design Considerations 1.Five levels of product/process understanding 2.When and where to use DOE 3.Selection of variables and experimental domains 4.Special considerations in product/process studies using DOE 主讲人:邱怡虹博士、艾伯维制药资深高级研究员(资深总监) (备注:由于时间关系,邱博士此次授课将采用远程视频模式,其他专家老师均为现场授课。且为避免重复,以上授课内容将会根据Minitab、JMP工程师授课内容进行适当删减,请大家知悉) |
10:00-10:20 (20分钟) | 茶歇 |
10:20-11:50 (80分钟) | 五.Case Studies 六.Summary 主讲人:邱怡虹博士、艾伯维制药资深高级研究员(资深总监) (备注:由于时间关系,邱博士此次授课将采用远程视频模式,其他专家老师均为现场授课。且为避免重复,以上授课内容将会根据Minitab、JMP工程师授课内容进行适当删减,请大家知悉) |
11:50-12:00 (10分钟) | 答疑 |
12:00-13:30 (90分钟) | 午餐 |
13:30-15:00 (90分钟) | 题目:口服固体制剂处方工艺研究中的质量研究和控制 1、处方前研究的重要性 2、有区分性体外溶出方法的建立 3、原料、辅料、中间体和制剂的质量标准建立及说明 4、分析方法的开发、预验证和验证 5、分析方法的转移 6、质量研究中的项目管理 主讲人:陈洪博士、以岭药业研究院副院长 |
15:00-15:20 (20分钟) | 茶歇 |
15:20-16:20 (60分钟) | 题目:生物等效性试验生物样本分析的关键点 1、试验室的管理 2、试验室中变异度的控制 3、试验前BE的调研和方法学设计 4、预试验的结果评估 主讲人:毕吕存南加州大学获得药物学博士、前FDA审评官 |
16:20-17:00 (40分钟) | 答疑 |
报名采用蒲公英网上报名系统,微信识别下方二维码即可报名:

(报名)
微信添加刁刁拉您入此次培训群(须备注单位姓名)

(入群)
新闻来源:药研
商务合作:185 2338 0314
157 3056 3797


















