本文分析来源于2007-2011以及2012-2016年的临床试验
原文作者:Gavin Coney
中文翻译:徐聪颖
生物制药行业有很多关于临床试验设计和管理日益复杂的讨论。最近评估显示,将药物上市的成本高达30亿美元,而且10个药物中仅有1个能成功上市。这些高成本低成功率的趋势是不可持续的,使用有针对性的临床策略被认为是提高成功率的关键一步。
在本文中,我们研究了三种生物标志物(疗效标志物,毒性标志物,疾病标志物)的具体作用。我们还分析了不同生物标志物在多种适应症中的应用增长情况,这些趋势将与临床研究专业人员相关。虽然我们注意到总体上,使用生物标志物的临床试验的数量在增加,但各个生物标志物的增长率并不一致,这对很多后期临床试验中未被证实的疗效具有重要意义。
临床试验复杂性的增加导致了临床试验的平均持续时间的大幅延长,以及试验不同阶段的差异日期明显缩短。(见图1)。
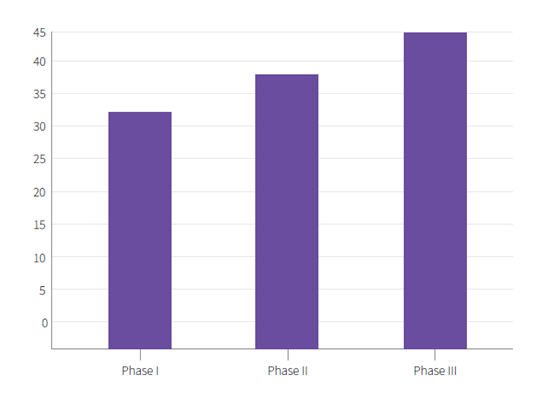
临床试验的试验时间增加会导致花费上涨,延迟药物上市以及错失成为潜在的首次上市的药物,阻碍了患者获取潜在的救生治疗。药物研发策略需要确保将上市的化合物能够显示足够的有效性,同时避免过多的招募要求、不必要的毒性以及昂贵的研究方案修订。
虽然临床试验时间表正在急剧扩大,特别是在肿瘤领域,我们也注意到临床研究的数量也在大幅增加。通过分析Cortellis临床试验情报中心数据库中在2007年至2016年期间开始的临床试验数量后发现,试验数量持续上升。我们在比较2007年1月1日至2011年12月31日(2007-2011)以及2012年1月1日 至2016年12月31日(2012-2016)这两个日期区间后发现,试验数量增长了33%。(见图2)
图2 2007至2016年开始的临床试验数量
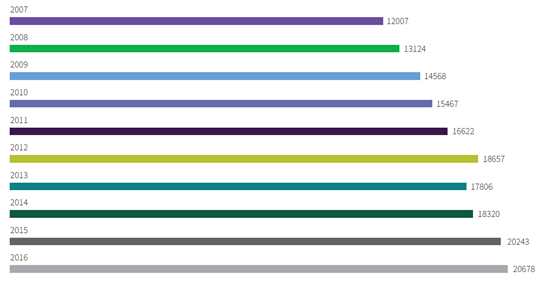
来源:Journal of Health Economics, DiMasi, Joseph A, Grabowski Henry G & Hansen, Ronald W. “Innovation in the Pharmaceutical Industry: New Estimates of R&D Cost.” 47, 20-33 (2016). 2 Cortellis Clinical Trials Intelligence, Clarivate Analytics, March 15, 2017.c
我们相信试验数量的增加对患者招募以及竞争有影响。根据分析还可以看出,和疾病机制、靶标行为以及患者分布相关的最佳可用的临床策略需要提高。
为了了解潜在的生物学模型的基本原理是否匹配试验的复杂性,我们查阅了最近发表的分析报告,分析结果表明绝大多数披露的临床试验失败理由不是策略原因,而是未经证实的有效性(52%)和安全性问题(24%),这突出了一个坚实的生物学原理的重要性,人们在理解潜在疾病机制,药物作用和受试者分组方面存在科学上的不足3。(见图3)
图3 试验失败原因
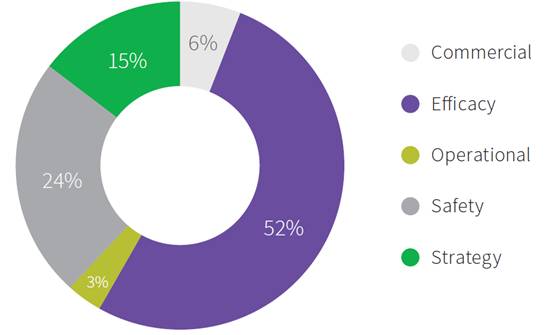
来源:Nature Reviews Drug Discovery, Harrison RK. “Phase II and Phase III Failures 2013-2015.” 15, 817–818 (2016)
患者群体具有多样化性质,对一部分患者人群有效和安全的治疗,对于另外一部分患者人群来说,可能不会有类似的益处,并可能引起额外的毒性。实验设计时使用分子亚型对患者进行细分的目的是增加能证明处于研发阶段的靶向疗法有效性的可能性,同时减少或消除已知的可能增加无应答概率或严重不良事件行为的影响。生物标志物的有效应用对于确定患者细分策略和试验入组标准至关重要。太宽的患者细分可能导致疗效不能得到证实; 相反,基于不正确假设的模型可能对有效性和安全性都有影响。另外太窄的患者细分可能会给患者招募带来挑战。
采用这种靶向方法的新药不仅改变了我们治疗特定疾病的能力,还可以增加我们开发新疗法和患者治疗的潜力。在Philadelphia染色体阳性的慢性骨髓性白血病(CML)和急性骨髓性白血病(AML)患者中,伊马替尼(Imatinib)通过把5年生存率从31%显著提高到81%验证了这种临床策略。
患者治疗的改善也反映在其他例子中,这些例子中的临床策略都是基于特定的患者群体,从而降低风险,最终缩短上市时间,尤其是当它被批准可以采用快速审批途径的时候。从历史上看,药物审批力求在最初的和扩大的适应症上,最大限度地利用潜在的市场机会。临床试验所需的平均持续时间上升表明,改变策略方法非常有价值,特别是近期在伊马替尼和派姆单抗(Keytruda)等药物取得成功之后更加明显。由默沙东开发的派姆单抗适用于TPS> 1%PD-L1表达为阳性以及EGFR和ALK突变为阴性的转移性或晚期非小细胞肺癌患者。这种新药作用机制易于理解,并且和明确的生物标志物相关联,以致研发专业人员有信心在试验早期仔细选择特定细分患者,从而使药物尽早展现疗效,获得了独特加速的批准。最终药物的上市许可让患者和默沙东都受益。
为了确定这些著名的成功是治疗发展的新阶段的开始,我们希望了解个性化治疗的转变有多深以及这种策略在不同治疗领域的临床应用有多广泛。通过比较两个时期(2007 至 2011年以及2012至2016年)开始的临床试验,我们可以确定在有效的临床试验中许多应用生物标志物的趋势,证明了应用特定类型的生物标志物有所增加,这也凸显了一些我们有机会增加潜在生物学机制知识的治疗领域。
我们分析了Cortellis临床试验情报中心里包含263,210条临床试验记录的数据库,数据库中每个记录代表一个临床试验,这些数据来自于30个全球试验注册管理机构和其他有来源的参考文献。(见图4)
图4 使用特定生物标志物的临床试验数量,2007-2011 以及2012-2016
因疗效而使用生物标志物的临床试验

因毒性而使用生物标志物的临床试验

因疾病风险而使用生物标志物的临床试验

正如预期一样,我们的分析证实生物标志物的使用正在增加。通过检查从2007年到2016年开始的临床试验,我们发现开始临床试验数量在增长。从2007年到2011年,总共有71,735例临床试验,而从2012年到2016年,总共有95,552例临床试验,数量增加了33%,使用生物标志物评价疗效,毒性以及疾病的试验数量也显着上升。当分析所有生物标志物的作用时,我们发现疾病标志物在该时间段内增加了120%,其次是毒性标志物增加了99%,最后是疗效标志物增长了61%。
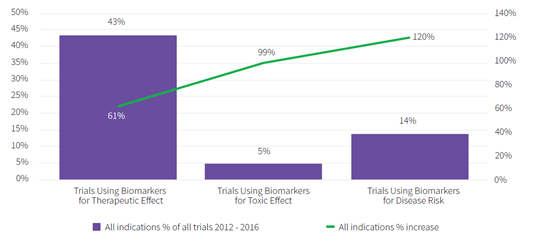
为了分析应用特定类型生物标志物的临床试验的数量增长,我们检查了应用特定生物标志物的试验数量的增长率与当前水平的关系。(见图5)
图 5 应用特定生物标志物的临床试验数量的百分比与增长率的关系
来源 Cortellis Clinical Trials Intelligence, Clarivate Analytics, March 2017.c. 4 New England Journal of Medicine,
Druker BJ, et al. “Five-Year Follow-up of Patients Receiving Imatinib for Chronic Myleloid Leukemia.” 355, 2408-2417 (2006)
在这里我们可以看到,有43%的临床试验使用疗效生物标志物,并且增长率是61%。但是疗效生物标志物的增长率不如毒性生物标志物(99%)或疾病标志物(120%)那么快。鉴于毒性和疾病标志物的历史应用相对较低,该临床方案研究有利于将来形成患者可用的治疗方法。
鉴于各个适应症的所有生物标志物的作用总体增强,个别具有最高增长水平并正在经历最剧烈的转变的治疗领域将显得突出。我们将研究变化最大的治疗领域(TAs)中的疗效标志物,毒性标志物和疾病标志物。
从疗效标志物的应用增长来看,营养失调性疾病相对于高基线水平而言,呈现最快增长。在相对较低的基线水平上应用疗效标志物时,神经系统疾病、心血管疾病和肌骨病都明显经历了快速增长的时期。我们还可以观察到妇产科是另外一个应用疗效标志物的高增长领域。(见图6)
图6 应用疗效生物标志物的增长率与相同治疗领域的试验数量百分比的关系
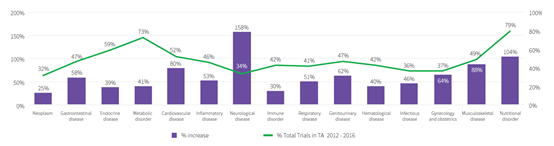
虽然整体上使用毒性标志物的试验数量低于其他标志物,但是证据表明其在既有和新兴治疗领域有增长。在该表中就占所有治疗领域的百分比而言,尽管肿瘤相对较多,但肿瘤没有出现在应用毒性生物标志物的最高增长领域名单中。代谢疾病当前的使用率较高,但增幅较低。拥有最高增长率的领域是神经系统疾病,增长率为177%,其次是心血管系统疾病144%和传染性疾病114%。在拥有较少数量的临床研究的治疗领域中,营养失调性疾病的增长率152%,肌骨病增长率为107%,以及代谢疾病增长率为103% 。(见图7)
图7 应用毒性生物标志物的增长率与相同治疗领域的试验数量百分比的关系

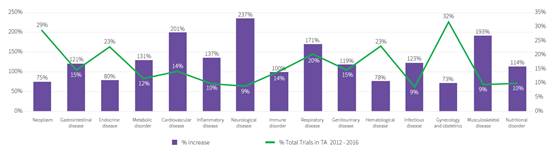
我们看到一些领域使用的疾病标志物的增长率非常大(> 100%),这证实了我们在前面全球层面的分析。在使用疾病标志物的领域中,我们看到妇产科的临床试验数量比其他任何领域都高。然而,它也显示出最低的使用增长水平。神经系统疾病和其他疾病相比,有最大的增长率(见图8)
图8 应用疾病生物标志物的增长率与相同治疗领域的试验数量百分比的关系
我们在这里的分析为企业界的个体成功以及面临的挑战提供了一个宏观视角。结合我们对不同生物标志物作用和治疗领域的认知,我们可以清楚地认识到针对疗效,毒性和疾病的生物标志物的应用在上升。然而,目前的使用和投资水平在不同治疗领域有很大的不同,这是不同的临床策略和对生物学基础理解信心的反应。
鉴于进行临床试验的持续时间和成本增加,对潜在生物学原理的信心至关重要。生物标志物可在患者选择和疗效确认方面发挥关键作用。在本篇分析中,我们已经展示了一些较强和较弱的疾病增长领域。在我们观察的三种生物标志物中,神经系统疾病显示出最高的增长率。考虑到神经系统疾病是一个相对成熟的领域,这表明人们在治疗中使用生物标志物观察疗效,毒性和疾病的信心在持续增加。尽管营养失调性疾病的试验数量低得多,但除了疾病标志物之外,所有类别的增长都是第二高。肌骨病试验中生物标志物的总体使用在整个表中也表现良好。尽管生物标志物在肿瘤领域中的巨大成功推动了其应用潜力,但是其增长速度在减慢,并且和最高增长率相差甚远,没有出现在任何增长指标列表里。
活动预告
:
欲了解更多关于目前临床试验中的生物标志物的状况与作用,以及生物标志物的具体使用方向。欢迎注册参加科睿唯安CORTELLIS在线大讲堂
时间:
2017年09月07日(周四) 14:30-16:00
主题:
赢在起点——临床试验
中生物标志物的应用与开发
点击左下角【阅读原文】免费在线注册
科睿唯安(原汤森路透知识产权与科技集团事业部)对本文的全部内
容以及可能附带的全
部资料拥有全部知识产权,并受法律保护。网络转载、编译及其他商业使用请联系市场
部:[email protected]






