【背景介绍】
随着骨科植入物在骨缺损治疗中的广泛应用,骨植入体相关感染成为日益严峻的挑战。抗生素耐药性的快速发展以及感染防控技术的停滞,暴露出传统治疗方法的局限性。因此,亟需探索新型非抗生素治疗手段,这些方法不仅能够高效清除感染源,还能促进植入物与周围组织的融合,从而在抗感染与组织再生方面实现双重突破。
为此,
四川大学华西医院骨科/运动医学/骨科研究所周宗科/王端团队联合四川大学材料科学与工程学院吕想团队
功能性压电生物材料上取得新进展。相关成果以
“A multimodal defect-rich nanoreactor triggers sono-piezoelectric tandem catalysis and iron metabolism disruption for implant infections”
为题发表于
Science Advances
(DOI:10.1126/sciadv.ads8694)
。

作者成功开发了一种基于无铅压电纳米反应器的声压动力-化学动力(SPT-CDT)级联催化技术,通过构建富含氧空位的钡/钛掺杂钙钛矿结构(BFBT)纳米材料,实现了钛(Ti)植入物表面的高效抗菌和骨再生功能。该技术利用超声诱导的压电效应,触发自循环Fenton反应,生成大量羟基自由基,并通过氧空位促进电子迁移,维持高活性铁(Fe)状态,绕过了传统Fenton反应的限速步骤,实现了高效的化学动力学治疗。同时,该技术通过扰乱细菌的铁代谢,结合大量活性氧自由基(ROS)的产生,诱导细菌发生类铁死亡,显著增强了抗菌效果。此外,BFBT涂层在细胞黏附力下产生的生理电微环境,能够刺激巨噬细胞由M1向M2极化,重塑抗菌后的炎症环境,并在无超声条件下加速骨再生。结果表明,BFBT涂层在体内表现出卓越的抗菌和骨修复能力,显著提升了成骨相关标志物(如Runx2、BMP-2和CD31)的表达水平。该研究为设计高效抗菌和促进骨再生的植入物涂层提供了新的思路和理论依据,具有广阔的临床应用前景。
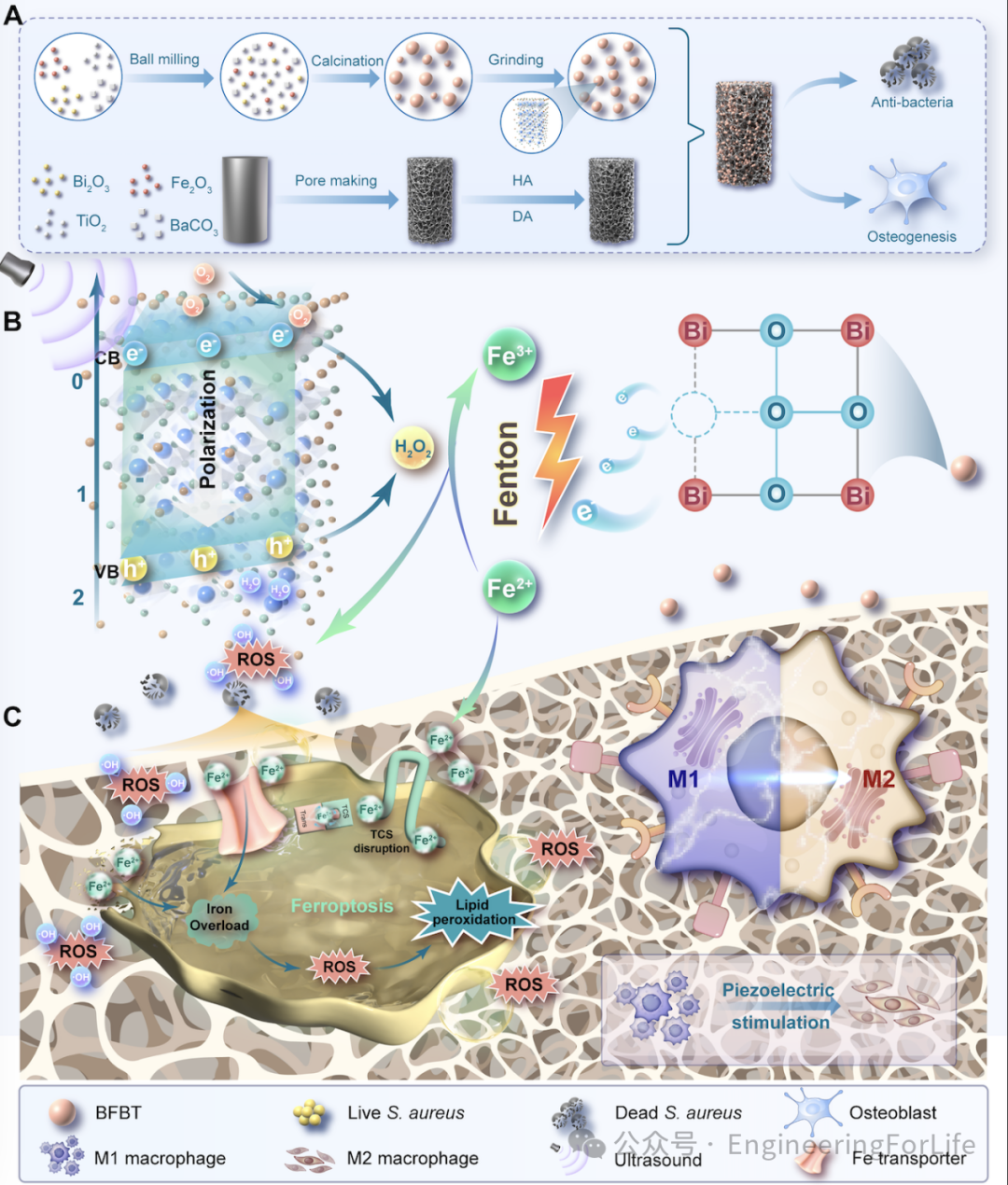
图1 SPT-CDT串联催化及细菌铁代谢破坏用于植入物感染的示意图
首先,作者展示了无铅压电纳米材料(BFBT)在超声刺激下的压电催化性能(图2D and E):超声诱导的压电效应使BFBT晶体结构产生不对称变形,进而生成自供给的H2O2,并通过铁(Fe)介导的Fenton反应高效产生羟基自由基。结合氧空位促进的电子迁,BFBT能够维持高活性铁(Fe)状态,持续催化反应,实现了自循环的声压动力-化学动力(SPT-CDT)级联反应。基于亚甲基蓝(MB)等探针的验证实验(图2F)表明,调节超声频率和强度可精确控制羟基自由基的生成速率,模拟与实测的电子自旋共振(ESR)(图2G)谱图高度吻合,证实了BFBT在超声作用下能够高效生成羟基自由基。进一步的光学流追踪实验显示,氧空位富集的BFBT能够持续向反应中心Fe提供电子(图2J and K),保持Fe的高活性状态,稳定催化反应,实现了无外部添加剂的SPT-CDT自循环级联催化,为高效抗菌和骨再生奠定了理论基础(图2L)。

图2 BFBT压电催化剂的结构表征及压电催化活性
接着,作者计算了BF和BFBT的带隙结构(图3A),结果显示BFBT的导带电位满足O2/•O2−和H2O2/•OH的反应条件,同时,BFBT的压电电位和能带弯曲促进了电子和空穴的表面反应,触发级联氧化还原反应(图3B)。通过DFT计算,作者模拟了BF和BFBT的氧空位结构,发现BFBT中富电子Fe位点能直接解离H2O2生成2OH*,能量较低(图3C)。差分电荷密度(图3D and E)和COHP分析(图3F)表明,BFBT中电子注入更多,O-O键更弱,进一步解释了其高效ROS生成的机制(图3K)。
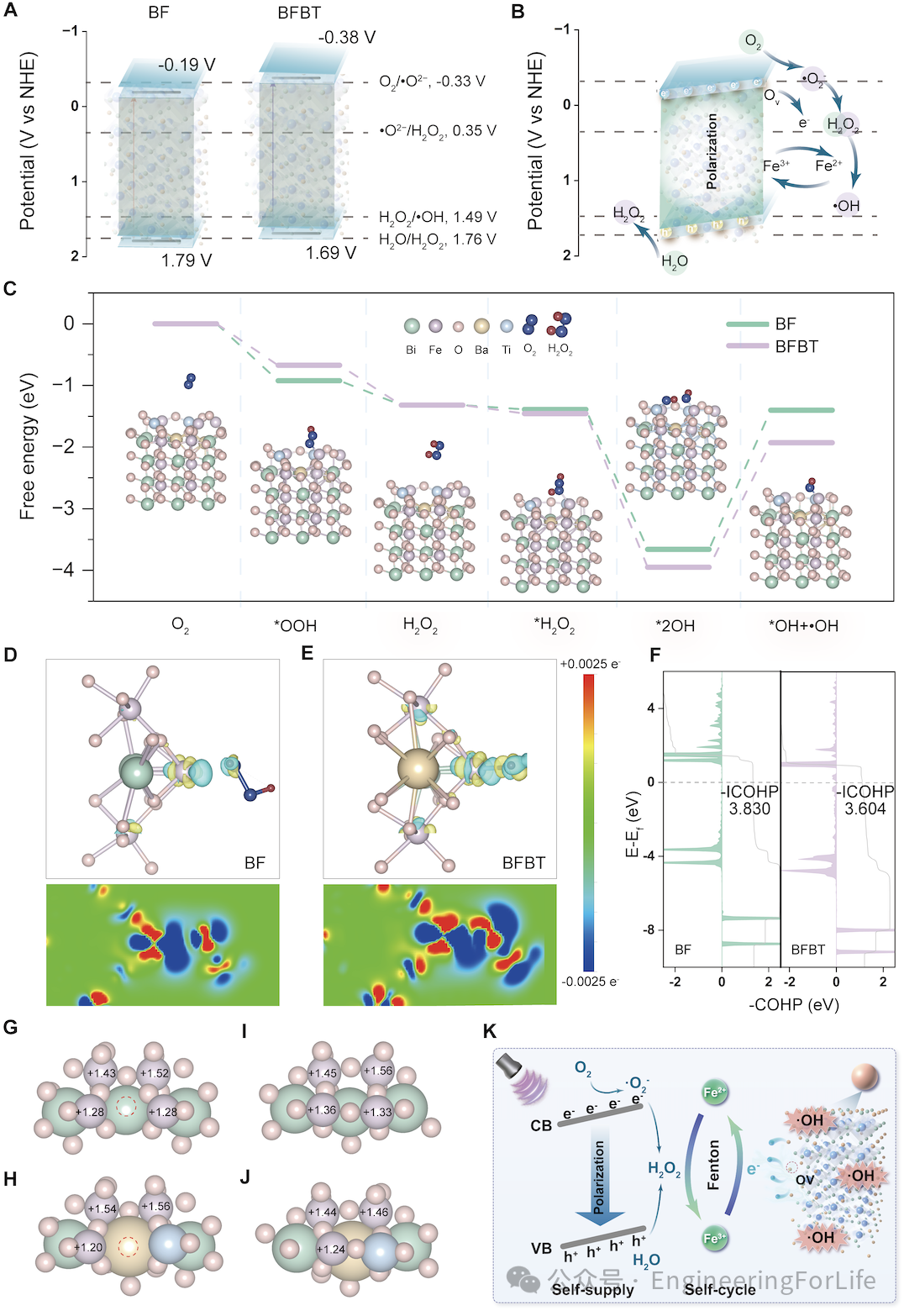
图3 BFBT压电纳米反应器压电催化活性原理
然后,作者通过碱热处理在钛表面构建了多孔结构(T),并进一步修饰了pDA(Tp)、纳米羟基磷灰石(TH)和BFBT(TH-BFBT)。体外抗菌实验显示,TH-BFBT在超声作用下对金黄色葡萄球菌和大肠杆菌的杀菌率分别达到93.1%和94.3%(图4A-B)。SEM观察显示,TH-BFBT+US组细菌表面出现明显褶皱和破裂,表明其强大的抗菌效果。Live/Dead和结晶紫染色进一步证实了TH-BFBT+US对生物膜的显著破坏(图4C)。Bio-TEM图像显示,TH-BFBT+US处理的细菌细胞壁不完整并伴有细胞质泄漏,表明其通过ROS和铁代谢干扰诱导了细菌的类铁死亡(图4D-E)。RNA-seq分析揭示了TH-BFBT对细菌双组分系统(TCS)的显著影响,进一步证实了其通过破坏铁稳态诱导细菌死亡的机制(图4F-K)。




