
【通用名称】
康柏西普眼用注射液
【商品名称】
朗沐
【英文名称】
Conbercept Ophthalmic Injection
【汉语拼音】
Kang Bo Xi Pu Yan Yong Zhu She Ye
【成份】
活性成份:康柏西普(Conbercept)是利用中国仓鼠卵巢(CHO)细胞表达系统生产的重组融合蛋白(由人血管内皮生长因子VEGF受体1中的免疫球蛋白样区域2和VEGF受体2中的免疫球蛋白样区域3和4,与人免疫球蛋白Fc片段经过融合而成)。
辅料:枸橼酸、蔗糖、精氨酸、聚山梨酯20等。
【性状】
本品为白色或类白色澄清液体。
【适应症】
本品适用于治疗:
1) 新生血管性(湿性)年龄相关性黄斑变性(nAMD);
2) 继发于病理性近视的脉络膜新生血管(mCNV)引起的视力损伤。
【规格】
10 mg/ml,0.2 ml/支
【用法用量】
本品应在有资质的医院和眼科医师中使用。医院应具备该疾病诊断和治疗所需的相关仪器设备和条件,由具备确诊新生血管性(湿性)年龄相关性黄斑变性(nAMD)和继发于病理性近视的脉络膜新生血管(mCNV)引起的视力损伤的能力和丰富的玻璃体腔内注射经验的眼科医生进行诊断和治疗操作。
1) 一般给药信息
本品仅用于经玻璃体腔内注射给药。
2) 新生血管性(湿性)年龄相关性黄斑变性(nAMD)
推荐给药方案为:推荐剂量为每次0.5mg(相当于0.05ml的注射量),初始3个月,每个月玻璃体腔内给药1次,之后每3个月玻璃体腔内给药1次。
或者,在初始3个月连续每月玻璃体腔内给药1次,之后按需给药。这种方案需要患者每月随访,由眼科医师根据患者的视力和影像学结果,评估是否因活动性病变而需要再次给药治疗。初始连续给药3次后,按需给药与每3个月给药1次相比,需要更多的随访和检查,但患者可能在更合理的给药次数情况下获得更佳的治疗效果。
治疗期间应关注患者视力变化情况,如果出现显著的视力下降,患者应根据眼科医师的评估进一步接受本品注射治疗。两次注射之间的间隔时间不得小于1个月。
3) 继发于病理性近视的脉络膜新生血管(mCNV)引起的视力损伤
推荐的给药方案为:推荐剂量为每次0.5mg(相当于0.05ml的注射量),初始3个月,连续每月玻璃体腔内给药1次,之后按需给药。
按需给药方案需要患者每月随访,由眼科医师根据患者的视力和影像学结果,评估是否因活动性病变而需要再次给药治疗。治疗期间应关注患者视力变化情况,两次注射之间的间隔时间不得小于1个月。
给药方法:
1. 术前准备
在玻璃体腔内注射给药前,应对患者的既往病史进行全面的评估,以评估其发生高敏反应的可能性(见【禁忌与注意事项】)。
本品必须在无菌条件下进行玻璃体腔内注射,其中包括采用外科手术的手部消毒、无菌口罩、无菌手套、无菌手术单和无菌开睑器(或类似器具)。注射前必须给予患者适当的麻醉剂和眼局部用广谱抗生素。注射前消毒眼周皮肤、眼睑和眼球表面。
2. 药品准备
本品为一次性无菌中性硼硅玻璃管制注射剂瓶(西林瓶)包装。
应在给药前进行康柏西普眼用注射液外观检查,如发现药物有微粒、浑浊、变色,则不能使用。
玻璃体腔内注射操作应采用30G一次性无菌注射针头。请严格按照使用说明进行本品配置操作(见【
使用和操作以及丢弃说明
】)。
3. 注射操作
1) 嘱患者朝远离注射部位的方向注视;
2) 距角巩膜缘3.5~4.0 mm的范围进针,应倾斜缓慢刺入巩膜,针尖朝向眼球中心(避免伤及晶状体);
3) 小心缓慢推完药液;
4) 拔出针头,使用棉签压迫穿刺孔防止药液反流。
每支康柏西普眼用注射液只能用于一只眼的单次治疗。尽量避免同一患者双眼同时治疗,如果必须进行,应当重新消毒,更换药物和注射器具。
4. 注射后
注射结束时结膜囊内可滴入抗生素。注射后一周内应对患者进行监测;叮嘱患者出现眼部疼痛或不适、眼红加重、畏光或视力下降等症状时,及时向医师报告。(见【禁忌与注意事项】)。
特殊人群用药
肾损害
尚无相关研究。由于全身暴露可忽略不计,无须采取特别措施。
肝损害
尚无相关研究。由于全身暴露可忽略不计,无须采取特别措施。
儿童与青少年(18岁以下)
尚无相关的安全与有效性数据。
老年患者
无需调整剂量。
【不良反应】
1、临床试验数据
1) 新生血管性(湿性)年龄相关性黄斑变性(nAMD)
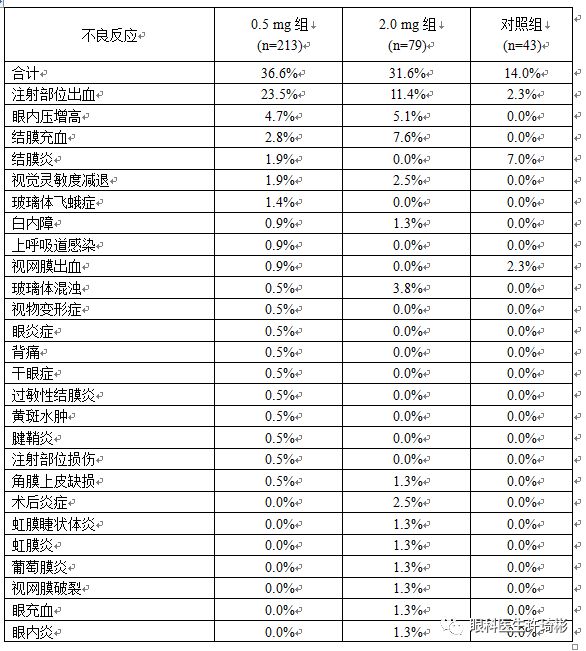
在4项以新生血管性(湿性)年龄相关性黄斑变性(nAMD)患者为研究人群的临床试验(HOPE、BRIDGE、AURORA和PHOENIX)中,共292例患者接受康柏西普眼用注射液治疗,试验中最常见的不良反应为:注射部位出血、眼内压增高和结膜充血,这3种不良反应均由玻璃体腔内注射引起,且程度较轻,大多数无需治疗即可恢复。其他的不良反应包括结膜炎、视觉灵敏度减退、玻璃体飞蛾症、白内障、视网膜出血、玻璃体混浊、术后炎症、角膜上皮缺损等,极少数患者出现视物变形症、眼炎症、干眼症、过敏性结膜炎、黄斑水肿、注射部位损伤、虹膜睫状体炎、虹膜炎、葡萄膜炎、视网膜破裂、眼充血、眼内炎、眼痛等偶发的不良反应。
表1. 康柏西普眼用注射液治疗nAMD适应症不良反应列表

2) 继发于病理性近视的脉络膜新生血管(mCNV)引起的视力损伤
在一项以继发于病理性近视的脉络膜新生血管(mCNV)引起的视力损伤为研究人群的III期临床试验中,共171例患者接受康柏西普眼用注射液治疗。治疗组在整个试验期间最常见的不良反应为注射部位出血和眼内压增高,这2种不良反应程度都为轻度,且均由玻璃体腔内注射引起,大多数患者无需治疗即可恢复。其他的不良反应包括眼内炎、非传染性(非感染性)眼内炎、眼痛、角膜沉积物、眼压降低、眼炎症等,极少数患者出现注射部位水肿、视网膜出血、玻璃体出血、玻璃体飞蛾症、玻璃体疾病、结膜炎、前房炎症、视觉灵敏度减退等偶发的不良反应。
表2. 康柏西普眼用注射液治疗mCNV适应症不良反应列表
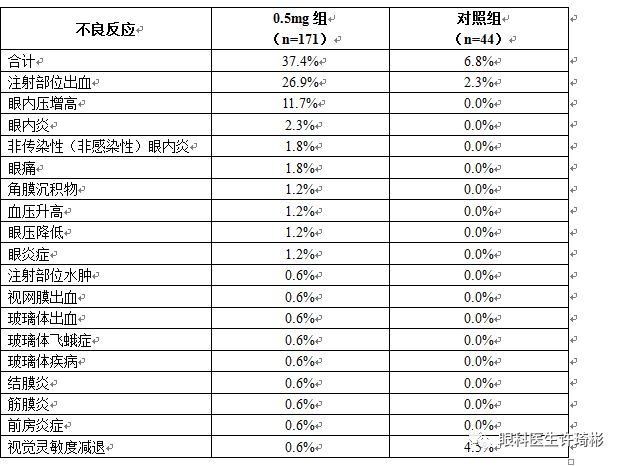
*注:0.5mg组是指SHINY试验中所有至少接受过一次康柏西普眼用注射液治疗的受试者,包括治疗组和在延长期接受康柏西普眼用注射液治疗的对照组受试者。
2、上市后监测数据
根据一项上市后5千多例的回顾性安全性研究,和截止2015年11月26日临床用药的自发性安全报告,监测到的多数不良反应与临床试验中观察到的一致。此外,还有少量新发现的不良反应包括:(1)眼局部不良反应:视网膜脱离、玻璃体腔积血、角膜上皮脱离、前房混浊、视网膜出血、玻璃体腔内异物、眼异物感、眼睑水肿、眼睛不适、结膜水肿和角膜水肿;(2)全身不良反应:骨骼肌肉疼痛和带状疱疹、过敏(皮疹、荨麻疹)、偏头痛。以及新发现的不良事件:心前区不适1例,尚不能确定其与药物的相关性。
3、相同作用机制产品相关安全性风险
根据相同作用机制产品的公开报道和文献,接受抗VEGF治疗的安全性风险还包括:(1)常见的眼部不良反应:玻璃体脱离、视觉障碍、玻璃体漂浮物、结膜出血、眼部刺激、眼异物感、流泪增加、睑缘炎、眼瘙痒、视网膜变性、视网膜异常、视网膜色素上皮脱离、视网膜色素上皮撕裂、视力下降、玻璃体异常、后囊膜混浊、点状角膜炎、角膜上皮擦伤、前房闪辉、视力模糊、眼部出血、眼分泌物、闪光幻觉、畏光、眼睑痛、核性白内障、后囊下白内障、皮质性白内障、角膜糜烂等。(2)不常见的眼部不良反应:晶状体混浊、失明、前房积脓、前房出血、角膜病、虹膜粘连、角膜皱褶、注射部位刺激、眼睑刺激等。(3)部分受试者出现了皮疹、荨麻疹、瘙痒和红斑等过敏反应。
4、免疫原性:
同所有治疗性蛋白药物一样,接受康柏西普治疗的患者中有潜在出现免疫反应的可能。免疫原性数据高度依赖于检测方法的灵敏性和特异性。
在康柏西普眼用注射液的I-II期临床研究中,采用光学表面等离子共振(Surface Plasmon Resonance,SPR)技术,共检测63例受试者的450份给药前后的血清样品,未检测出明确的、针对康柏西普的特异性抗体。在以上研究中,共有4例患者发现可疑的阳性信号,其中2例患者用药后的血清抗-康柏西普抗体响应值低于用药前;另外2例采用梯度浓度法对抗-康柏西普抗体进行再次测量,结果显示没有浓度相关性,可能均为非特异结合,但提示应关注患者接受康柏西普眼用注射液治疗后的免疫反应。
【禁忌】
对于康柏西普或药品成分中任何一种辅料过敏的患者禁用。过敏反应可引发严重的眼内炎症反应。
眼部或眼周感染的患者禁用。
活动性眼内炎症患者禁用。
【注意事项】
玻璃体腔内注射,包括本品注射,与眼内炎、眼内感染、孔源性视网膜脱离、视网膜撕裂和医源性外伤性白内障有关(参见【不良反应】)。本品注射时必须采用合格的无菌注射技术。此外,注射后一周内应监测患者的情况,以便早期发现感染并治疗。眼科医师应指导患者在出现任何提示有眼内炎的症状或任何上述提到的事件时,立即报告给医师。
本品注射后60分钟(根据本品临床研究情况描述)内可观察到眼内压升高(参见【不良反应】)。因此须同时对眼内压和视神经乳头的血流灌注进行监测和适当治疗。虽然在康柏西普的临床试验阶段尚未观测到动脉血栓栓塞事件,同类型药物国外大规模临床试验结果也显示,接受玻璃体腔内注射血管内皮生长因子(VEGF)抑制剂的治疗组和假注射对照组,动脉血栓栓塞事件的发生率是相近的,但是使用血管内皮生长因子(VEGF)抑制剂后,存在潜在的动脉血栓栓塞风险。
有文献报道显示,长期高频率的使用抗VEGF药物,有少数患者有可能出现地图样萎缩,提示长期过度使用本品也有出现地图样萎缩的可能。因此主治医师应谨慎评价对这些患者使用本品治疗是否合适,以及治疗益处是否超过了潜在的风险。
同所有治疗性蛋白药物一样,接受康柏西普治疗的患者中有潜在出现免疫反应的可能。
尚未开展双眼同时使用本品治疗的安全性和有效性研究。如果双眼同时接受治疗,可能会使全身暴露量升高,从而导致全身不良事件的风险升高。
本品不得与其他抗血管内皮生长因子(VEGF)药物同时使用(全身或局部使用)。
出现下述情况,应暂停给药,且不得在下次计划给药时间之前恢复给药:
与上次的视力检查相比,最佳矫正视力(BCVA)的下降 ≥30字母;
眼内压≥30 mmHg;
视网膜撕裂;
涉及中心凹中央的视网膜下出血,或出血面积占病灶面积的50%或更多;
在给药前后的28 天已接受或计划接受眼内手术。
接受抗VEGF治疗新生血管性(湿性)年龄相关性黄斑变性(nAMD)之后,视网膜色素上皮撕裂的风险因素包括大面积的和/或高度隆起的视网膜色素上皮脱离。在具有这些视网膜色素上皮撕裂风险因素的患者中开始本品治疗时应谨慎。
孔源性视网膜脱离,3期/4期黄斑裂孔患者应中断治疗。
本品治疗可引起短暂的视觉障碍,这可能影响驾驶或机械操作的能力(参见【不良反应】)。出现这些症状的患者在这些暂时性的视觉障碍副作用消退前不能驾驶或进行机械操作。
【孕妇及哺乳期妇女用药】
妊娠
目前尚无本品在妊娠妇女中使用的数据。尚不清楚妊娠妇女使用本品是否会对胎儿造成伤害,或者会影响生育能力。故本品不得用于妊娠妇女,除非预期利益超过其对于胎儿的潜在风险时才可考虑使用。
有生育力的妇女
有生育能力的妇女应在治疗期间采取有效的避孕措施。
哺乳
不清楚本品是否分泌入人乳汁中。作为预防性措施,建议患者在本品治疗期间不要哺乳。
【儿童用药】
尚未进行该项研究,且无可靠参考文献。
【老年用药】
在已开展的临床试验中,接受本品治疗的患者平均年龄为66.27±8.26岁,约 53.7%的患者年龄≥65岁,约19.7%的患者年龄≥75岁。在这些试验中,随着年龄增加,没有发现本品的有效性或安全性出现显著差异。
【药物相互作用】
尚未进行该项研究,且无可靠参考文献。
【药物过量】
尚未进行该项研究,且无可靠参考文献。如果出现药物过量,应监测眼内压并治疗(如果主治医师认为有必要时)。
【临床试验】
本品的安全有效性数据主要来自于以下3项在新生血管性(湿性)年龄相关性黄斑变性(nAMD)患者中和1项在继发于病理性近视的脉络膜新生血管(mCNV)引起的视力损伤的患者中进行的临床试验。
1. 新生血管性(湿性)年龄相关性黄斑变性(nAMD)
在4项新生血管性(湿性)年龄相关性黄斑变性(nAMD)临床试验(HOPE、BRIDGE、AURORA和PHOENIX)中,共292例患者接受康柏西普眼用注射液治疗。其中3个主要临床试验结果如下:
1.1. PHOENIX试验
PHOENIX试验是一项多中心、双盲、随机、假注射对照的III期临床试验。筛选合格的受试者按2:1的比例随机分配至0.5 mg治疗组和假注射组,核心期分别每月接受1次玻璃体腔内注射药物或假注射,连续3次。在随后的延长治疗期,治疗组接受每3个月一次的玻璃体腔注射0.5 mg的康柏西普眼用注射液,假注射组从第3个月末开始连续3个月每月接受一次玻璃体腔注射0.5 mg的康柏西普眼用注射液,随后每三个月给药一次。
3个月核心期治疗结束时,治疗组最佳矫正视力(BCVA)较基线提高9.2±9.22个字母,改善显著(P<0.001);假注射组BCVA较基线提高2.0±12.67个字母(P=0.301)。经协方差分析(ANCOVA),两组组间差异显著。
其他影像学指标中,治疗组中心视网膜厚度较基线下降79.2±136.03 μm,假注射组中心视网膜厚度较基线没有统计学意义的改变。同时,治疗组的中心点视网膜厚度、总黄斑体积、病损总面积和渗漏面积等指标较基线改变情况与对照组相比,组间差异均有统计学意义。
在完成12个月的治疗后,治疗组维持了核心期治疗结束时的视力水平,最佳矫正视力(BCVA)提高10.0±13.96个字母,与基线相比改善显著(P<0.001),同时各影像学指标的改善也得到维持;假注射组(从第3个月末开始连续3个月每月接受1次0.5 mg康柏西普眼用注射液玻璃体腔注射,之后每3个月1次)BCVA较核心期结束(第3个月)时提高6.8±10.08个字母(P<0.001),中心视网膜厚度较核心期结束下降96.6 ± 161.42 μm(P<0.001),与治疗前(无论是基线还是核心期结束时)相比均有显著改善。
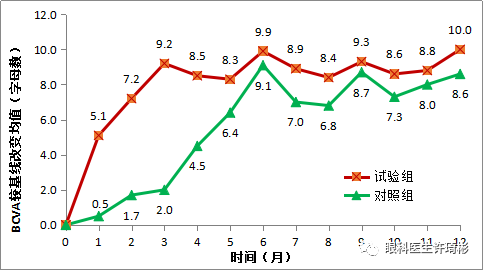
图1. PHOENIX试验中从基线期到第12个月视力的平均改变(FAS人群)
1.2. AURORA试验
一项多中心、双盲、随机、不同剂量和不同频度给药的平行对照临床试验,受试者按1:1随机进入0.5 mg和2.0 mg两组,目标眼玻璃体腔内注射康柏西普眼用注射液,核心期给药1次/月,共3次。在延长治疗期,0.5 mg和2.0 mg两组受试者又分别按1:1随机分配至每月1次(q1m)和按需给药(PRN)组,共0.5 mg q1m、0.5 mg PRN、2.0 mg q1m和2.0 mg PRN 4组。q1m组每个月给药1次,PRN组研究者根据每月访视后的评估结果决定是否需要重复给药,在第12个月末完成后进行最后评估。
治疗3个月后,0.5 mg和2.0 mg组BCVA提高了8.97±13.08和10.43±10.65个字母,中心视网膜厚度分别减少了83.69±139.43 µm和138.6±139.05 µm,改变具有统计学意义。12个月后,0.5 mg PRN、0.5 mg q1m、2.0 mg PRN和2.0 mg q1m受试者BCVA分别改善了14.31±17.07、9.31±10.98、12.42±16.39、15.43±14.70个字母,中心视网膜厚度分别降低了119.8±175.50 μm,129.7±170.80 μm,152.1±142.73 μm和170.8±160.43 μm,与基线相比均有改善。
1.3. HOPE试验
一项多中心、开放式、随机、不同给药剂量的临床试验,受试者随机入组后进入核心治疗阶段,目标眼玻璃体腔内注射康柏西普眼用注射液 0.5 mg或2.0 mg,每4周1次,连续3次治疗后,研究者根据每次评估结果决定是否需要重复给药。治疗52周后,0.5 mg和2.0 mg组最佳矫正视力(BCVA)平均提高15.11±17.10和16.44±17.42个字母,中心视网膜厚度分别减少214.61±179.86 μm和203.94±190.95 μm,与基线相比,改变均具有统计学意义。















