


近日,华人抗体协会与《药学进展》联合精心打造的抗体药专辑终于付梓出版了,协会公众号进行系列转载。这是全文转发这个专辑的第三篇文章,作者是上海
岸
迈
生物的吴辰冰博士。 前言部分由《药学进展》常务副主编郑晓南和编辑杨臻峥编辑撰写。

抗体药物是未来生物药的主力军,也是创新药研发的重中之重。FDA历年批准的原创新药中,抗体药物所占据的比例越来越高,越来越多的科学家也积极投入到这一研究领域:其受重视的程度可见一斑。近年来,围绕创新驱动国家战略,鼓励创新的政策密集出台,制度改革不断释放发展红利,中国创新药物研发,尤其是以抗体药物为主导的生物药研发将迎来新的时代。
2017年是抗体药物研发领域极其不平凡的一年。在这一年,专注于搭建治疗性抗体领域全球华人交流合作平台及中国抗体药走向世界桥梁的非营利专业协会——华人抗体协会正式成立并召开了第一次年会;也是在这一年,《药学进展》与华人抗体协会签署了战略合作协议。尽管相隔大洋两岸,未曾有过会晤,但多次的线上对话已让双方加深了对彼此的了解,也凝聚了在努力推进中国抗体药研发进程方面的共识,终于,这本历时半年精心酝酿和策划的抗体专刊在金秋十月如期出版。
此次致力于抗体专刊出版的专家来自军事医学科学院基础医学研究所、沈阳药科大学、上海岸迈生物科技有限公司、美国马萨诸塞大学医学院、SYL咨询公司、南京大学医学院附属鼓楼医院、加州大学洛杉矶分校、抗体工作室有限公司,他们在抗体专刊的选题策划、组稿、撰写直至最终出版的过程中不辞辛劳,付出了大量的时间和精力。《药学进展》特此向他们致以最诚挚的谢意!
抗体专刊的四篇综述,覆盖了抗体产业链从上游到下游的热点话题:美国马萨诸塞大学医学院内科系卢山教授介绍了DNA免疫技术在高质量单克隆抗体诱导开发中的应用进展;抗体工作室有限公司创始人刘跃博士介绍了治疗用单抗的人源化和优化;上海岸迈生物科技有限公司总裁吴辰冰博士综述了双特异性抗体技术及双特异性抗体在肿瘤治疗、炎症治疗和抗病毒治疗中的应用进展;“千人计划”专家、沈阳药科大学马宁宁教授担任此次抗体专刊的栏目主编,策划选题同时,以独到的视角聚焦抗体下游领域,阐述了抗体大规模生产中的反应器放大策略并给予了很好的建议,并邀请到军事医学科学院基础医学研究所沈倍奋院士为抗体专题点评(
抗体专辑|抗体药物研发四大看点:创新之路向何方?(Ⅰ)
)。
最后,特别感谢华人抗体协会创始人和会长王守业博士的鼎力支持以及他在促进双方合作中不遗余力的努力。抗体专刊既是华人抗体协会专家智慧的结晶,更是《药学进展》与华人抗体协会相知相识、携手助力抗体药物研发的最好见证!
在今天发布的文章中,吴辰冰博士将为我们重点介绍双特异性抗体技术的研究和应用进展。欢迎阅读、讨论!
(文:郑晓南,杨臻峥)

吴辰冰:博士,上海岸迈生物科技有限公司总裁。吴博士从美国佐治亚大学生物化学系获得生物化学与分子生物学博士学位后,进入美国哈佛医学院进行博士后研究,获得美国癌症研究中心的研究基金,主要从事分子免疫学的研究,在揭示X-连锁淋巴组织增生性疾病(x-linked lymphoproliferative disease,XLP)的机制方面有重要突破。后来进入雅培制药公司生物研究中心,从事治疗性抗体的研究与开发十多年,带领多个项目从早期研究开始成功进入到临床申报。同时,吴博士还带领团队开发出新一代的双特异性抗体平台技术“DVD-Ig”,并获得专利授权,目前已有5 种由该技术开发出来的新型抗体进入临床Ⅱ期研究。 2010 年吴博士加入上海睿智化学研究有限公司,建立了一个全方位的治疗性抗体研发平台,并借此与国内外生物医药企业广泛合作,成功地开发出一些有影响力的创新抗体药物。吴博士于2013 年加盟上海中信国健药业股份有限公司,担任首席科学官兼研究院院长,主要致力于完善研发梯队,建立技术平台,充实研发管线,制定研发策略。2016年5月吴博士开始担任上海岸迈生物科技有限公司总裁,主要进行新一代生物大分子的技术开发及产品研发,旨在建立一个创新型国际化的生物医药企业。吴博士长期从事分子免疫及抗体药物研究工作,以第一作者身份在
Nature Immunology
和
Nature Biotechnology
等国际一流学术刊物上发表多篇论文,并有多项国际专利授权和50多项国际专利申请。
双特异性抗体技术及其临床应用进展
吴丹青,吴辰冰
*
(上海岸迈生物科技有限公司,上海 201203)
[ 摘要]
与单克隆抗体不同,双特异性抗体具有同时靶向2 个不同表位的能力,并能起到特殊的生物学功能,例如免疫细胞召集、受体共刺激或共抑制、多价病毒中和等。新颖的抗体结构设计较好地解决了早期双特异性抗体技术面临的一些技术难点。随着第1 个双特异性抗体药物Blincyto 被FDA 批准上市,越来越多的双特异性抗体药物进入了研发管线。文章综述了重组双特异性抗体技术及其在肿瘤、炎症和抗病毒等方面的临床应用进展。
自从第1 个单克隆抗体药物Orthoclone OKT3 获批上市以来,已有为数众多的单克隆抗体药物在不同的治疗领域显示出了卓越的疗效。单克隆抗体主要通过结合一个特定的表位,起到一定的生物学功能,诸如阻断蛋白相互作用,激活或调节受体功能。抗体的Fc 片段还能起到诱导抗体依赖细胞介导的细胞毒作用(antibody-dependent cell mediated cytotoxicity,ADCC)或补体依赖的细胞毒作用(complement-dependentcytotoxicity,CDC)效果。构建双特异性抗体,同时靶向2 个不同表位的概念起源于20世纪80 年代。当时的研究者主要通过化学反应联接,或杂交瘤二次融合等技术手段得到双特异性抗体。20 世纪90 年代,Coloma等使用基因工程技术构建了第1 个IgG 和单链抗体(scFv)的融合蛋白,从而实现了单个分子的双特异性结合能力。从此基因工程成为了主流的构建双特异性抗体的技术平台。
根据不同的组成部分以及构建方式,双特异性抗体可以分为许多种类(见图1)。例如,根据结构左右对称性分为对称结构和不对称结构,根据IgG 分子完整性分为类完整抗体和类抗体片段,以及根据抗原结合区域的数量构型分为两价、三价、四价或更多价的构型等。不同的双特异性抗体设计各有利弊,但是以临床治疗为目的的双特异性抗体设计都要解决同样的问题:第一,保证两对(或以上)不同轻链与重链的正确偶合或配对;第二,保持每个单克隆抗体各自结合域的独立性,同时结合不同表位的时候互相之间不会产生空间位阻的干扰;第三,抗体分子要易于用哺乳动物细胞进行表达,不需要复杂的蛋白修饰工艺,有较好的成药性。长久以来,保证轻链和重链的正确偶合一直是双特异性抗体构建的一个关键点。由于抗体轻链和重链之间是通过恒定区配对结合的,不同抗体的轻重链在一起表达的时候会产生错配。早期的双特异性抗体通过串联2个scFv 的方式,可以较容易地得到没有轻链错配问题的双特异性抗体,例如Mircomet 公司开发的BispecificT cells Engager (BiTE)结构,Microgenics 公司开发的Dual Affnity Re-Targeting (DART)结构等。但是这些由抗体可变区片段构成的分子经常会有不稳定、表达量低,或者体内半衰期过短等问题,比较难应用于药物开发。也有研究者在完整的IgG 结构上使用公共轻链(往往是没有结合活性的)来规避这个问题,或者各选用一个kappa 和lambda 亚型的轻链,然后再通过后期亲和纯化的方式得到配对正确的双特异性抗体分子。但是这2 种方案都有很大的局限性,没有广泛使用的价值。罗氏公司开发的CrossMab 结构通过在轻重链间交换其中一个抗体的CH1 和CL 片段,并结合Knob-in-hole技术从而实现了2 个单价抗体分子的非对称式组合。Abbvie 公司的DVD-Ig 技术通过将其中一个抗体可变区片段的VH 和VL 分别与另一个完整抗体的VH 和VL 的N 端通过肽链直接连接,从而实现了2 个双价抗体的对称式组合。Genmab 公司的Duobody技术则利用了IgG4 的Fab 片段交换技术(Fab arm exchange)的特性,将2 个单克隆抗体先各自表达,然后再通过后期处理的方式实现双特异性抗体的有效组合。
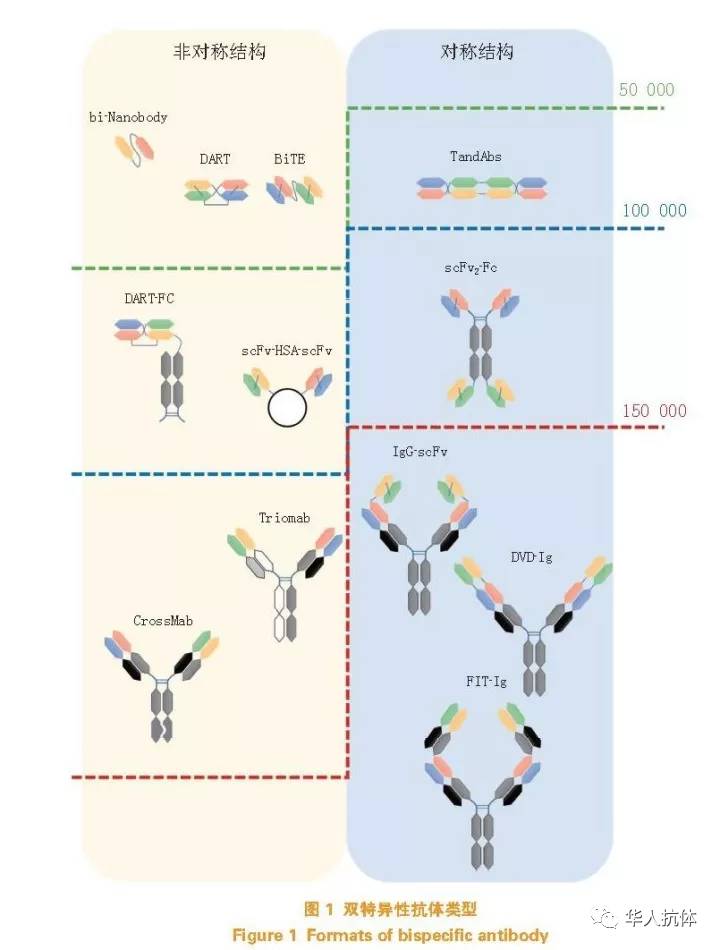
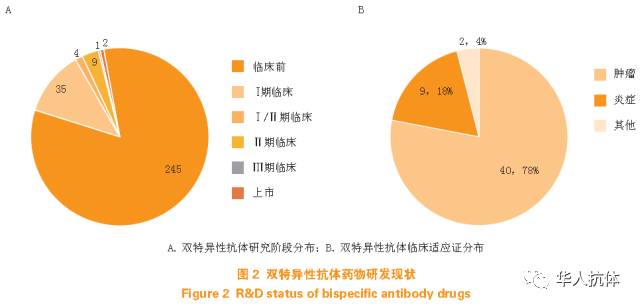
根据双特异性抗体能够同时结合2 个不同靶点的特性,研究者可以设计出独特的双特异性抗体分子,从而实现单克隆抗体往往无法实现的生物学功能。其临床应用价值也早已被众多的研究机构和制药企业所重视。自从第1 个在欧洲获批上市的双特异性抗体catumaxomab(Removab)和第1 个在美国获批上市的blinatumomab(Blincyto)问世以来,有数十个双特异性抗体正在进行临床开发,有更多的双特异性抗体分子正处在临床前研究阶段,且大部分已经进入临床阶段的双特异性抗体都应用在肿瘤治疗领域(见图2)。越来越多创新的双特异性抗体分子结构正不断地被设计和制造出来,以期能实现更好的生物学功能和更适于药物开发的理化特性。
2.1 免疫细胞衔接器
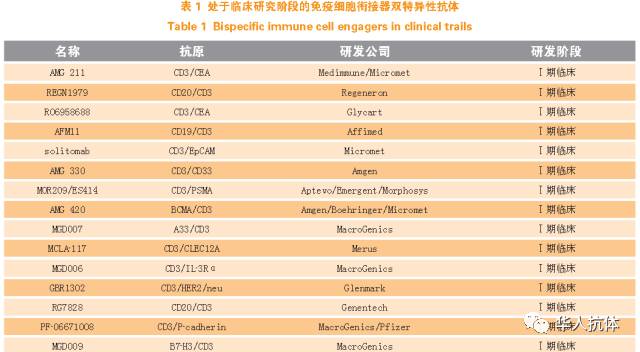
免疫细胞衔接器是一种特殊的双特异性抗体分子,通过同时靶向肿瘤和免疫细胞来达到召集免疫细胞清除肿瘤细胞的目的。目前已经批准上市的2 个双特异性抗体产品都属于这个类别,Trion Pharma公司开发的catumaxomab 能够靶向肿瘤表面抗原EpCAM 和T 细胞表面受体CD3,而Micromet 公司和Amgen 公司开发的blinatumomab 可以同时结合CD19 和CD3。两者都是通过激活并召集杀伤性T 细胞,从而达到治疗肿瘤的目的。Catumaxomab 属于Triomab 技术平台,由一个靶向肿瘤的小鼠IgG2a 和一个靶向人CD3ε 的大鼠IgG2b构成,同时还能通过Fcγ 受体激活单核细胞、巨噬细胞、星状细胞以及NK 细胞,从而实现“三功能”抗体活性。由于小鼠和大鼠的轻重链之间很少发生错配,通过quadroma(hybrid-hybridoma)的方式,将分别表达小鼠和大鼠抗体的杂交瘤进行二次融合,从而得到同时分泌Triomab 双特异性抗体以及小鼠和大鼠单克隆抗体的杂交瘤细胞株。然后再通过亲和纯化的方式,分别去除小鼠和大鼠单克隆抗体。虽然catumaxomab 是第1 个批准上市的双特异性抗体,但同时也具有非常明显的局限性,主要体现在Triomab 抗体复杂的生产工艺以及异源抗体比较容易产生的免疫原性问题。Micromet公司(后被Amgen 公司收购)开发的blinatumomab 是一种基于BiTE 技术的双特异性抗体,由2 个只含有可变区的scFv 通过多肽连接而成。与Triomab 抗体不同,BiTE 抗体可以通过重组中国仓鼠卵巢(CHO)细胞进行大规模培养生产,并且BiTE 抗体只含有2 个结合域,一个高亲和力地靶向癌细胞表面抗原(例如CD19),另一个以较低亲和力靶向CD3。临床试验已经证明了blinatumomab 即便在很低的使用剂量下,依然可以有效地召集T 细胞并清除肿瘤细胞。但是由于没有Fc片段,BiTE 抗体分子的体内半衰期很短,实际使用的时候需要额外配备连续输液装置。除了这2 个已经有产品成功获批上市的公司以外,其他大部分的免疫细胞衔接器双特异性抗体都还处于Ⅰ期临床阶段甚至更早。表1 列举了目前正处于Ⅰ期临床阶段的免疫细胞衔接器。例如Macrogenics 公司开发的DART 抗体,其双特异性抗体分子是由2 个单链抗体交叉串联构成的。具体来说,第1 个抗体的VH 片段和第2 个抗体的VL 片段连接,第2 个抗体的VH 片段和第1 个抗体的VL 片段连接。两段交叉的单链抗体通过二硫键共价偶联形成稳定的单一分子。目前靶向CD123/CD3、gpA33/CD3、CD19/CD3 以及B7-H3/CD3 的DART 抗体都已经进入了Ⅰ期临床试验。
除了召集T 细胞以外,还有一类召集NK 细胞的免疫衔接器抗体。Affimed 公司基于RECRUIT-TandAbs 技术开发了靶向NK 细胞表面CD16A 抗原和肿瘤表面抗原CD30 的衔接器抗体AFM13,并已经进入治疗霍奇金淋巴瘤(hodgkin lymphoma,HL)的Ⅱ期临床试验。RECRUIT-TandAbs 抗体是由2条双特异性单链抗体通过非共价偶联形成的。每条单链抗体都是由2 个不同单克隆抗体的可变区(VH和VL)通过3 条长度相等的肽链串联而成。与BiTE 和DART 抗体类似,由于缺少Fc 片段,RECRUIT-TandAbs 的体内半衰期也比较短。目前除了召集NK 细胞的AFM13,还有召集T 细胞的AFM11(CD19/CD3)进入了治疗非霍奇金淋巴瘤(nonhodgkinlymphoma,NHL)和急性淋巴细胞白血病(acutelymphoblastic leukemia,ALL)的Ⅰ期临床试验阶段。
大多数的T 细胞免疫衔接器分子都是单价的,目的是为了避免抗体分子在没有结合肿瘤之前就通过CD3 交联从而激活T 细胞。MorphoSys 公司开发了一个特殊的双价T 细胞免疫衔接器MOR209/ES414。这个双特异性抗体分子是由分别结合前列腺癌标志物PSMA 和T 细胞受体分子CD3 的2 个单链抗体通过人IgG1 Fc 片段连接组合而成的。体外T 细胞增殖和细胞因子分泌实验证明,虽然这是一个两价的抗体分子,但是其必须要在有表达PSMA 抗原的细胞同时存在的情况下,才会激活T 细胞。在小鼠肿瘤移植模型中,MOR209/ES414 能够显著抑制肿瘤生长,并大大提高了存活率。
2.2 免疫哨卡抑制剂
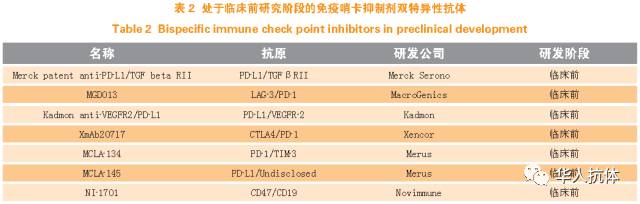
近年来随着几个突破性的免疫哨卡抑制剂单克隆抗体的临床应用并成功获批上市,肿瘤免疫领域的研究可谓蒸蒸日上。基于不同的免疫哨卡分子之间机制的互补性,研究者提出结合2 个免疫哨卡单克隆抗体进行组合治疗,并已经开展了大量的临床试验。临床前动物实验已经证明了单独使用CTLA-4或者PD-1 阻断抗体可能会上调另一个未阻断的信号通路,并因此抑制了T细胞活性。联合阻断PD-1 和CTLA-4 在小鼠肿瘤模型上显示了更好的肿瘤治疗效果。针对黑色素瘤的一个Ⅱ期临床试验也证实,相对于单独使用抗CTLA-4 单克隆抗体ipilimumab,联合抗PD-1 单克隆抗体nivolumab可以提高客观应答率以及无进展生存期,但是相应的自体免疫副作用也显著加强。与单克隆抗体组合治疗相比,使用双特异性抗体药物进行治疗可能有其优势。一方面双特异性抗体通过1 个分子结合2 个不同的抗原,有可能起到更好的协同效应。例如Macrogenics 公司基于DART平台开发的靶向PD-1 和LAG-3 的双特异性抗体,其在临床前体外T 细胞增殖实验中甚至表现出了优于单克隆抗体组合的生物学活性。另一方面,双特异性抗体可以通过调节针对某一个靶点的亲和力,从而更好地靶向肿瘤组织。例如Novimmune 公司开发的靶向CD47和CD19 双特异性抗体,采用了一个高亲和力的CD19抗体和低亲和力的CD47 抗体,通过CD19 的肿瘤特异性结合(靶向B 淋巴细胞瘤),从而极大地降低了由于CD47广泛表达而引起的与非肿瘤组织的特异性结合。类似的还有斯坦福大学Piccione等报道的靶向CD47和CD20 的双特异性抗体。目前所有的免疫哨卡抑制剂双特异性抗体都处于临床前研究阶段(见表2)。
2.3 酪氨酸激酶受体和血管生成因子抑制剂
酪氨酸激酶受体ErbB 家族蛋白是肿瘤治疗的重要靶点。抗EGFR 和HER2 单克隆抗体,如panitumumab和trastuzumab 可以通过阻断酪氨酸激酶活性,促进膜蛋白受体内吞以及召集免疫细胞等作用机制抑制肿瘤生长。但是临床研究发现这2 个靶点的靶向治疗都有不同程度的耐药问题。针对结肠癌的EGFR 单克隆抗体治疗中发现,EGFR 突变或者cMET 扩增会导致耐药。研究者于是转而研究同时靶向EGFR 和cMET的双特异性抗体疗法,希望通过同时阻断2 个受体来起到避免EGFR 耐药的作用。Janssen Biotech 公司的JNJ-61186372 是由1 个靶向EGFR 胞外配体结合域的单克隆抗体zalutumumab 和另一个靶向cMET 胞外HGF 配体结合域的单克隆抗体,通过GenMab 公司开发的可控Fab 片段交换技术(controlled Fab-arm exchange,cFAE) 构建成的双特异性抗体。JNJ-61186372 不仅与已经上市的cetuximab 和panitumumab 有不同的抗EGFR 表位,并且Fc 片段还通过降低核心岩藻糖技术增强了ADCC 效果,在对厄洛替尼(小分子EGFR 酪氨酸激酶抑制剂)耐药的非小细胞肺癌(NSCLC)动物模型上体现了明显的肿瘤抑制效果。
对HER2 单克隆抗体trastuzumab 的临床研究也发现了许多不同的耐药机制,例如在trastuzumab 结合的情况下,HER2 仍能与HER3 或EGFR 蛋白形成异二聚体从而激活下游信号通路,另外肿瘤表面的一种膜蛋白MUC4可能会阻碍trastuzumab 与HER2 蛋白的结合等。基于这些研究,Medimmune 公司开发了一个特殊的HER2 双特异性抗体MEDI4276。这个双特异性抗体由一个trastuzumab 的单链抗体和另一个靶向HER2 不同表位的单克隆抗体39S 构成。39S 能够阻断HER2 与HER3 形成异二聚体,从而降低HER3 的激活和上调以及由此引起的trastuzumab 耐药问题。MEDI4276 已经进入了治疗乳腺癌的Ⅰ期临床研究阶段。Merrimack公司设计了一种同时靶向HER2 和HER3 的双特异性抗体MM-111,由2 个单链抗体通过人血清白蛋白(HAS)连接构成。MM-111 可以同时阻断HER2/3 的酪氨酸激酶活性,其在临床前乳腺癌动物模型中显示了一定的应用价值。
抗血管生成是另一种抑制肿瘤的方式。VEGF 单克隆抗体bevacizumab 通过抑制肿瘤内新生血管从而起到抑制肿瘤的作用,但在一些肿瘤例如胶质母细胞瘤中治疗效果不佳。在小鼠胶质母细胞瘤模型的研究中发现,Angiopoietin-2(Ang-2)蛋白可能是一个导致VEGF 单克隆抗体耐药的关键蛋白。一种同时靶向小鼠Ang-2 和VEGF 的双特异性抗体A2V 在小鼠胶质母细胞瘤模型试验中能够延长总生存期。罗氏公司据此开发了一种靶向人Ang-2 和VEGF 的双特异性抗体vanucizumab 。在2012 年,vanucizumab 成为了第1 批进入临床研究的异源二聚体双特异性抗体,并在2014 年进入了治疗结肠癌的Ⅱ期临床试验。此外,国内的第二军医大学报道了2 种同时靶向EGFR、HER2、HER3 和VEGF 的四价抗体FL518 和CRTB6,并在多个肿瘤动物模型中显示出优于单克隆抗体乃至双特异性抗体的肿瘤抑制效果。
炎症的致病机制十分复杂,通常和许多促炎症细胞因子密切相关。对甲氨蝶呤治疗类风湿性关节炎无效的病人,现在临床可以采用TNFα 单克隆抗体治疗。但是越来越多的临床前研究和临床证据表明单纯阻断TNFα 信号通路的作用是非常有限的。在胶原蛋白诱导的DBA/1 小鼠类风湿关节炎模型里,合用2 种中和单克隆抗体同时阻断IL-1α 和IL-1β 体现了更好的治疗效果。由于IL-1α 和IL-1β 的蛋白序列相似度仅有20% 左右,用一个单克隆抗体同时靶向两者显然是不可行的。另外,靶向两者的受体IL-1R 的AMG-108单克隆抗体也并不成功。Abbie 公司利用DVD-Ig 技术开发了靶向IL-1α 和IL-1β 的双特异性抗体,在小鼠骨关节炎模型中体现出了比IL-1α 或IL-1β 单克隆抗体更好的治疗效果。其人源化后的双特异性抗体分子ABT-981 正处于治疗骨关节炎的Ⅱ期临床研究阶段。
除IL-1 之外,其他适用于抗体治疗的细胞因子还包括IL-4、IL-13、IL-17 以及IL-23 等。IL-4 和IL-13是与二型炎症密切相关的细胞因子,两者共享了一个异二聚体受体IL-4Rα/IL13Rα1,但是又各自另有一个完全不同的受体,而且两者有不同的致病机制。赛诺菲开发的IL-4/IL-13 双特异性抗体SAR156597 目前正处于治疗弥漫性系统性硬化症和特发性肺纤维化的Ⅱ期临床阶段。IL-17 是另一个非常重要的炎症细胞因子,不仅能促进其他炎症因子,如TNFα、IL-1β、GMCSF 的分泌,而且与许多炎症因子能产生协同效应,导致IL-6 和IL-8 等炎症介质大量产生。联用低剂量的IL-17 与TNFα 拮抗剂在小鼠类风湿模型中显示出非常明显的抗炎症效果。目前,Abbvie 公司开发的同时靶向TNFα 和IL-17A的DVD-Ig 双特异性抗体分子ABT-122 正处于Ⅱ期临床研究阶段。Covagen 公司开发的COVA322 是另一个已经进入临床研究阶段的TNFα/IL-17A 双特异性抗体分子,由一个抗IL-17A 的Fynomer 和抗TNFα的单克隆抗体adalimumab 构成。
可以阻断病毒入侵细胞,乃至中和病毒感染的广谱抗体一直是抗病毒领域的一个重要研究方向。从感染者体内分离得到的广谱抗HIV 单克隆抗体是HIV 治疗领域的一个重要突破,但是进一步的研究也发现单克隆抗体治疗无法很好地解决HIV 病毒的免疫逃离问题。解决这个问题的出路可能在于使用单克隆抗体组合疗法或者构建双/ 多特异性抗体。Asokan 等利用CrossMab 技术将4 个针对HIV 衣壳蛋白重要中和靶点(CD4bs 、V3-glycan、V1V2-glycan 以及MPER)的单克隆抗体分别研制成双特异性抗体。体外病毒中和实验表明,双特异性抗体体现出比单克隆抗体更广谱的中和能力,但是与单克隆抗体组合相比并没有明显的优势。Bournazos 等设计了一种新颖的双特异性HIV 中和抗体,与Asokan 等构建的IgG1 抗体不同,他们使用了重链铰链区经改造的IgG3 亚型。体外中和实验证明,抗体的中和能力与重链恒定区结构密切相关,IgG1 亚型的双特异性抗体没有显示出优于单克隆抗体的中和能力,而改造后的IgG3 亚型双特异性抗体则体现出明显提高的中和能力。研究者推测这可能与HIV 衣壳蛋白的三聚体结构有关,经改造的IgG3 增加了2 个抗体结合域之间的距离和各自的灵活度,可能从空间上加强了与表位的结合能力。其中的一个双特异性抗体3BNC117/PGT135 甚至体现出了优于2 个单克隆抗体组合的中和能力,人源化小鼠体内实验也证明了这种改进重链的双特异性抗体有优于单克隆抗体组合的抗病毒活性。无独有偶,Huang 等几乎同时报道了另一种双特异性的HIV 中和抗体。他们使用了5种靶向HIV 衣壳蛋白的广谱中和单克隆抗体与2 种靶向HIV 受体蛋白(CD4/CCR5)的单克隆抗体,基于CrossMab 技术构建了一系列的双特异性抗体。经体外病毒中和筛选实验,有2 个双特异性抗体(10E8/P140和10E8/iMab)体现出比单克隆抗体组合更有效的中和能力。随后的人源化小鼠体内实验也证明,经基因工程优化的10E8v2.0/iMab 单克隆抗体有着显著的HIV 病毒中和能力以及预防能力。

















