伴随着网络上沸腾的质疑声,终于,在今天(7月22日)下午,长生生物道歉了。
长生生物回复深交所称,目前,公司百白破生产车间已经停产,公司正积极研究百白破组份疫苗以及以此为基础的多联疫苗。对于此次事件的发生,公司感到十分的自责和愧疚,再次向各位接种者和投资者表示深深的歉意。公司将引以为戒,举一反三,制定切实可行的纠正措施,进行彻底整改,确保生产的合规性、真实性、可靠性、可追溯性以及疫苗质量的安全性。
《中国经营报》报道,对于接种过问题批次百白破疫苗该如何进行下一步处理,长生生物销售总监杨鸣雯称,问题疫苗流向的山东省已经出台了补种方案,即将陆续实行。据了解,补种的疫苗可能从长春长生之外的其他厂家采购。其称,该工作由省疾控中心免疫预防管理所负责,家长可到当地接种点咨询,无需额外支付补种费用。
下午7点,国家药监局对长生生物的疫苗问题作出了通报。据央视新闻报道,国家药监局负责人表示,
现已查明,企业编造生产记录和产品检验记录,随意变更工艺参数和设备。上述行为严重违反了《中华人民共和国药品管理法》《药品生产质量管理规范》有关规定,国家药监局已责令企业停止生产,收回药品GMP证书,召回尚未使用的狂犬病疫苗。国家药监局会同吉林省局已对企业立案调查,涉嫌犯罪的移送公安机关追究刑事责任。
药监局已部署全国疫苗生产企业进行自查,确保企业按批准的工艺组织生产,严格遵守GMP生产规范,所有生产检验过程数据要真实、完整、可靠,可以追溯。国家药监局将组织对所有疫苗生产企业进行飞行检查,对违反法律法规规定的行为要严肃查处。
疫苗问题刷屏,所有人神经再次被刺痛,对企业经营者的良知、有关部门的监管提出质疑。
今天下午,央视财经发表的评论文章,抛出了一连串问题,每一个问题,都直击痛处:
我们不禁要问:问题疫苗企业的拥有者、管理者,你们的责任感到哪里去了?你们也是父母,也是社会肌体的组成部分,你们的良知到哪里去了?
我们不禁要问:越来越强的监管之下为何还有“漏网之鱼”?作为行业主管部门和监管机构,是做好市场规则和社会秩序的维护者,还是资本暴利的助推手?疫苗事件发生后,吉林食药监局的调查用了九个月,九个月后的判罚是罚款344万元。这种一罚了之的监管,究竟作用几何?
我们不禁要问:一个覆盖面如此广泛、影响如此剧烈的事件,为什么有关部门的回应总是那么含糊其辞、讳莫如深?这背后,是懒政怠政不作为?或是另有难言之隐?
我们不禁要问:食品药品安全,是基本目标,是最低标准,法律不可谓不繁,中央要求不可谓不严,可到底是怎么落实的呢?执法部门执行到位了吗?问题疫苗的出现,这到底是部门不作为、难作为,还是懒作为?是部门利益在抵挡和消减中央精神,还是企业财大气粗,法力无边?
毁掉民众对于疫苗的信任非常容易,但要再次唤起民众的信心却需要漫长的努力。63年前美国那场疫苗丑闻的惨痛教训,以及在此基础上建立的全球最严格的疫苗监管机制,值得我们认真去理解。
1955年,美国中西部五个州的约20万名儿童接种了脊髓灰质炎疫苗,随后发生了多起接种疫苗的儿童瘫痪事件。调查最终追溯到这些疫苗的生产商,位于加州伯克利的一家家族医药企业Cutter Laboratories,因疫苗未能有效灭活病毒,共造成4万名儿童患上脊髓灰质炎,200名儿童患不同程度的瘫痪,以及10名儿童死亡。

▲时任美国卫生部秘书长Hobby
这起美国医学史上最严重的一起疫苗事件,被称为“卡特事件”(“Cutter Incident”),美国民众对于疫苗的信任度一度降至冰点。
该事件让一位名叫Paul Offit的儿科医生沮丧万分,他是疫苗的积极推动者,坚定认为疫苗接种注射能够有效防止疾患的发生。在他看来,脊髓灰质炎的危害堪比原子弹,在Karl Landsteiner早1908年第一次发现脊髓灰质炎病毒后不到10年,纽约爆发了严重疫情,2400人丧生(绝大多数为儿童),成千上万名儿童留下终生残疾,到了50年代的夏天,疫情在美国再度爆发,同样让成千上万家庭遭遇悲剧。
成千上万的诉讼接踵而至,“承担无过错的责任”是1958年美国法院对Cutter Laboratories的最终判决,在Paul Offit看来,该判决的含义是:该医药公司在没有过错的情况下,依然要承担后果,即便它们在疫苗研发制造过程中使用的是当时最好的医学标准。
“卡特事件”给整个美国的疫苗市场,带来了让人始料未及的影响。由于法院“无过错责任”的判罚,医药公司开始重新审视研制疫苗的商业合理性,毕竟,疫苗的研发周期长,需要经历多轮临床试验,过程中受到严格监管,最后流向市场后,还不时要担心面临法律诉讼的巨额罚款,研制疫苗对医药公司来说,已经成了一桩“吃力不讨好”的生意。结果,在接下来的近30年中,疫苗一度濒临成为首个在美国医疗市场上“灭绝”的产品。
在终于意识到问题的严重性后,美国政府开始从立法层面帮助建立一套能够同时保护疫苗生产方和消费方的机制,帮助该市场健康有序发展。
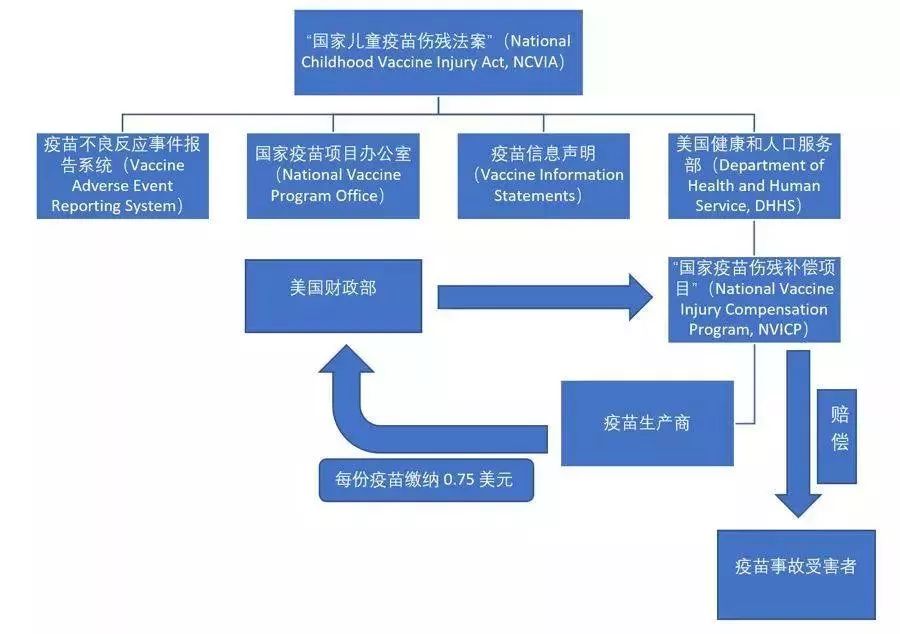
1986年,时任美国总统的罗纳德·里根签署了“国家儿童疫苗伤残法案”(NationalChildhood Vaccine Injury Act, NCVIA)。
该法案的主体包含三个部分:一是疫苗不良反应事件报告系统(Vaccine Adverse Event Reporting System),要求所有医疗服务机构通过该系统回报所有因疫苗使用造成的不良反应事件。
二是疫苗信息声明(Vaccine Information Statements)。法案要求所有医疗服务提供机构在提供疫苗服务之前,都要向疫苗接种者、接种者父母或监护人,出示疫苗信息声明,披露疫苗的名称,对病毒的简要介绍,以及疫苗的好处和潜在风险。每一分疫苗信息声明都由疾控中心出具,并向州、地方医疗监管机构及医疗服务机构发放。
三是建立国家疫苗项目办公室(National Vaccine Program Office),该办公室设立在美国健康和人口服务部(Departmentof Health and Human Service, DHHS)之下,该办公室负责协调所有与防疫活动相关的医疗机构,包括疾控中心(CDC)、食品和药物管理局(FDA)、国家医疗机构(National Institutes of Health)以及医疗资源和服务局(HealthResources and Services Administration)。
美国疫苗市场法律监管制度简要框架图
具体来说,NVICP类似于一个补偿基金,通过对每一剂的疫苗收取0.75美元的税,由美国财政部向疫苗生产商收取。该项目覆盖的疫苗包括大多数针对儿童的常规疫苗以及部分成人用疫苗。
NVICP机制流程如下:当被项目覆盖的疫苗造成的伤残事件发生后,起诉人不能直接向疫苗生产商发起诉讼,而是需要首先向联邦法院提交诉讼,随后,如果被美国司法部认定诉讼成立,将给予相应赔偿,赔偿金从NVICP从支取。起诉人只有在诉讼不成立或者对赔偿方案不满意的情况下,才能再向疫苗生产商提起民事诉讼。
NVICP每月都会通过美国医疗资源和服务局(HealthResources and Services Administration)出具报告,详细披露疫苗相关情况,包括项目内各种疫苗的流通数量,每种疫苗受到的诉讼数量信息。
根据数据显示,自1988年成立至2017年,NVICP项目共收到17281个诉讼案件,其中6085件被认定为应提供赔偿,11196件被撤销,赔偿总金额为39亿美元。
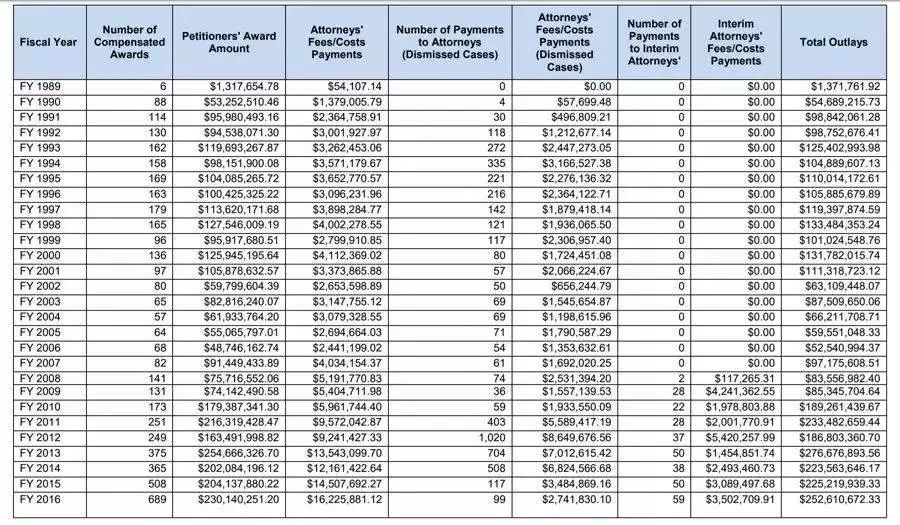
NVICP披露的自1988年成立以来所有赔偿的疫苗相关的案件数量及金额,来源:美国医疗资源和服务局(Health Resources and Services Administration)官网
对于疫苗的生产和流通流程中的监管,监管主体主要是美国食品和药物管理局(FDA),分为事前监管(Pre-Licensure)和事后监管(Post-Licensing)。
首先,所有从事疫苗生产的医药公司,都需要首先获得FDA颁发的特许资质。
在获得资质之前,医学研究人员首先需要通过电脑模拟和预测疫苗如何与人类的免疫系统相互作用,然后研究人员进行疫苗的动物实验。
在所有这些实验室内经历的试验成功后,FDA批准其用于人体临床试验,参与者完全自愿。在他们参与之前,将被充分告知试验的目的以及潜在风险。
FDA要求疫苗通过三个阶段的临床试验,第一阶段包含20至100名自愿者,过程约为几个月,用于评估基本的安全以及通常反应。
第二阶段包含几百名自愿者,持续约几个月至2年,过程中将收集安全和功效信息,上述两个阶段收集的数据将用于决定疫苗的成分、剂量以及部分药物反应等。
在确认并非无效或会造成健康问题后,试验进入第三阶段,包含几百至上千自愿者,通常持续几年,研究人员将对注射疫苗和未注射疫苗人群的反应进行比对,以确认疫苗的功效和对人体反应。
当所有这些试验均表明疫苗是安全有效的情况下,疫苗生产商可以向FDA提交牌照申请:包含疫苗产品牌照和生产基地牌照。在审核申请过程中,FDA将评估之前的临床试验数据,还要付生产实地检查生产流程是否符合疫苗生产安全标准。只有在上述所有过程均通过FDA的审核后,医药公司才能获得生产面向大众的疫苗的相应资质。获得FDA疫苗生产资质的过程漫长,通常需要10年甚至更久时间。
在获得执照之后,进入
监管过程,FDA要求所有生产商在每一批疫苗流通上市前,提交一份样品。此外,生厂商还需要向FDA提供疫苗测试的安全、效力和纯度结果。
FDA要求每一批上市流通的疫苗都要抽样重新测试的理由是因为疫苗对于环境因素,例如温度条件十分敏感,并且在生产过程中可能遭遇污染。
从历史记录看,FDA极少因为贴错标签、生产过程中受污染或生产流程缺陷等问题召回流通后的疫苗。
此外,由于此前临床实验数据仅针对相对小规模的人群
进行,而很多罕见的反应只有在运用到更大规模人群
后才会显现,因而FDA建立了监测机制对流通后的疫苗不良反应进行实时监控,就是前文所提到的疫苗不良反应事件报告系统
。此外,还建立了用于研究罕见不良反应的大规模互相关联的包含数百万人信息的数据库。
美国的NVICP已经实施近30年,我国在疫苗赔偿领域却还没有相应的法律规范,NVICP国家赔偿机制以及“无过错”原则对于我国以后制定相关法律,相信会很有借鉴意义。





