
写在前面
本篇于
2013
年发表于
Ecology Letters
。题目中的“
20
年”是相对于
1992
年而言。
1989
年,
Simon Levin
在
MacArthur
奖的颁奖典礼上,做了题为
On the problem of pattern and scale in ecology
的演讲,
1992
年,
Ecology
刊登了该篇演讲的全文。
Jérôme Chave
梳理了
20
年间的进展,并撰写了综述。
文章编译
引言
在引言部分,作者首先介绍了本文的写作动机,即,相对于
1992
年的致辞而作。继而,总结了
20
年来生态学所见证、并对生态学产生重要影响的四大科技革命。首先,随着数字时代的到来,计算机的运算能力显著提高。其次是,生物化学的发展。尤其是
PCR
技术和高通量测序技术的引入,显著革新了生态学的研究。现在我们熟知的分子生态学的顶刊,
Molecular Ecology
,就是创办于
1992
年。第三项革命则与环境感测相关。环境感测与监测技术的发展,为人类重新审视地球生态系统提供了新的工具。第四,现在人类具备了在全球尺度上传播信息与知识的能力,这使得更广阔范围内的通力合作成为可能。
相应地,生态学关注的主要命题也发生了巨大改变,而这背后的主要驱动力则是全球环境变化。比如,全球人口增长
25%
的同时,
CO2
的排放量增加了
40%
。现在人类面临的重要挑战就是,如何理解生态系统动力学在不同尺度的转化,以及生命支持系统对环境变化的响应。而解决问题的核心在于,解析全球尺度的环境变化如何影响个体,并对种群产生选择压力,进而导致遗传、表型和物种多样性的改变。所以,本质问题在于,如何桥联不同的空间尺度——从
1
立方米的海洋或
1
平方米的陆地,到全球尺度。另外一个相关问题是,有机体与环境的互作也具有显著的尺度依赖性。最简单的理解就是,不同生物的体型大小存在巨大变异。通过扩散与休眠,生物体也经历着不同时间和空间尺度的洗礼。
基于上述背景,本综述主要关注与格局和尺度相关的四个命题。第一,综述了耦联生态与演化尺度的新方法。第二,介绍了生态系统科学相关的研究进展。第三,总结了有机体研究的前沿进展,尤其是系统生物学与生态学的融合。第四,回顾经典主题:生态学里的空间格局。
1.
生态与演化尺度的耦联
Coupling ecological and evolutionary scales
传统研究往往认为生态学过程发生在较小的时间尺度,而演化过程则发生在较的的时间尺度,因此,这两个过程是不相干的。而近
20
年的研究则不断刷新人类的认知,越来越多的研究开始关注和探索生态尺度与演化尺度的耦联。
作者首先综述了演化的步调(
pace of evolution
),即,演化对种群动力学究竟有多大影响?
Yoshida(2003)
等人以萼花臂尾轮虫(
Brachionus calyciflorus
)觅食小球藻(
Chlorella vulgaris
)的体系为研究对象,发现藻类是否具有演化潜力将显著影响藻类
-
轮虫互作关系的振荡周期与相位。如图
1
所示,当藻类由多克隆组成时,互作周期明显变长。单克隆食物的情况下,实验结束时,藻类和轮虫都会消失。而在多克隆食物的情况下,实验结束时,轮虫消失,藻类占据绝对优势。这可能是因为,适口度低的食物,在系统中持续维持;而适口度高的食物,在轮虫崩溃后,占据了绝对优势。

图
1.
恒化系统内轮虫觅食单克隆藻类(
a
)和多克隆藻类(
b
)的实验结果。
继而介绍了
Grant
夫妇在野外观察和研究达尔文雀(
Darwin’s finch,
Geospiza fortis
)的经典案例,以证明生态与演化动力学如何在短时间内协同作用。并介绍了后续学者如何通过计算,将生态效应与演化效应对达尔文雀表型变异的塑造作用拆分出来。计算结果发现,
1976-1990
年间,达尔文雀体型和喙的大小变化过程中,演化变异的速率比生态过程变化速率的高出两倍。
环境过程固然会影响物种演化,反过来,物种演化也会影响生态系统动力学。作者给出了以孔雀鱼(
guppy,
Poecilita reticulata
)为对象的经典研究。长期暴露于捕食作用的风险,驱使孔雀鱼性成熟提前、体型变小、后代变多且变小。孔雀鱼的食物可利用度则随环境而改变,例如林冠盖度小将有利于一种大型藻类的生长,从而为孔雀鱼提供更多食物。
Palkovacs (2009)
等人通过微宇宙实验,研究了孔雀鱼面临的捕食风险的高低,如何定量影响其所处生态系统的结构与功能。结果表明,孔雀鱼表型的变异确实会影响生态系统过程,并且与鱼的密度无关:高风险表型对应的藻类数量变多,但是生物量对应的初级生产力反而降低,相应地,无脊椎动物的总生物量也降低。
上述案例涉及的主要都是较为简单的体系。未来更需要关注,这种简化体系内的发现,如何拓展到包含多物种、复杂互作的群落水平。以及,类似的生态
-
演化动力学模式,是否可以在不同的空间尺度延续。
2.
全球变化的多重尺度
The scales of global change
在
1992
年,主流研究是把生态系统科学与演化生物学分开的,而
Levin
则认为这种分割是不好的。经过
20
年的发展,很多的研究开始强调适应性(
adaptation
)在缓解全球气候变化过程中的重要性,并开始从地球地理历史的角度解析目前的生物地化功能。该部分主要讨论:初级生产力和代谢的研究,如何从细胞水平拓展到全球尺度?
连接不同尺度生产力的自然货币是碳单位。净初级生产力(
net primary production, NPP
)就是指单位时间、单位面积内生物圈的固碳量。那么,区域尺度的
NPP
对全球尺度的
NPP
贡献几何?反过来,全球尺度的
NPP
如何影响区域尺度的
NPP
?由于碳循环始终是高度变异的(图
2
),研究上述问题非常困难。而近
20
年内的显著突破就在于,通过将经验数据与模型相结合,为生物圈构建预测模型。
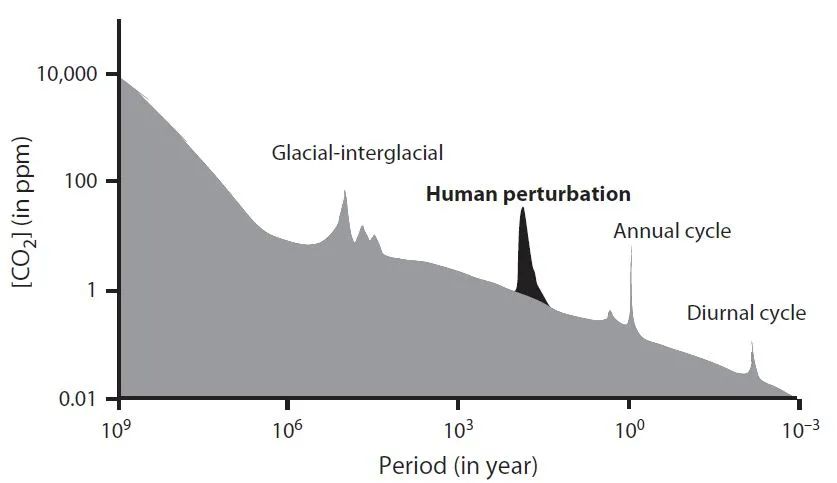
图
2.
空气中
CO2
浓度的变异谱。
在陆地生态系统中,全球
NPP
的估算依赖于多种方法的结合,例如基于遥感技术。将大气化学组分的度量与使用全球循环模型的反演技术结合,可以估算区域尺度的碳循环。而在过去
20
年里,使用涡度相关技术度量生态系统与大气间的
CO2
交换,取得了长足的进展。其中重点提到了
Moorcroft (2001)
等人提出的
Ecosystem Demography (ED)
模型。这一方法实现了从个体过程到区域过程的缩放。目前
ED
模型是同化不同尺度数据最有潜力的方法。在海洋生态系统中,也有类似的进展。例如,光学成像和缩放模型的发展,使得人类可以利用叶绿素浓度来推测海洋
NPP
,从而获得了相当精准的海洋
NPP
分布图。
表征尺度在生物学中重要性的一个经典主题是异速生长(
allometry
)。很多的研究探讨了,基础代谢速率与有机体质量的关系。且不管异速生长指数究竟应该是多少,作者认为,异速生长的理念至少可以助益连接生理学与生态系统科学。
在陆地生态系统的系统尺度上,代谢速率是植物的呼吸作用与土壤分解者异养呼吸作用的综合。一般认为,异养呼吸作用占总呼吸作用的
25%
~
50%
。
Vargas (2010)
等人对三个系统内的土壤呼吸作用进行了高频监测。通过波谱转换分析,他们研究了环境变异与土壤呼吸作用的关联尺度(图
3
)。结果发现,虽然土壤呼吸作用应该随湿度与温度的升高而增大,但是很难预测土壤呼吸作用的日变化。即,在较小的时间尺度,难以通过模型研究土壤呼吸作用的动力学。如果假定生态系统内所有细胞的代谢速率对温度具有相似的温度依赖性,则或许可以获得大尺度上的环境变异与呼吸作用的关系。
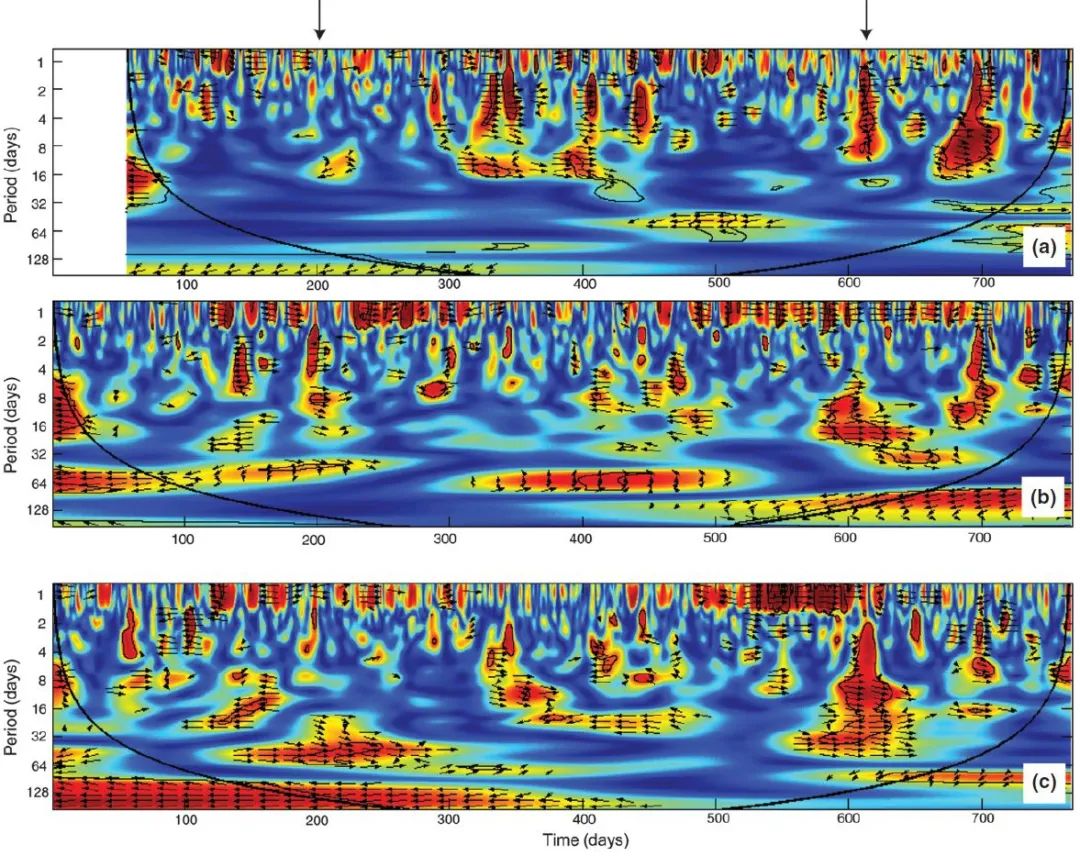
图
3.
波谱分析。
在细胞水平,生化反应速率与温度的关系可以用阿伦尼乌斯方程来表征。类似地,
Lloyd & Tayor (1994)
使用如下方程计算土壤呼吸速率
R
t
:
R
t
= R
10
exp[E(1/kT
10
-1/kT)]
。使用经验数据绘图,他们发现
E=0.55 eV
时,公式的拟合度较好。而
Gillooly(2001)
发现,在有机体尺度,活化能
E
的值为
0.41
~
0.74 eV
。这说明,温度变化对生态系统内所有生命体具有相似的影响。
3.
互作网络的模块度
Modularity in interaction networks
生物系统本质上是分级的、结构化的和模块化的。模块度(
modularity
)赋予系统冗余性(
redundancy
)和弹性(
resilience
),这对于有机体和生态系统都很重要。模块度为连接个体和群落提供了新的研究视角,其重要性也与日俱增。针对该主题,本文主要讨论两个内容。
第一,个体组间的组合不是随机的,将互作从个体尺度拓展到群落尺度需要依赖于小尺度的个体组合。研究生态互作网络,更应该关注每个个体做了什么,而不仅仅是谁把谁吃掉。种内变异会导致互作强度随时间而改变。基于个体的互作网络就是建立在种群生态学研究的基础之上。然而,如何度量个体间的互作网络仍然是一个难题。目前主要使用稳定同位素技术与
eDNA
技术。也有一些学者通过实时监测个体的运动或者度量化学介质来开展研究。
第二,在探索不同尺度模块度差异的同时,也要寻求共性,及可能的矛盾。有些情况下,个体之间的互作会导致在更大尺度,比如群落尺度,涌现出新的行为。例如,
Velicer & Yu (2003)
的研究发现,黄色粘球菌(
Myxococcus xanthus
)在生活史的一定阶段,会呈现出类似多细胞生物的结构,以利于种群在软介质表面的滑行。生物膜(
biofilm
)的发育也是类似的集合行为。这种方式虽然牺牲了部分个体,但是显著增强了种群的扩张能力,对物种本身是极为有利的。在生态学中,理解不同尺度的排列组合差异
/
矛盾,对于估计复杂性的涌现以及个体间互作网络的模块度非常重要。
该部分的第三块内容对系统生物学和反向生态学进行讨论。生物学复杂性的涌现依赖于催化反应。由此造成的构造与功能的隔室化成为生命体最普遍的共性。寻求细胞生物学网络和生态学网络模块度的类比,某种程度上就是要探索不同尺度格局形成作用的共性。
Jeong (2000)
等人对代谢网络的研究表明,这些互作都是无尺度(
scale-free
)的,即,大部分的酶只和少数的底物关联,而少部分的酶(所谓的核心,
hub
),则与多数的底物关联。
那么,如果将生态网络与代谢网络结合,会怎样呢?物种之间的生态互作通过是由化学信号所介导。
Stolyar (2007)
等人研究了一种硫酸盐还原细菌和一种产甲烷菌之间的互惠作用,这一作用可以环境中的甲烷含量。他们将这一体系发展成为两个互利物种的代谢网络模型。模型可以准确预测几个生态学相关的特征,例如代谢通量和生长过程中两物种的细胞比率。对代谢网络和化学计量模型的重建不仅能够预测代谢通量和个体的生长表型,而且能够捕获简单细菌群落互作的关键生态学特征。也就是说,如果已知一个物种的全部代谢网络,则该物种的生态学可以通过代谢网络与环境的互作来定义。这使得我们可以借由化学信息系统的结构来推测生物演化的环境,这一方法也被称为反向生态学(
reverse ecology
)。
Parter (2007)
等人对大量细菌代谢网络的模块度进行计算后,认为转录因子的比例可以反映环境变异程度。他们发现,有机体代谢网络的模块度,在变化的环境中显著高于稳定的环境中(图
4
)。这暗示着,模块度可用于度量生态位的宽度。为解析代谢网络中哪些节点代表了外源获取的化合物,诞生了“种子化合物”的概念(图
5
)。这一概念可以区分,与自由个体相比,寄生个体丢失了哪些关键的代谢特征;并证实了,相对于自由个体,寄生个体的代谢机能显著简化。这些研究表明,反向生态学不仅可以帮助我们重新思考生态学的经典问题,而且为生态学与细胞生物学的融合提供了保护伞。
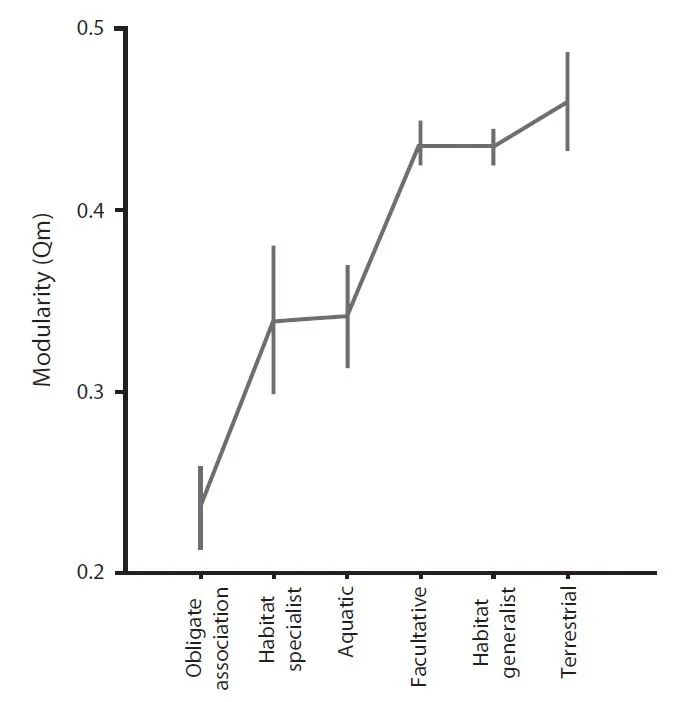
图
4.
有机体不同生态学与标准化的细菌代谢网络模块度。
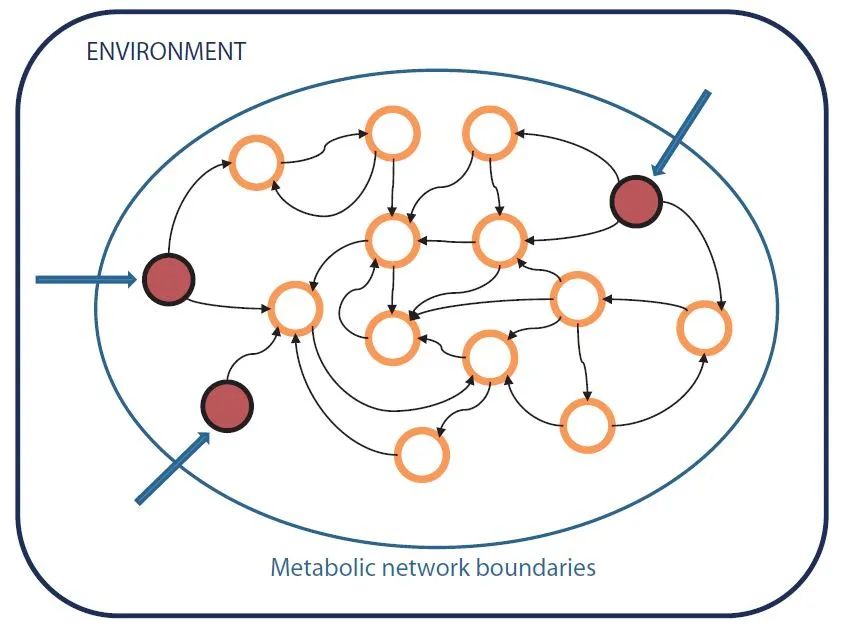
图
5.
代谢网络的反向生态学。
4.
生物多样性的空间格局
Spatial patterns of diversity
以树木的分布地图为例,生态学家感兴趣的是,不同个体是否会在局域尺度聚集成簇,以及这种聚集是否会随空间尺度的变化而改变(图
6
)。这也是物种空间分布的共性,即,个体在空间上呈现斑块化分布,而斑块度则随着观测尺度的改变而改变。在没有环境障碍的情况下,扩散能力是限制物种扩张的主要因素。格局形成的玩具模型可以很好地展示这一机制。
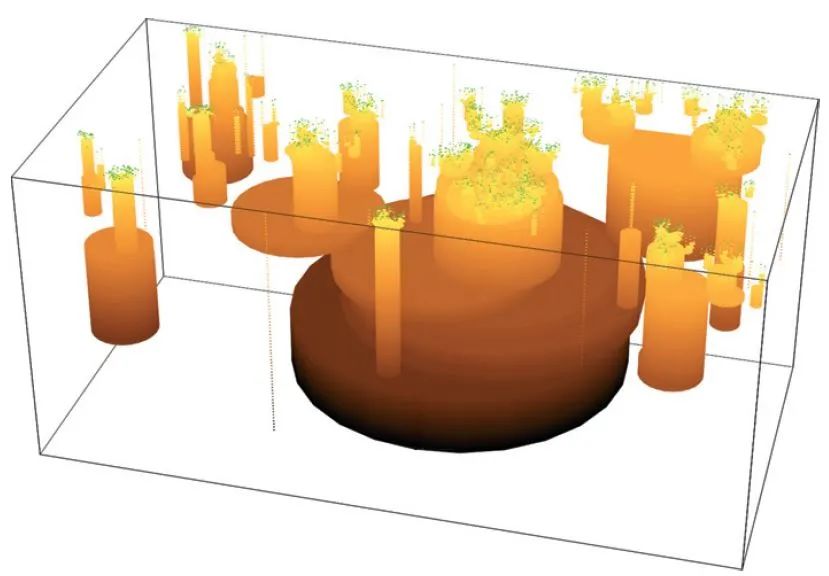
图
6.
马来西亚一个
50
公顷样地中
1404
棵
Mallotus penanmgensis
的空间分布图。















