
一名
41
岁的男性患者由于癫痫发作,无力和认知能力下降就诊于本医院的精神科门诊。该名患者还有偏头痛、感音神经性听力损失及慢性尿蛋白病史。
2
年前,这名患者的个性和行为发生了微妙变化,包括脾气暴躁并且爱争论;
1
年前,他有一周左右的时间持续感到头痛、不适和疲劳,随后突然出现讲话困难;几个小时后,他经历了由最初能使用正确句式但词不准确讲话到完全不能讲话并丧失部分书写能力。
该名患者在1
年前,
10
个月前和
7
个月前分别对大脑进行了
MRI
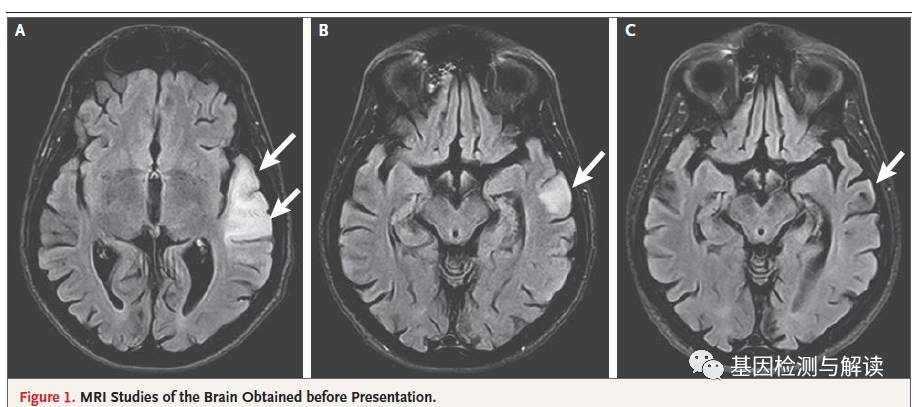
检测(如图
1
)。结果表明,患者的脑实质体积要比相应年龄段患者的脑实质体积缩小的多。
1
年前的
MRI
结果发现(
Fig 1A
)
,
在左前颞叶及后侧尤其是下壁小叶出现了轻微膨胀、内轴高压病变。这种病变因为会影响皮层,因此还在皮质下白质也发现了病变。
10
个月前及
7
个月前的
2
份
MRI
结果显示(
Fig 1B
和
1C
),病变的信号特点基本维持一致,但体积变小;事实上,
7
个月前的
MRI
结果表明病变基本缓解了。同时患者的血管造影和静脉造影的磁共振结果正常
。
该名患者在
1
年前被其他医院诊断为中风,医生用阿司匹林和降脂药进行治疗。他的语言能力在随后的
2
个月内逐步得到了改善但还不能恢复到基线水平,他头痛的症状则没有改善。
这名患者在出院
1
个月后,又出现了强直阵挛,医生用
levetiracetam
(左乙拉西坦)治疗,癫痫不再发作。在接下来的
11
个月中,他又反复发生了局部神经症状,认知快速下降,无力和步态不稳定,同时还伴有全天头痛,小腿肌肉痉挛,体重减轻
11kg
。
在来本医院就诊前
1
个月,患者血液中的胆固醇、脂类水平和肝功、肾功经检测均正常。在来本医院就诊前
2
周时,他的行为越来越像小孩,自言自语、易冲动、爱生气。他的步态、平衡及协调能力变得越来越差,并且他吞咽困难的症状继续加重。
该名患者先天身材矮小。
25
岁时,他被发现患有感觉神经性听力损失(右耳比左耳更严重);该病持续进展以至于他借助了听力辅助器械。在他
25
岁时发现了尿蛋白增多。他没有已知的过敏史。目前,他已经结婚并育有一个孩子。他适度饮酒,但经常抽烟。他的母亲是位法国
-
加拿大
-
爱尔兰后裔;据报他母亲患有抗核抗体阳性的狼疮性肾炎,糖尿病和大肠炎,并且她在走路时需要经常休息。他的父亲是匈牙利和意大利后裔并患有糖尿病和冠状动脉疾病。患者的姨妈和舅舅也患有糖尿病,并且舅舅也患有感觉神经听力损失。他有
9
个兄弟姐妹,身高在
150-163cm
。这些兄弟姐妹中有些据说健康,有些有轻微胃肠运动障碍或应激性结肠综合征,感觉神经听力损失,焦虑和
β-
地中海贫血症状。
在检测时发现,这位患者形态明显消瘦。血压为
112/72mm Hg
,脉搏为
83
,体温为
36.8
°
C
。氧饱和度为
99%
。体重为
40.5kg
,身高为
152cm
。蒙特利尔认知评分为
25
,他具有电报式语音共济失调性构音障碍并且经常说一些难以理解的话。他的视神经盘平坦且无苍白现象,在面对面视野检测中视野正常,瞳孔检查也正常。每只眼睛向上注视明显受限,横向注视有些受限,向下注视轻微受限。同时他还有双侧颜面无力并且佩戴听力辅助装置时仍有严重的双耳听力障碍。肩关节外展无力。肌肉量、语音、颈部和四肢力量是正常的,并无震颤,指鼻和跟
-
膝
-
胫测试中有轻微测距不足;快速转化运动则明显不规律。患者坐姿时没有出现躯干共济失调。当他双脚站立并闭眼时则明显得在晃动。他的步态有些失调,并且
2
个踵趾步态测试后他就会失去平衡。其他剩余的神经检测均正常。
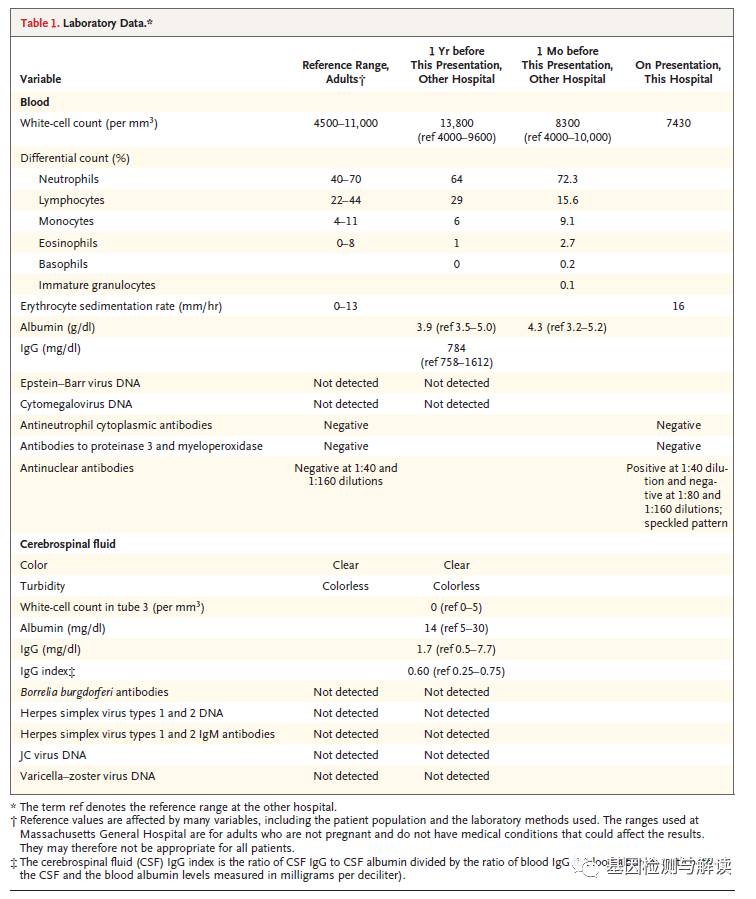
实验室检测发现有轻度肉碱缺乏,而这被认为与饮食有关。乳酸水平最初正常,但随后升高并保持这种升高状态;最高水平为
8.3 mmol/l
(标准范围为
0.5-2.2 mmol/l
)。其他检测结果见表
1
。
鉴别诊断(
DifferentialDiagnosis
)
这位
41
岁患者被发现为进展性脑病,并且分级诊断的过程包括了许多疾病的分
类,如血管,炎症,自身免疫,感染,代谢,毒性,肿瘤,神经病变和精神疾病。
进展性脑病患者一般在就诊的许多年前就出现了一些体征和症状,如尿蛋白,感觉神经听力损失,偏头痛和身材矮小。而这位患者轻微的个性改变仅发生在几年前。在鉴别诊断中,疾病进展的病症包括有血管性痴呆,多发性硬化,硬膜动静脉瘘,
CADASIL
(常染色体显性遗传病合并皮质下梗死和白质脑病),烟雾病,和线粒体疾病,如
MELAS
(线粒体脑肌病伴乳酸血症和卒中样发作)。
尽管这位患者在近几年里有轻微的症状,他在就诊本医院的
1
年半以前存在疾病复发和缓解但总体呈快速恶化过程。疾病进展数周或数月的病症包括中枢神经系统浸润性原发性肿瘤(
CNS
)(例如
CNS
的原发性淋巴瘤),急性多发性硬化症,原发性中枢神经系统血管炎和其他参与
CNS
的血管炎(如
Susac
综合征),自身免疫性脑病,进行性多灶脑白病和克雅氏病。
原发性中枢神经系统血管炎
这类患者脑部病变的图像特点最初会被诊断为中会风。多灶缺血性中风是原发性中枢神经系统血管炎的重要特点,在大脑中小血管(小动脉和小静脉)中罕见血管炎。大多患者在经历数周或数月的不同神经和精神疾病症状和体征后会就诊,他们中的一些可能被诊断为多灶性缺血卒中;在某些情况下,这些症状会持续进展。虽然这类患者普遍存在颅神经疾病,共济失调,癫痫和其他局部和扩散性疾病,但头痛和认知衰退是这一疾病的主要特点。根据定义,该综合征仅影响
CNS
;而在本案例中,周围神经系统和其他器官的迹象和症状则排除了诊断为原发性中枢神经系统血管炎。
克雅氏病
具有中风症状的脑部病变经常见于克雅氏病患者。尽管克雅氏病是罕见疾病,但该疾病的患者会快速进展为痴呆。这类疾病是一类快速进展并致命(最多几个月或几年内便死亡)的退行性朊病毒相关海绵状脑病,并伴有步态和肢体共济失调及肌阵挛。其它临床特征包括进展速度,主要根据朊蛋白的分子分型(可能会引起视觉,小脑,丘脑或纹状体功能障碍)确定。患有克雅氏病的患者无肌病,肾脏肌病或听力损失症状。
其它血管疾病
以中风或类风湿为特点的病变可能会与其它血管疾病一起发生,包括静脉窦血栓形成和遗传性血管病变,如
CADASIL
和
moyamoya
病。在没有血凝过快条件下形成的静脉窦血栓往往会复发并出血。在本案例中,患者的血管影像学研究没有发现炎症或其他影响
Willis
或其平衡的中度或大血管病变。
与自身免疫性甲状腺炎相关的激素敏感性脑病
(SREAT)
患有
SREAT
的患者会有复发缓解期,并伴有复发性局部病灶神经功能缺损,脑病进展,人格改变,癫痫和共济失调,但患者极少见局部的脑损伤。
SREAT
的另一特征还包括锥体束征和肌阵挛。
SREAT
患者也不会出现全身症状、体征(甲状腺功能障碍除外)及相关神经系统的变化。
线粒体疾病
本案例中的患者是在就诊本医院前
1
年出现症状,似乎起源于发热。随后,他的病情急剧恶化,出现其他感染包括肺炎。这些特点可能提示了一种增加代谢需求的可能性。代谢紊乱会出现卒中样发作,并且代谢紊乱经常在儿童期发病,是先天性的代谢失常。然而,如果患者患有多系统线粒体脑疾病则会在他们
10
岁,
20
岁,
30
岁时出现症状。
在一些复杂案例中,如本案例,涉及了不同症状及多部位病变,这有助于重点关注综合征的诊断并细化鉴别诊断。进展性脑病虽然会有反复,但冲动和精神问题是该疾病的一个特点。本案例中,这位患者的癫痫和肌病表现为眼肌麻痹和近端肌肉无力。他还有偏头痛、感觉神经性听力损失,身材矮小,萎靡不振和肾功能障碍(尿蛋白)的症状。尽管这位患者没有糖尿病,但他的一些亲属中有人患有糖尿病,并且还有一些亲属患有胃肠蠕动问题。这种多系统紊乱是线粒体疾病的一个特点,该疾病会影响一些高代谢活性的组织,尤其是在高代谢状态下(如系统性感染)。本案例患者的可复发,急性和短暂局灶性神经功能障碍失常对应了具有指示卒中特征的可逆性、局灶性皮层和皮层下脑损失。需要注意的是这种病变并不发生在主要脑动脉区域。虽然患者的乳酸水平在首次检测时是正常的,但他当时没有处于代谢压力之下;随后,该患者在住院期间急性衰退期的检测则出现持续的乳酸性酸中毒。导致脑病的多系统线粒体疾病包括
Leigh
综合征,
MERRF
(肌阵挛性癫痫伴破碎红纤维综合征),
Kearns-Sayre
综合征,线粒体神经胃肠型脑肌病和
MELAS
。
Leigh
综合征是一种儿童疾病。
MERRF
可能在成年期发病,肌阵挛是该疾病的突出特征,但本案例的患者并不存在该症状。
Kearns-Sayre
综合征中患者中很少见有局限性神经功能缺损,线粒体神经胃肠型脑肌病患者在疾病进程早期存在胃肠道症状。在该病人就诊时,
MELAS
则是最可能的诊断。
病例讨论
肌肉活检
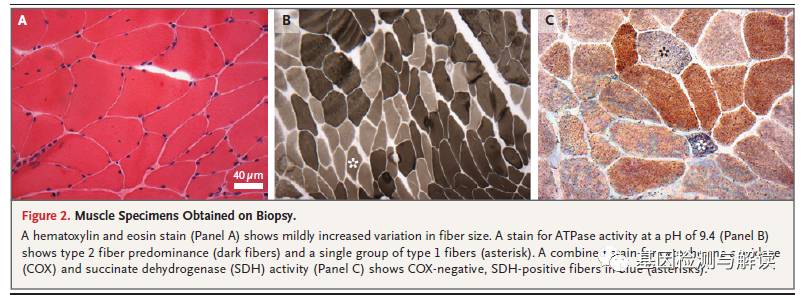
左四头肌活检(如图
2
)结果显示肌肉纤维大小和纤维再生变化明显。
Gomori trichrome
染色没有发现破碎红纤维。
ATPase
酶活染色发现肌肉中主要是
type2
性纤维并且轻度纤维型有分组现象。另外,细胞色素
C
氧化酶(
COX;
复合物
IV
)和琥珀酸脱氢酶(
SDH;
复合物
II
)双染色法可以用来评价线粒体功能。该患者体内确实发现了
COX
阴性,
SDH-
阳性纤维。电子显微镜进一步显示了该患者体内有变大的线粒体和一些具有复杂嵴的线粒体,以及具有增厚基底膜的毛细血管。这些发现并不能确诊,但由于该患者线粒体失常的临床问题,存在比相同年龄段患者更多的
COX
阴性纤维以及电子显微镜下微小的线粒体异常,建议做更详细的线粒体评估。
基因检测
MELAS
是一种涉及多个基因的疾病,
32
个线粒体基因中任何一个发生突变都会产生相应的疾病。最常见的突变是
MT-TL1
基因中
m.3243A
→
G
的突变,
MT-TL1
基因编码
Leu tRNA
(
UUR
)。由于该患者的症状和
MELAS
高度相似,因此进行了线粒体
DNA
的靶向分析。尽管对最受影响部位的组织样本进行分析可提供最高量来揭示线粒体
DNA
中的突变,但是本案例的患者则是进行了全血分析;考虑到他病情严重,我们确信他的异质水平会足够高到被检测的水平。唾液,尿液和肌肉样本和口腔拭子可用于
MELAS
的基因测试;由于阴性选择和细胞更新,血液中的产量是最低的。因此,血液中即使检测为阴性,也不能排除
MELAS
的诊断。
经过基因检测发现本案例的患者携带












