疫苗接种仍是控制季节性感染的主要方法,在减少与流感相关疾病的发病率和死亡率方面是最有效的方法。自1940年代以来, 生产流感疫苗的主要方法是基于鸡胚的生产过程。然而,发生大流行时,这种方法有很大的局限性,因为从分离毒株到最终产品和验证需要六个月时间。事实上,用鸡胚生产疫苗是一个相对缓慢的过程,生产产量既无法预测,且毒株之间差异较大。特别是,如果下一次流感大流行的是禽流感病毒,产蛋母鸡数量将减少,用于疫苗生产的受精蛋胚将会短缺。虽然蛋类来源疫苗的生产将会继续,但是已经开发出源于细胞培养的流感疫苗的新生产技术,以及其他新技术平台,如合成流感疫苗。(点击文末阅读原文,有福利!)
流感在全球范围内发生,其对儿童的年度攻击率大约20 - 30%,对成人的是5 - 10%。对于高危人群,(流感)疾病可能导致住院和死亡。估计,每年导致300万到500万例严重疾病,25万至50万人死亡。每年流行和不定期大流行的是A型流感病毒。在一项研究中,99%的住院病例是由A型流感病毒引起的,只有1%是由B型流感病毒引起的。在北半球,一般从10月至3月流感流行, 在南半球则是从4月到9月。自1952年以来,全球流感监测和反应系统(GISRS)一直在进行流感病毒学监测。自它成立以来,网络不断发展,现在由113个国家的143个国家流感中心(NICs),和6个世界卫生组织(WHO)合作中心(CCs)组成。为了监视全球流感活动,所有这些实验室大约每年处理500000呼吸道标本。NICs每年向CCs送检大约8000株分离过的流感病毒样本,以确定病毒抗原和基因特征,提供支持以确定季节性流感疫苗生产所用毒株的组成。
需要持续地监测全球流感,监测范围除了以前季节性出现的病毒还有新病毒的出现和循环,这样才能获得最佳的流感疫苗产品。在欧盟/欧洲经济区(欧盟/ EEA),大多数季节性流感疫苗来源于鸡胚 (表1)。流感病毒是生长在受精蛋的尿囊腔中; 然后病毒收获,灭活、纯化和加工。目前每年的产能是4.13亿剂三价流感疫苗,在一些欧盟/欧洲经济区国家,四价灭活流感疫苗有望替代三价灭活流感疫苗。
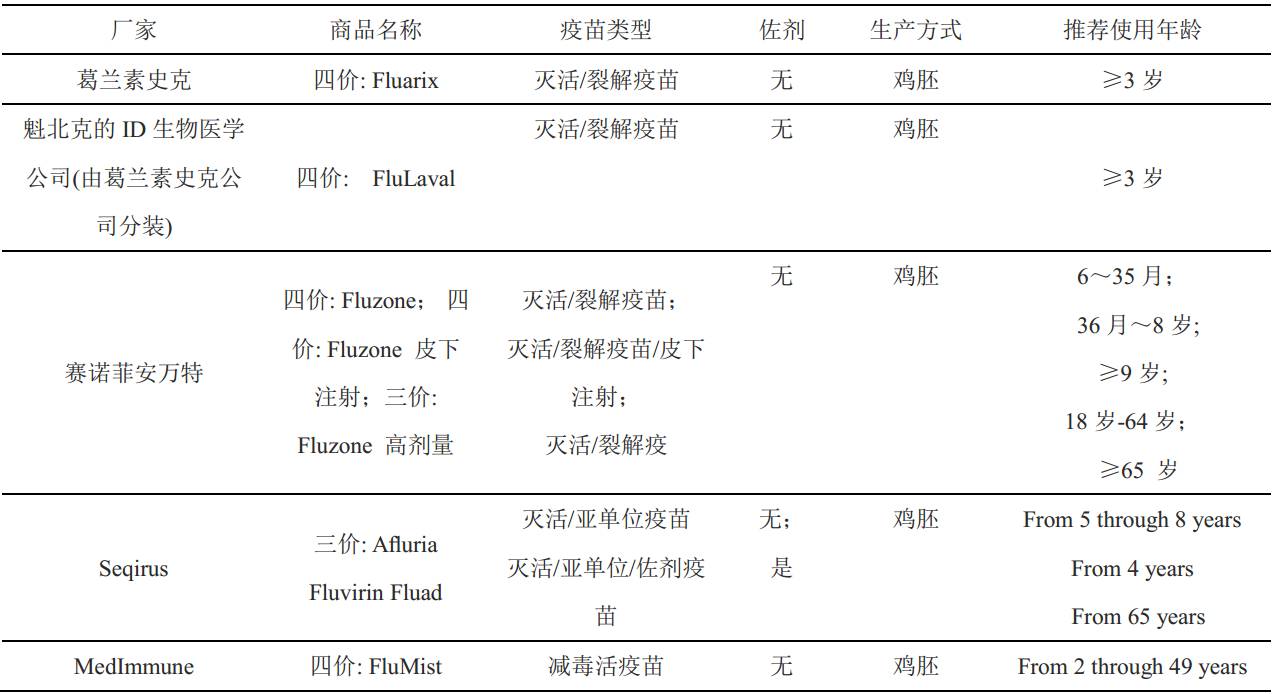
表1. 在欧盟/欧洲经济区可用的季节性流感疫苗 (2015/2016季)

在美国, 生产三价和四价流感灭活疫苗,以及生产的减毒活流感疫苗也是使用基于鸡胚的普通方法进行的(表2)。美国2016-2017季已经签发1.57-1.68亿剂量的注射流感疫苗。
表2. 可用的季节性流感疫苗在美国(2016/2017季)
目前,同时存在的三种生产流感疫苗的方法,引起许多疫苗生产企业的兴趣;第一种历史悠久,是常规的借助蛋类生产流感疫苗的方法,第二种是细胞培养来源的流感疫苗,第三种具有最新技术的合成疫苗(图1)。
![]()
1995年,世卫组织建议开发一种可共选择的流感病毒培养系统,并研究哺乳动物细胞培养系。商业上提出了三种细胞系用于细胞培养的流感疫苗:Madin Darby犬肾细胞(MDCK),Vero细胞(来自非洲绿猴的肾脏上皮细胞)——用于脊髓灰质炎疫苗生产20年以上和PER.C6是一株源于人类视网膜衍生细胞系。
MDCK细胞和Vero细胞被证明是特别有前景的细胞系候选细胞,因为那时流感疫苗只在鸡胚蛋中生产,为此需要大量高质量的受精鸡胚,这只能通过仔细的事先计划才能得到。在遇到大流行毒株的情况下,可能不易获得足够数量的鸡胚来生产特定的疫苗,因为从毒株鉴定到疫苗的时间约为4 - 6个月,通常需要1到2个鸡胚生产一个剂量的流感疫苗。从人类传播的野生流感病毒中选择不同的表型,这些不同的表型均可以在鸡胚培养中适应;基于鸡胚的疫苗可能是对鸡胚成分过敏的人的禁忌。1958年,加州大学伯克利分校的SH - Madin和NB Darby借助一只健康的可卡犬的肾脏建立了MDCK细胞系。MDCK 33016悬浮细胞株已经适应了在无血清的条件下生长,MDCK细胞已经被用来分离广泛的人类流感病毒。生产细胞培养的流感疫苗有许多优点。首先,避免了基于鸡胚的生产系统所需用较长的生产周期,并且有一个包括封闭生物反应器系统的更可控的生产过程。此外,在哺乳动物衍生组织中培养扩增的病毒仍然保持抗原性不变,不像在鸡胚中孵化的情况,因为这个宿主系统可以对生长良好的变异进行选择。在2007年6月1日,一种MDCK细胞培养的季节性流感疫苗由诺华疫苗公司生产,商品名是Optaflu,它被欧洲药物管理局(EMA)批准在欧盟用于肌内注射使用。诺华公司(Novartis)的疫苗在市场销售之前,用了5年时间进行相关研究。事实上,在德国,第一期临床试验于2002年开始,研究涉及40名18到40岁的志愿者, 2003年第二期研究包括200名18 - 60岁之间的志愿者,第三期后,进行了数年上市后产品研究。
2012年11月,美国食品和药物管理局(FDA)批准了第一个细胞培养型流感疫苗——Flucelvax。Optaflu作为该产品最初的商标名称,被美国生物制品评估和研究中心(CBER)拒绝,随后提出Flucelvax并被接受。
2009年11月,德国监管部门批准了细胞培养源的流行病疫苗Celtura(诺华公司),该产品是H1N1流感疫苗,源于MDCK细胞培养技术,采用MF59佐剂。2009年7月至9月,在I期临床研究期间,对Celtura进行的一项随机研究显示,在单次治疗后,一种抗体反应似乎与保护有关。在2012年,上市后疫苗监督研究证实Celtura具有良好的安全性 (表3)。
1998年,百特疫苗(Baxter Vaccines)开发出一种基于Vero细胞,通过细胞培养生产一种新疫苗的方法。2009年一种野生型 H1N1 A型病毒在加州全范围迅速流行;在欧洲,百特公司被允许通过Vero细胞开展这种新疫苗的研究。欧洲监管当局于2009年10月批准了Celvapan疫苗。Preflucel是由百特公司制造一种季节性流感疫苗,加上之前的H1N1 A型病毒,至此通过Vero细胞系平台已经生产三种灭活流感病毒疫苗。2008 - 2009年流感季,在美国进行的Preflucel的III期临床研究证明,源于Vero细胞培养的疫苗在青少年和成人身上都是安全且耐受性好。然而,2011年10月20日,由于澳大利亚药品监管机构告知欧洲药品管理局(EMA)怀疑细胞培养的流感疫苗有越来越多的副作用,百特公司从欧盟市场召回了大量的药品。作为预防措施,EMA随后召回了欧洲市场的所有批次(表3)。已经显示PER.C6细胞系符合欧盟和美国对流感疫苗生产的监管要求。在2009年,赛诺菲巴斯德公司(Sanofi Pasteur)已获得借助PER.C6进行流感疫苗生产的许可证,并开始了其H7N1疫苗的I期临床试验(表4)。这是以细胞为基础对H7大流行性流感病毒疫苗候选物进行的第一项研究,尽管疫苗耐受性良好,但结果显示免疫原性和体液免疫应答较差。因此,这个疫苗不符合人用药品委员会(CHMP)批准的疫苗标准。迄今为止,已批准用于人类的流感疫苗中还没有源于PER.C6(表5)。
表3 诺华MDCK细胞培养流感疫苗的临床试验摘要信息
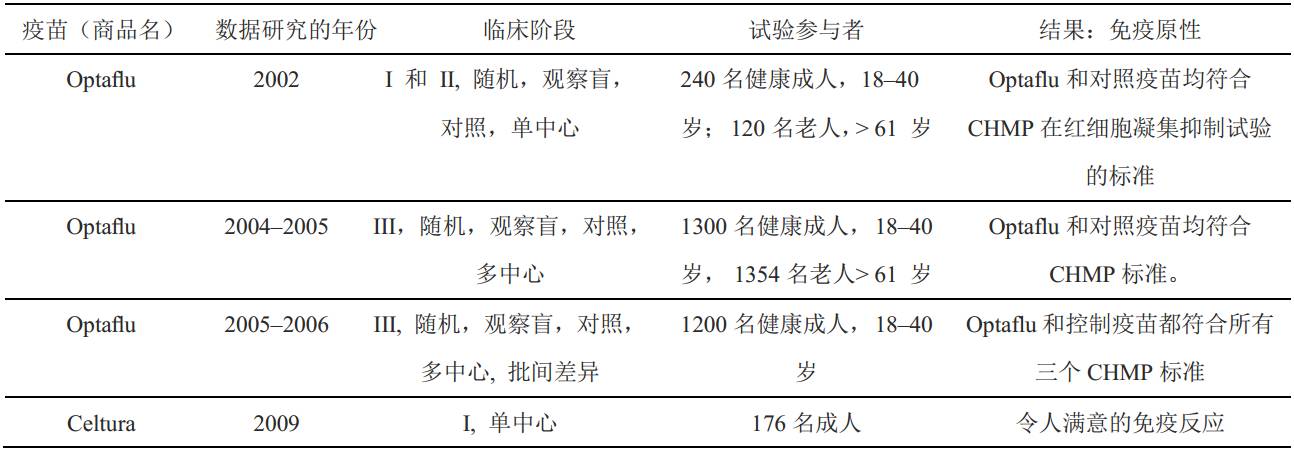
表4百特Vero细胞培养流感疫苗的临床试验摘要信息

表5赛诺菲巴斯德PER.C6细胞培养流感疫苗的临床试验摘要信息

使用细胞生产流感疫苗有一些局限性; 目前许多公司使用MDCK和Vero贴壁细胞系放大生产方面仍然是最大的挑战。用于生产流感疫苗的其他非贴壁细胞系(如PER.C6系),在其疫苗产品的第一次临床研究阶段产生了免疫应答不成功的结果。限制这种技术发展的一个主要原因是活的流感病毒需要进行不同步骤的灭活或衰减以满足生物安全,这种方法的直接结果就是导致最终产品的产量比较低。
为了克服细胞培养疫苗生产的局限性,如在细胞中病毒传代或可能的培养污染,开发了新流感疫苗的生产技术,它是使用杆状病毒表达载体系统(BEVS)来代替细胞培养生产。在此过程中,将血凝素(HA)基因序列插入含有杆状病毒的昆虫细胞中。昆虫细胞在无动物血清培养基中悬浮培养细胞密度适中。在流感疫苗组成中,每种菌株血凝素含量是45g,而季节性流感病毒的血凝素含量为15g。2013年1月16日,FDA批准了蛋白质科学公司的Flublok,这是第一种使用昆虫病毒表达系统的许可疫苗。其他流感疫苗正在通过新技术开发,特别是大流行性流感疫苗。对健康成年人的第一期研究表明,由H1N1 A型大流行性病毒株在植物中产生的重组血凝素制备的流感疫苗已经显示了其安全性和免疫原性。特别地,用含有特异性病毒HA的杂交载体感染烟草植物能够大规模生产重组血凝素蛋白。人类进行的第一项研究评估了HAC1(一种植物产生的重组HA在流感疫苗中)的免疫原性。几种病毒已经用作重组载体疫苗;例如,修饰的牛痘病毒安卡拉(MVA)已被用作流感病毒H5N1的外来HA基因的疫苗载体。最近一项对80名18-29岁志愿者进行的I-II期研究已经证实这种疫苗的耐受性和免疫原性。然而,其免疫原性尚未与常规H5N1灭活疫苗的免疫原性进行比较。流感疫苗的另一种替代制剂是通过肌内注射接种的基因编码流感病毒核蛋白质。对小鼠进行DNA核蛋白注射能够诱导对同源和异源病毒株的保护。另一个策略是使用嵌合血凝素(cHA)制定一种通用的流感疫苗,这个方法与之前提到的方法完全不同。由于免疫系统通常识别HA相同的结构域,即使各种流感病毒的不同头部结构会引起免疫系统加强反应,每个流感季节之前也不需要重复接种疫苗。通过这种创新技术,可以生产各种流感疫苗,如灭活的全疫苗,裂解苗,减毒活疫苗,重组疫苗和DNA疫苗。
在实验室也观察到,当免疫系统所识别的球状结构域被去除时,抗体对血凝素基底部的应答增加。
虽然一些公司的鸡胚源亚单位疫苗继续在生产,但已经开发出新型流感疫苗的制造平台。
1945年,用鸡胚生产的第一支流感疫苗获得批准。在未来十年,蛋源和细胞源的流感疫苗很可能会同时生产和销售。与蛋源的疫苗生产相比,更快的发展和更创新的技术将缩短疫苗的等待时间。
通过细胞培养技术生产疫苗有个许多优点:细胞培养生产更清洁和更快,这在大流行的情况下尤为重要; 避免了病毒不适应的现象;最后,生长的细胞控制于限定的培养基中且细胞库都符合良好生产管理规范(GMP)标准,相比蛋源疫苗的生产要求却较低。
到目前为止,最成功的两个细胞系是MDCK细胞系和Vero细胞系,两种细胞系的使用已经使季节性和大流行性流感疫苗在欧洲和美国进行生产和销售。
细胞培养源的疫苗生产具有优点和缺点。一个明显的优势是可以检测和去除细胞培养物中的任何外来的感染因子,而主要缺点是需要对现有的设施进行修改或完全重建。流感疫苗制造过程的每一步都得到持续监控,因为存在污染的可能性较大:原始临床样品分离中时出现外来病毒,细胞培养中的致肿瘤病毒,生产操作人员或原材料等。
新技术的研究产生了最新一代的流感疫苗,其中疫苗是在流感病毒不灭活或使用亚单位表面抗原的情况下生产的; 因此,可以避免以蛋源和细胞源生产中固有的许多问题。合成疫苗的巨大优势在于生产过程不是以全病毒开始,而是从中提取目标蛋白质; 糖蛋白(例如血凝素HA)的核苷酸序列被人工合成并插入完全独立于病毒的生产环境中。 DNA疫苗可能是未来人类接种的候选疫苗,预先构建的疫苗株库能够被用在流行病,特别是大流行病时期。
参考文献:
Manini I, Trombetta CM, Lazzeri G, Pozzi T, Rossi S, Montomoli E.Egg-Independent Influenza Vaccines and Vaccine Candidates.Vaccines (Basel). 2017 Jul 18;5(3). pii: E18.
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品圈微信群!
请注明:姓名+研究方向!


版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。

点击左下角,填写报名信息,参与本期在线交流即有机会参与抽奖!















