转载自:
识林
®
- 药业法规实践知识平台 www.shilinx.com
-
“预 BE 试验已经做到 18 例,受试者多一些才保险。”
-
“药物变异性高,已做到 120 多例,若再多
一些例数就通过了,听说有企业这个产品都突破 150 例了。”
-
“这个是我们企业的主打产品,钱不是问题,多增加受试者,务必确保通过。”
-
“这个药物变异性太高,我们床位有限,一次做不了那么多受试者,你换一家基地试试吧。”
-
“这个药品变异性太高,BE 试验没法开展,参比制剂自身对照都难以等效。”
以上这些说法是否很耳熟?
仿制药一致性评价工作在正如火如荼的开展,大批口服固体制剂 BE 临床批件正蓄势待发,生产企业、CRO 和临床基地形成一个 BE 上下游生态链,国内企业的关注点大多投向 BE 试验的过程管理上,且普遍存在:
镜头拉回2008年美国佐治亚州亚特兰大市,时值11月,清风习习,美国药学会年会场内气氛热烈、活泼,一个全球科学家小组正就 FDA 的 BE 指南展开热烈讨论。高变异药物等 BE 问题已困扰美国药界数十年,时任 FDA 仿制药办公室科学主任的余煊强博士萌生了撰写一本 BE 专著的想法。余博士随即与时任 FDA 仿制药办公室 BE 主审的李冰博士,与多位 FDA 审评专家和学者合作,主编了
《FDA 生物等效性标准》
专著。今年 1 月,北京大学药物信息与工程研究中心和北京大学医学出版社推出了该书的中译本(购买方式请
点击此处
),书中讲到:
高变异药物:个体内 BE 测量值的可变性(%CV)为 30% 或更高的药物。个体内可变性的来源包括:
由于平均 BE 方法的固有特性,即使在仿制药和参照药品的平均生物利用度差别很小的情况下,高变异药物 BE 研究也可能需要招募大量的受试者。这是个体内变异性高所致的后果。如下图所示,在使用平均 BE 方法和常规样本量的BE研究中,甚至还可能出现高变异性参照药品与自身相比,也不能证明 BE 的情况。
FDA 选择评估了多个方法:直接扩大 BE 限度、固定样本容量扩大 BE 限度、基于参照药品的可变性扩大 BE 限度和基于样本容量和缩放比例扩大 BE 限度。根据这些评估,FDA 发展出参照药品标度平均 BE 方法:使用点估计约束, 并将 BE 容许限度按照参照药品的可变性缩放。
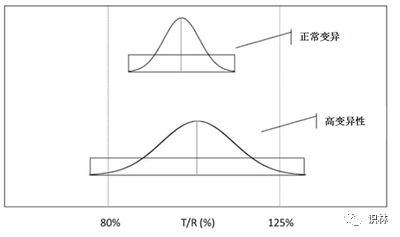
图 BE 研究变异性影响。受试者数相同情况下,高变异性导致置信区间变宽,使得研究更难以通过 80-125% 的 BE 限度
该方法通过研究参照药品个体可变性来调整高变异药物的 BE 限度。运用参照药品-标度是基于这样一个一般概念:参照药品的可变性可用作设定 BE 限度公用标准的一个指标。本方法有效地降低了高变异药物所需的 BE 试验样本数。
FDA 推荐部分重复设计方法作为获取该信息的最有效方式。参照药品标度平均 BE 方法已在 FDA 成功应用。迄今为止,这一新方法已用于支持许多高变异仿制药药品的审批。
今年 4 月 10-11 日,现任 FDA 药品质量办公室副主任的余煊强博士、FDA 仿制药办公室 BE 一处代理处长李冰博士和其他 FDA 审评专家和学者将在北京大学药物信息与工程研究中心主办的
“中美药监生物等效性会议”
上,与我国食药总局 CDE 审评专家同堂探讨 BE 试验方案设计与技术审评关注点。这将是 BE 领域一次国际高水平的科学聚会,让众多业界人士翘首以待。
会议信息
时间地点:2017 年 4月 10- 11 日 北京友谊宾馆
日程详见:
中美药监生物等效性会议第二轮通知
(点击标题查看)
收费标准:
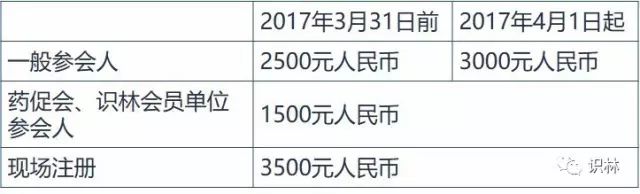 注册费含会议资料、茶歇和午餐
注册费含会议资料、茶歇和午餐
注册报名
即日起登录网站( http://www.cpier.pku.edu.cn )在线报名、点击文末阅读原文或长按识别下方二维码在线报名。

电话:010-62755647 / 62758023
邮箱:BE@cpier.pku.edu.cn
作者:识林-爬山虎
↓ ↓ ↓
请使用手机"扫一扫"
x





