本周新药数据共8个,其中抗感染2个,肿瘤2个,神经疾病2个,疫苗1个,皮肤疾病1个
❖
辉瑞宣布将与BioNTech联合开发与商业化BioNTech基于mRNA的COVID-19候选疫苗BNT162。伴随着美股反弹与多项利好,BioNTech股价当日大幅上涨66.5%。
BioNTech创立于2008年,总部位于德国美因茨,是mRNA疗法领域的主要玩家之一,2019年10月在达斯达克上市。目前在mRNA赛道上,与COVID-19结合比较紧密的公司主要有Moderna,CureVac和BioNTech,由于关注较高,话题一直不断,BD合作也是层出不穷。
其中BioNTech计划在获得监管批准后,4月底开展新冠疫苗全球临床试验,范围包括欧洲、美国和中国,其中复星医药负责该疫苗在中国大陆及港澳台地区的临床试验、上市申请和市场销售,并承担相应的成本和费用
❖
德国默克(Merck KGaA)发布了其自主研发的双功能免疫疗法M7824(PDL1/TGF-β)在二线治疗晚期非小细胞肺癌(NSCLC)临床研究的最新结果,所有患者的ORR为21.3% (n=17/80),这个其实不是很高,但是在1200mg剂量组中,PD-L1阳性(≥1%)和PD-L1高表达(≥80%)患者的ORR分别为36.0% (10/27)和85.7% (6/7),这就比较惊人了。
在O和K横扫重大癌种后,全球一直试图在寻找新的突破口,此前没上车的MNC也非常珍惜M7824这个机会,比如葛兰素史克(GSK)与德国默克就共同开发和商业化M7824达成了一项全球合作协议,GSK支付约3.43亿美元的首付款,以及38.71亿美元的潜在付款。
每月一次,臀部肌肉注射Cabenuva,与每日服用口服抗病毒疗法相比,治疗48周后,在抑制患者体内HIV-1病毒RNA水平方面效果相当
ViiV在HIV领域的产品线
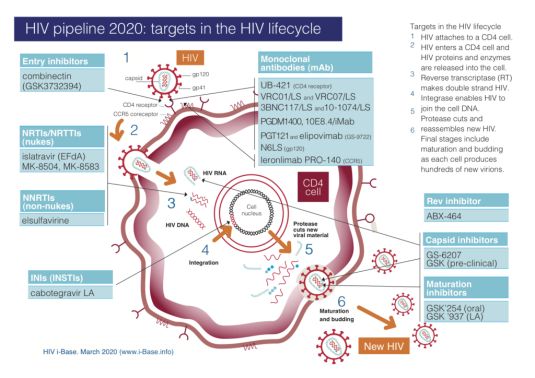
数据来源:ViiV healthcare
Soligenix公司宣布其光动力疗法SGX301在治疗皮肤T细胞淋巴瘤的3期临床试验中获得积极顶线结果
Soligenix公司宣布,该公司开发的“first-in-class”光动力疗法SGX301在治疗皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma, CTCL)的3期临床试验中获得积极顶线结果
SGX301将合成金丝桃素作为一种外用药膏涂抹在皮肤病变处,而病变处的癌变T细胞会吸收药物。16-24小时之后,SGX301可以被低能量的荧光激活,激活的金丝桃素能够抑制癌变T细胞的增殖并导致它们的凋亡
在名为FLASH的3期临床试验中,总计169名患者接受了SGX301或安慰剂的治疗。
试验结果表明,在第一个疗程结束后,SGX301组患者中,16%的患者病变减少至少50%,而对照组这一数值为4%(p=0.04)
杨森公司宣布向美国FDA递交ponesimod的新药申请(NDA),治疗复发性多发性硬化症(MS)成人患者
强生旗下杨森公司(Janssen)宣布向美国FDA递交ponesimod的新药申请(NDA),治疗复发性多发性硬化症(MS)成人患者
Ponesimod是一款特异性S1P1调节剂。这类药物能够通过抑制S1P1受体的活性,将淋巴细胞束缚在淋巴结中,从而降低循环淋巴细胞的数量
在3期临床试验中,ponesimod与获批疗法teriflunomide进行对比,共有1133名MS患者参与该试验,疗程长达108周
ponesimod与活性对照组相比,使MS的ARR降低30.5%。此外,其缓解疲劳的关键性次要终点也得以满足
辉瑞宣布其在研20价肺炎链球菌偶联疫苗,在3期临床试验中对成人显示出良好的安全性和免疫原性
辉瑞宣布,其在研20价肺炎链球菌偶联(20vPnC)疫苗,在预防由肺炎链球菌感染引起的肺炎和侵袭性疾病的3期临床试验中,对18岁及以上成人显示出与已获批疫苗Prevnar 13相当的安全性和免疫原性
偶联疫苗(conjugate vaccine)是通过化学方法将多糖或寡糖抗原,偶联到蛋白质载体上。它能够更好地刺激成人与儿童的免疫反应
在3期临床研究中,共有3880名此前未接种过肺炎链球菌疫苗的18岁及以上成人参与
试验结果显示,与Prevnar 13相比,接种20vPnC疫苗一个月后,试验组中60岁及以上成年人的13种血清型均达到了免疫原性的非劣效性标准。
辉瑞宣布,其口服JAK1抑制剂在治疗中重度特应性皮炎成人患者的3期临床试验中,达到了主要研究终点
辉瑞宣布,其口服JAK1抑制剂abrocitinib,在治疗中重度特应性皮炎(AD)成人患者的3期临床试验JADE COMPARE中,达到了主要研究终点
辉瑞的abrocitinib是一种口服小分子特异性JAK1抑制剂
在这项3期临床研究中,中重度特应性皮炎患者在接受外用疗法的同时,接受abrocitinib,活性对照(dupilumab),或安慰剂的治疗
接受两种不同剂量abrocitinib治疗的患者在第12周达到主要疗效终点的比例,显著优于安慰剂组,这一疗效在第16周得到维持。
使用洛匹那韦/利托那韦组合与标准护理相比,并没有为严重的COVID-19,成人患者提供显著益处
对于COVID-19,使用洛匹那韦/利托那韦组合与标准护理相比,并没有为严重的成人患者提供显著益处
洛匹那韦/利托那韦为复合蛋白酶抑制剂
临床试验总计招募了199名经过实验室检测确认的COVID-19患者。99名被纳入使用洛匹那韦/利托那韦治疗组,100名纳入标准护理组
洛匹那韦/利托那韦与标准护理相比,在意向治疗患者群(ITT)中,在中位临床改善所需时间方面并没有提供显著益处,两者均为16天(临床改善风险比1.31, 95% CI,0.95-1.85,P=0.09)
Biohaven Pharmaceuticals宣布其髓过氧化物酶抑制剂获得美国FDA授予的快速通道资格,用于治疗多系统萎缩患者
Biohaven Pharmaceuticals公司宣布,其口服髓过氧化物酶(MPO)抑制剂verdiperstat(BHV-3241)已获得美国FDA授予的快速通道资格,用于治疗多系统萎缩(MSA)患者
MPO是氧化和炎症过程的关键驱动因素,它在一系列脑部疾病中显著增加。抑制MPO的活性是治疗神经炎症和神经退行性疾病(包括MSA)的一种颇具前景的策略
2a期临床试验
经过12周的治疗后,安慰剂组患者评分下降了4.6分,而使用每日两次300 mg BHV3241的患者分数下降了3.7分,使用每日两次600 mg BHV3241的患者分数下降了2.6分
Verdiperstat对神经系统有保护作用
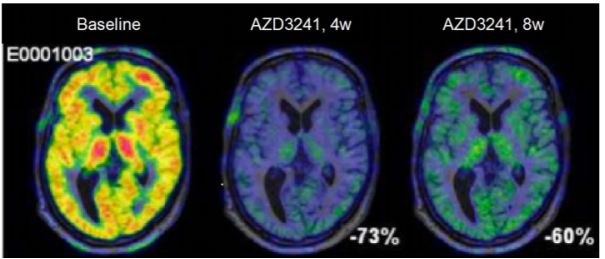
数据来源:biohaven
阿斯利康宣布Imfinzi在一线治疗小细胞肺癌的3期临床试验中,显示出对患者总生存期持续显著的改善
阿斯利康宣布,其免疫疗法Imfinzi(durvalumab),结合标准护理方法,在一线治疗广泛期小细胞肺癌(ES-SCLC)患者的3期临床试验CASPIAN的最终分析中,显示出对患者总生存期(OS)持续显著的改善
阿斯利康公司开发的Imfinzi是一款人源化抗PD-L1单克隆抗体,它通过防止PD-L1与PD-1和CD80受体的结合,解除免疫抑制
在名为CASPIAN的开放标签,随机,全球性3期临床试验中,广泛期SCLC患者接受了基于Imfinzi的组合疗法或者标准化疗组合的治疗
Imfinzi的组合疗法可以使患者得到具有临床意义的总生存期改善。添加了抗CTLA-4抗体的组合疗法没有达到试验的主要终点



















