1. 多糖塑造肠道菌群
在人类肠道中,一般一类菌仅限于分解一种或几种类型的多糖
Bacteroides thetaiotaomicron
能够分解超过
12
种,像这种能降解多种多糖的菌称之为“
generalists”
,专一性降解某一种多糖的菌称之为“
specialists”
,
specialists
在营养匮乏的情况下更容易缺失,这类菌往往倾向于利用常见的、膳食来源的多糖以及宿主自身的黏液多糖,而来自植物细胞壁以及黏液层的高分子成分较难被利用
[1]
,如
Figure1
所示:
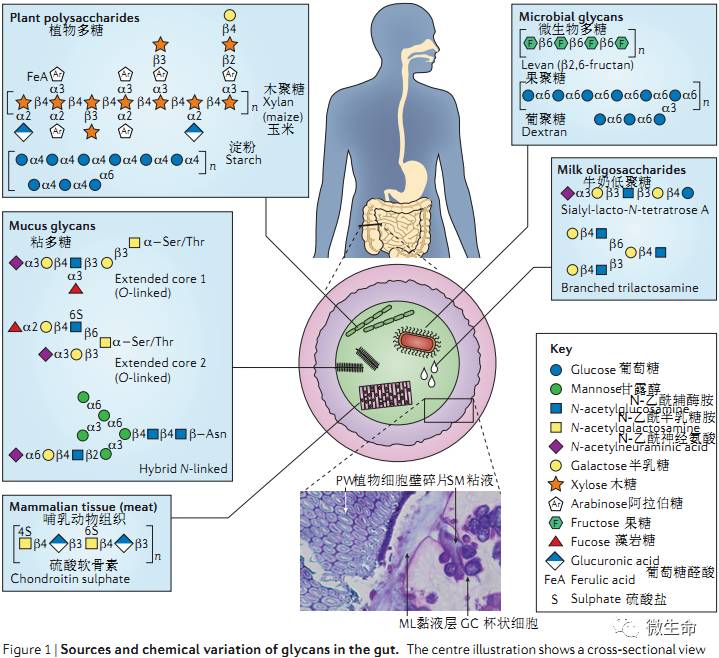
植物细胞壁多糖如纤维素、半纤维素、果胶有错综复杂组成,尤其是半纤维素与果胶结构仅有细微的差异。胞内植物聚糖如淀粉,可被包裹在不容性的微粒中或以特定化学形式存在,不易被酶降解。烹饪、碾磨等食品加工工艺能影响抗性淀粉的丰度,也会影响肠道微生物对植物聚糖的利用率。内源性的
O-
和
N-
连接的多糖化学结构也很复杂,成百上千种不同的结构可以连接在一种糖蛋白上,这就需要黏膜细菌产生许多不同的降解酶对不同类型的聚糖进行高效利用,也恰恰是黏液分泌物中多糖的复杂性与多样性阻止了细菌的侵袭,保障肠粘膜屏障结构的完整性。
微生物对特定多糖降解的代谢产物如
SCFAs
,在结肠中被吸收并产生积极效应,丁酸就是在结肠中产生的,并且直接作为能源物质被结肠细胞利用,可以移植结肠肿瘤的生长,乙酸盐与丙酸盐则被吸收后进入血液循环,在肝脏中参与脂类与糖类的代谢。
2. 糖类如何促进婴儿肠道菌群的改变
早期婴儿饮食来自于母乳或配方奶粉,很多来自饮食的糖类是在断奶后才可以被利用的。尽管碳水化合物的摄入量有一定波动,内源性的宿主多糖仍可作为一种稳定的微生物营养来源,贯穿宿主的一生,而婴儿早期肠道内碳水化合物的组成极大的影响了肠道菌群的建立。
母乳中含有上百种结构不同的多糖,初级结构为乳糖、半乳糖、葡萄糖、N-乙酰葡糖胺、藻岩糖、涎酸以及低聚糖
(
HMOs
)。
HMOs
低聚糖
含量丰富,结构复杂,其他哺乳动物中却没有,
HMOs
由支链乳糖或者N-乙酰葡糖胺重复单元组成,再由唾液酸与藻岩单糖修饰。
HMOs
与人血清组织抗原以及粘液中O-连接的结构类似。大多数
HMOs
并不能直接被人类编码的酶水解,作为一种天然的“益生元”,HMOs有助于肠道菌的成熟,尤其是对一些特定功能的微生物进行选择性富集。
婴儿肠道内主要的微生物与成人差异不大,但比例差异较大。母乳喂养的婴儿
Lactobacillus,
Bifidobacterium
比例最高,可能与
HMOs
有关,
Bifidobacterium infantis
与
Bifidobacterium bifidum
甚至可以直接代谢
HMOs
,
而
Lactobacillus spp.
倾向于利用
HMOs
的单糖组分,这表明婴儿肠道菌群中消化母乳的微生物是协同发挥作用的
[2]
。长期食用配方奶粉的婴儿,由于缺乏母乳中的低聚糖
Lactobacillus
与
Bifidobacterium spp
.
比例降低
,Clostridium spp.,
Bacteroides spp
以及
Enterobacteriaceae
的比例增高,其影响还有待评估。营养匮乏时,一些内源性的多糖能够为某些肠道微生物提供营养,定植于黏液层,而
HMOs
结构与粘液中O-连接的多糖结构非常类似,见
Figure1
,
因此这些细菌也可能利用
HMOs
,如
B.thetaiotaomicron,
分泌的外膜酶系统就能分解粘液中O-连接的多糖
[3]
。
3. 成人菌群代谢多糖
婴儿在6个月的时候饮食中的碳水化合物组成会有一个突然的转变。谷物、水果、蔬菜的摄入导致更多复杂的植物多糖进入肠道,菌群组成也发生改变
,
Bacteroidetes、
以及其他
Firmicutes
和
A
ctinobacteria
更多。菌群在发育过程中存在多个时间点,微生物功能基因更加丰富,其中植物碳水化合物降解有关的基因正是在摄入固体食物之前出现。
值得注意的是,植物多糖降解物种的出现是先于饮食结构的改变的,
这些微生物来自于口腔-粪便周期性的转运,并且能靶向利用多糖
[4]
。
除了特定饮食塑造菌群组成,直接在饮食中添加多糖也能影响物种丰度,如菊粉和小分子多糖,能增加
Bifidobacterium spp
的丰度,抗性淀粉则能够直接改变菌群的组成,摄入抗性淀粉2能增加
Ruminococcus spp
.
和
Eubacteriumrectale
的丰度,并经过发酵产生
SCFAs
。
4. 短期饮食改变有何影响?
膳食多糖含量的短暂波动会影响到菌群组成,研究认为,饮食结构的转变在
24小时以内就可以引起菌群明显的改变。蛋白与脂肪能够被人体靶向吸收,非淀粉类膳食多糖消化率低,其摄入量的改变可以引起菌群的改变,高脂饮食摄入增多,膳食纤维减少,使得可降解粘液多糖的菌得到富集
,
如
B. thetaiotaomicron
,
能编码更多降解宿主粘液多糖的酶
[5]
。
5.
拟杆菌的
Sus
系统(
starchutilization system
)
Sus
系统是
B. thetaiotaomicron
降解淀粉的主要机制,
Sus
系统涉及到
8
个基因,此系统位于细菌外膜系统,将淀粉绑定在细胞表面,分解成低聚糖,这些片段运输到周质空间,被进一步降解成单糖如葡糖糖,并输入到细胞内,整个过程见
FFigure2
。
B. thetaiotaomicron
的基因组包含多大
88
个相关基因簇,每一种都含有至少
2
个基因(如
susCsusD
)
[6]

a:
Bacteroides thetaiotaomicron
,
依赖于
TonB
的转运子,
SusC
与淀粉绑定脂蛋白
SusD,SusE, SusF
及
SusG
结合。其中
SusG
是糖苷水解酶家族
GH13α-
淀粉酶。刚开始淀粉被
SusG
水解成低聚糖,通过
SusC
与内膜蛋白
TonB
的结合运输到周质空间,其中低聚合度的麦芽糖被其他的
GH13
酶(
SusA
、
SusB
)进一步降解为葡萄糖,被分解的麦芽糖在内膜蛋白
SusR
作用下转运到细胞周质之中。
b.
Bacteroidesovatus,
能编码两种多糖利用系统,降解半纤维素阿拉伯糖,这里展示的是
PUL
系统编码的糖苷水解酶类。胞外脂蛋白位于细胞外膜
OM
上,细胞周质酶在内外膜之间,细胞质膜位于内膜之下。此图表示玉米阿拉伯糖的降解酶组成,
B. ovatus
的各种多糖水解酶根据单糖连接方式的不同而各不相同,两种颜色的表示此家族的酶能降解两种单糖连接方式的阿拉伯糖。
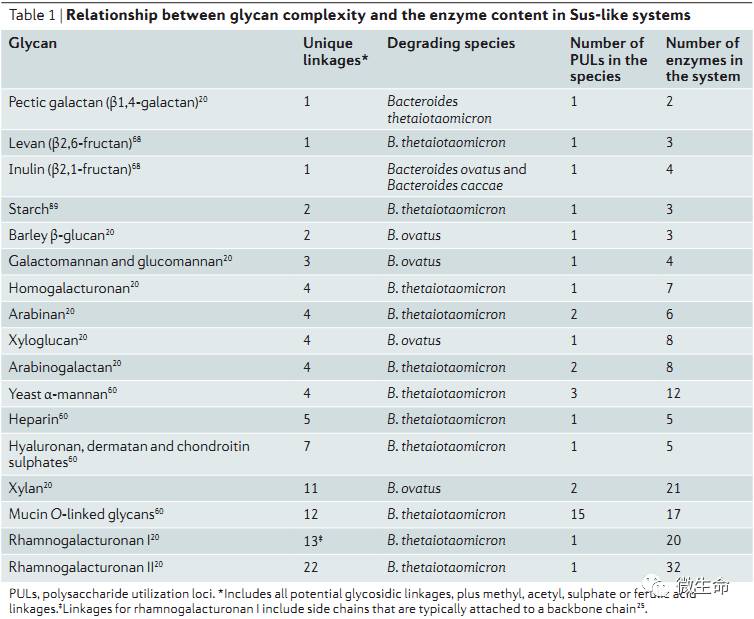
通常微生物一个
Sus
酶解系统所包含酶的种数直接与多糖靶点的复杂性有关,总结如表
1
6. 革兰氏阳性菌对多糖的利用策略
厚壁菌与放线菌中独特的
ABC
转运系统则是第二大类广泛存在的多糖降解吸收系统,厚壁菌编码的多糖水解酶要比拟杆菌少,但
ABC
转运系统更多
。
ABC
系统相邻基因编码糖苷水解酶类的频率较高,说明这些基因是协同发挥作用的。放线杆菌也有
ABC
系统,如
B. infantis
,编码的溶质结合蛋白家族
1
就能利用
HMOs
与粘液多糖。此外,纤维素体被革兰氏阳性菌降解在牛瘤胃与土壤中比较常见,对维生素的降解至关重要,厚壁菌的
Faecalibacterium,Eubacterium
,
Ruminococcus
可能产生相应的纤维素降解酶。
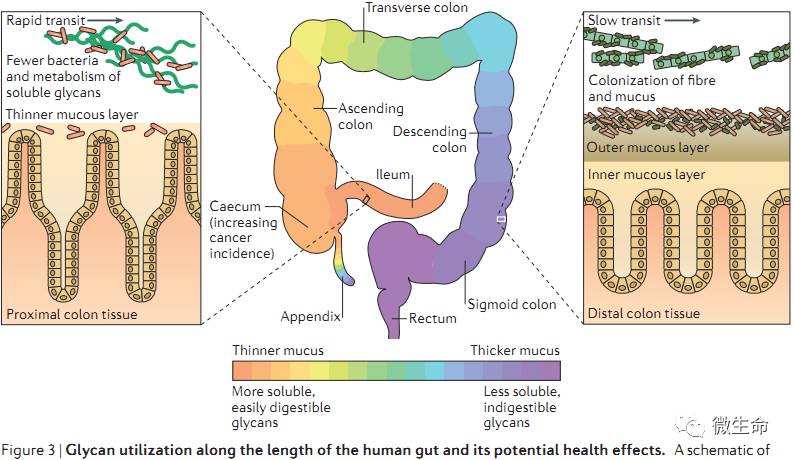
7. 肠道中代谢多糖的部位与速率
膳食多糖的溶解性各不相同,每一种多糖在肠道不同位置被降解、转运的速率也不相同。粘液厚度随肠道成纵向梯度增加,回肠粘液层最薄,肠内容物转运时间最短,细菌多,更容易消化多糖,如菊粉与不同支链的寡糖(
α-
阿拉伯聚糖和
β-
半乳聚糖)。乙状结肠和直肠粘液最厚,大多是不溶或难消化的多糖,粘液层有内层与外层,细菌定植只发生在外层
[7]
。如图
Figure3
所示:
值得注意的是,胃肠道的长度也与微生物组成的差异性有关,人类肠道(从胃到肛门)长达
8
米,近端小肠微生物多样性与密度非常低,只有少数几种存在,在远端小肠、回肠中微生物多样性与密度升高,这也是大多数膳食多糖发酵的位置。向无菌小鼠移植人类粪便,从小肠到盲肠
-
结肠,拟杆菌数量从
14%
增加到
42%
,肠道中多糖的溶解性与利用率的差异可能是影响肠道菌群组成与分布的重要原因
[8]
。
了解膳食多糖与肠道微生物时间与空间的分布,有助于操纵区域特异性的微生物,作为一种更精准的益生菌策略改善肠道健康。
8. 微生物食物链
各种微生物围绕着多糖代谢为中心,在体内形成了复杂的食物链关系
,
代谢产物由
SCFAs
、维生素、气体如图
Figure4
:
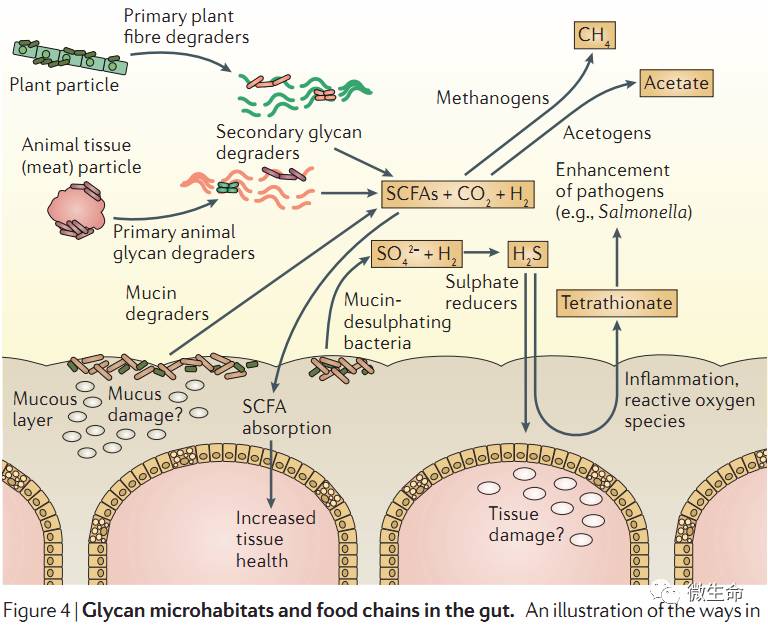
不同的膳食成分包括多糖是如何与微生物相互作用的?目前并不清楚。长期食用高膳食纤维能富集到更多
Prevotella
spp
。
长期食用动物脂肪与蛋白富集更多的
Bacteroides
和
Ruminococcus spp