作者 | Self Renew
编辑 | 勇闯心世界
近期抗体药物领域的一个最重磅的商业事件,就是赛诺菲与比利时的Ablynx公司达成以39亿欧元收购该公司的协议。赛诺菲意向收购Ablynx,看中的无疑是该公司最重要的资产:纳米抗体研发平台和在研项目。加之Ablynx进展最快的项目Caplacizumab已经处于上市申请中,纳米抗体这一概念在业内再次掀起一阵不小的波澜。在此时刻,小编对重链抗体(Heavy-chain antibody, HCAb)进行一番较为全面的总结,与众读者分享。之所以谈的是重链抗体,是因为重链抗体的概念比纳米抗体更为宽泛(在商业上,“纳米抗体”或者“Nanobodies”实际上已经是拥有专利权的专有名词),我们可以从更宏观的视野下探讨这一领域,虽然纳米抗体是商业化运作最为成功的一类。
本文中,小编将重链抗体的概念一拆为三,分别是:骆驼科动物来源的重链抗体、软骨鱼(鲨鱼)来源的重链抗体以及人源重
链抗体库来源的重链抗体。
对天然存在的重链抗体的首次报道是在1993年。当年,布鲁塞尔自由大学的Hamers课题组在《Nature》上发表文章[1],称他们在骆驼的血清中发现了缺少轻链的抗体。

他们用protein A和protein G组合的亲和层析方法分离出的骆驼血清中的IgG成分,发现3种分子量不同的IgG蛋白组分(如下图A中的c-f泳道)。之后,将这3个组分分别跑还原胶和非还原胶(如下图B和C),发现有一种组分(泳道2)经还原后分离为2条带,而另外两种组分(泳道1和3)经还原后均只有1条带。因此研究人员怀疑这两种组分是没有轻链、只有单独重链的抗体。再经过进一步对组分进行凝胶分离和验证之后,这一现象得到了确证。
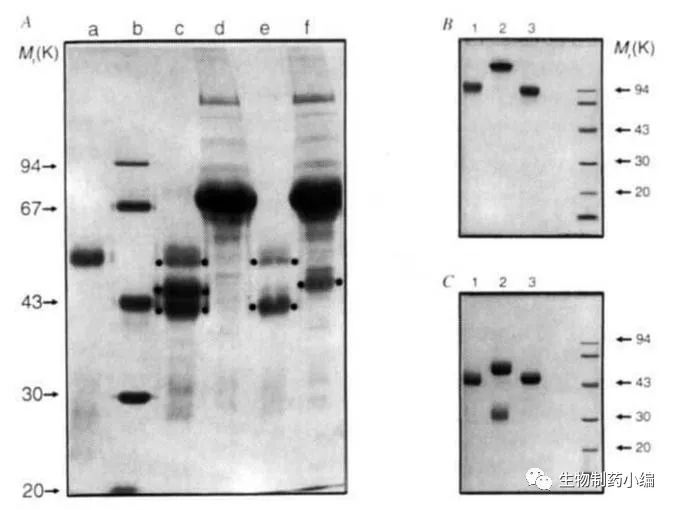
同时,他们又检测了骆驼科其他种属(如羊驼、骆马等)的动物血清,发现这类只有单个重链的抗体在血清中均比较富余。
随后,他们又证实了这些重链抗体对抗原的结合能力,并鉴定出了血清中这2种重链抗体组分(IgG2和IgG3)的结构和序列。
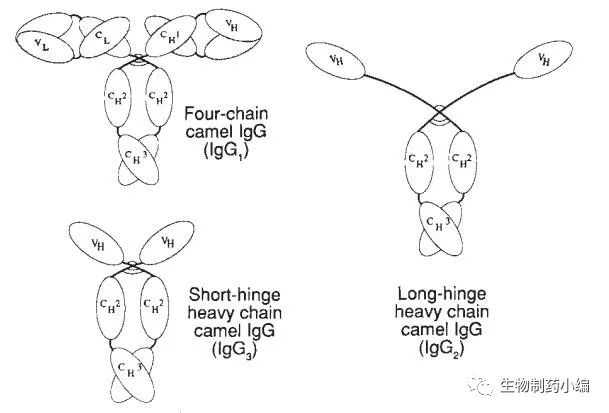
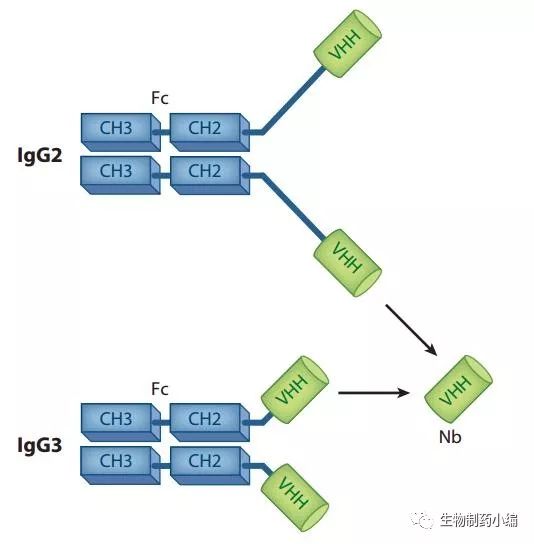
这一发现被公开之后,围绕这种骆驼来源的重链抗体的一系列性质研究和成药性研究在全世界广泛开展。由于抗体的抗原识别功能由可变区决定,因此研究集中在重链抗体的可变区(VHH区域)。由于分子量较小(约15KD),单独的VHH区域又被成为纳米抗体(Nanobody, Nb)。
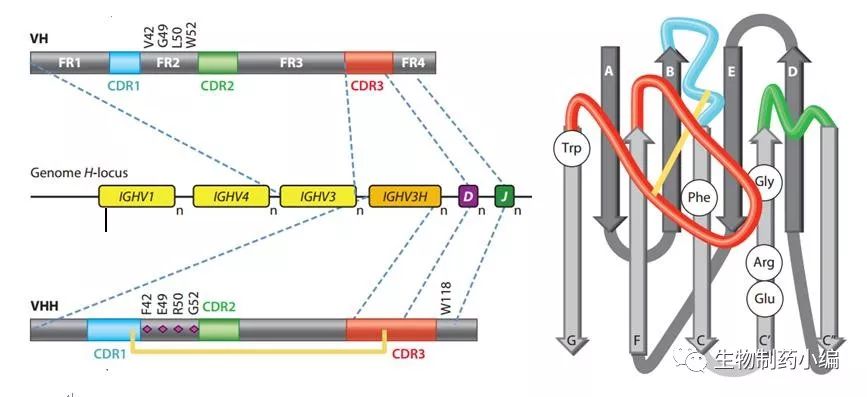
对于纳米抗体,最重要的问题之一就是,缺少轻链的抗体蛋白为什么能够在溶液中稳定存在。传统的抗体,重链的FR2位置具有疏水性,但这一区域是与轻链有相互作用的区域,轻重链之间的这种疏水作用既消减了蛋白整体的疏水性,也有助于稳定抗体的结构;另外,传统抗体的CDR区域的长度有一定的限制。而纳米抗体只有重链,且CDR3区域明显较长(从作用上讲,使得抗体与抗原有更大的接触面积)。它是如何维持构象的稳定性和蛋白的溶解性的呢?
通过Hamers课题组以及其他实验室(基本都来自布鲁塞尔自由大学)对纳米抗体的序列和结构的长期研究[2,3],人们逐渐认识到,传统抗体FR2区域的疏水氨基酸(Val49、Try52等)在重链抗体FR2区域内被亲水的或带电荷的氨基酸取代(Glu49、Arg50等),因此亲水性大大提高;其次,保守的链内二硫键降低了CDR3区域的柔性,使得蛋白整体上较为稳定。
由于纳米抗体只有重链可变区,通过PCR的手段建立基于纳米抗体的体外抗体库较为容易。因此,人们很快就发展出了一套完整的筛选靶向特定抗原的纳米抗体的流程,即:抗原免疫动物、噬菌体文库构建、阳性克隆筛选和鉴定[4]。与传统抗体的噬菌体文库构建相比,纳米抗体文库的构建天然地避免了轻重链错配的问题(单个B克隆技术的发展有助于解决传统抗体库构建的这一问题,但成本明显高很多)。
另外,经过试验,纳米抗体在微生物、哺乳动物细胞和植物细胞表达系统中都能有很高的产量。通过给蛋白添加特定的分泌信号肽和纯化标签,人们就可以进行大量表达和纯化。由于酵母表达能够帮助人们得到很高的产量,可以有效降低成本,因此成为工业界一个非常实用的选项。
经过测试,纳米抗体在稳定性方面的表现非常好,这一类抗体通常能够耐受2.3-3.3 M的胍类物质和60-80℃的高温,部分抗体能耐受90℃以上的高温。在天然结构的基础上,人们也可以通过改造(如在合适位置添加半胱氨酸)进一步提高抗体的稳定性。另外,也可以通过突变去除特定的酶识别位点,提高抗体的耐蛋白酶降解的性质。
相比于传统形式的抗体,纳米抗体能够有效结合抗原上的凹型区域,因此这一类抗体的靶点范围更为广阔,包括多种酶[5]、GPCR蛋白[6]、离子通道[7]等。
另外,由于分子量较小,纳米抗体可能拥有传统抗体不具备的诸多优势,包括组织穿透性强,肾脏清除率高等,这些优势对于纳米抗体在体内成像技术的应用上非常重要。
还有就是纳米抗体的免疫原性的研究。由于纳米抗体在序列上与人源抗体重链的序列较为类似,且分子量较小,因此理论上不会有很强的免疫原性。2004年至2006年之间由比利时自由大学或根特大学发表的几篇文章报道了人们利用纳米抗体作为药物或者靶向给药的“弹头”,研究其在多种小鼠疾病模型中的治疗作用[8-10]。这些研究中均未发现纳米抗体有明显引起小鼠免疫反应的的现象。另外,2009年,比利时自由大学的科研人员开发了一种对纳米抗体进行人源化的方法,将纳米抗体上与人源抗体相应区域中不同的14个氨基酸中的12个进行替换[11]。
这些令人欣喜的研究成果促成了纳米抗体的实际应用,用途包括作为研究工具、疾病诊断、疾病治疗以及其他工业应用。作为研究工具,主要应用在辅助蛋白质结构解析、成像等方面,比如借助纳米抗体解析GPCR结构[12],借助纳米抗体开发单分子成像技术[13]等。
将纳米抗体应用到医药领域并进行商业化最成功的当属Ablynx公司。2001年,基于布鲁塞尔自由大学科研人员开发的Nanobodies技术,Ablynx公司作为布鲁塞尔自由大学的附属单位而成立;2007年,该公司在欧洲交易所主板IPO。如今,该公司已经建立了纳米抗体从早期筛选到工业生产(毕赤酵母表达系统)再到临床应用的完整研发体系:
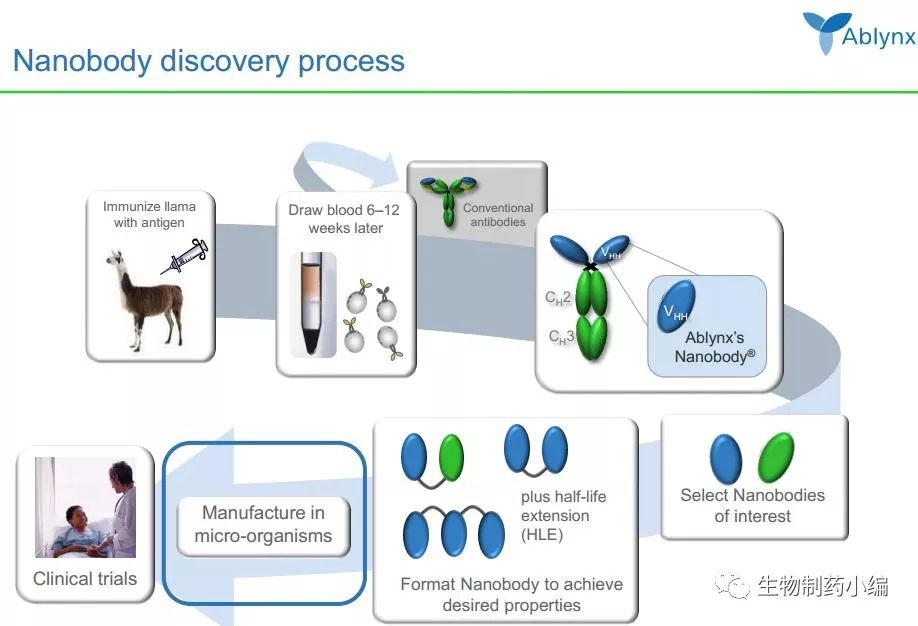
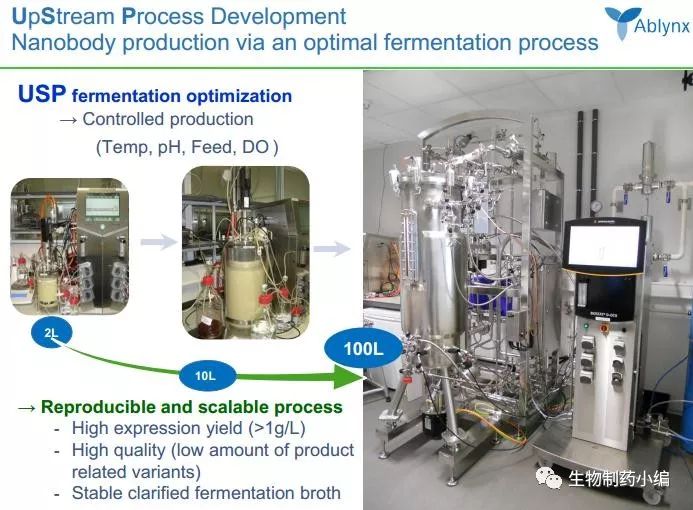
Ablynx称他们拥有超过45个自主研发或合作开发的新药项目,官网上公布了部分在研项目:
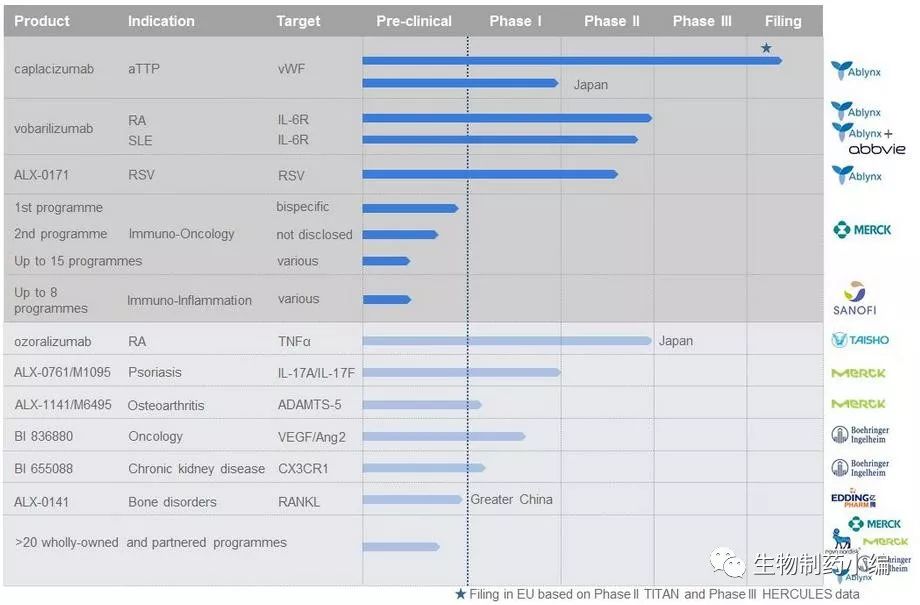
可以看出,该公司已经与多个大型药企建立了合作关系,可见纳米抗体平台的潜力得到了业界的广泛认可。目前,已推进至临床阶段及以上的项目有6个:Caplacizumab、Vobarilizumab、ALC-0171、ALX-0761、Ozoralizumab和ALX-0141。为数不少的抗体项目进入临床阶段,这类抗体的成药性已经得到一定的验证。
在国外,Camel-IDS公司(也是布鲁塞尔自由大学的附属单位)研发用于癌症的分子成像的纳米抗体的开发;另外,还有如Genscript、ProSci Inc、Creative Biolabs这样的CRO公司,为针对临床应用的纳米抗体的开发提供研发外包服务。
在国内的工业界,目前明确利用到纳米抗体技术平台的制药企业有康宁杰瑞、和迈生物和信达生物。
康宁杰瑞公开的研发管线上有两个基于纳米抗体平台开发出来的项目,即KN035和KN044。其中,KN035已经在中国、美国和日本开展多中心I期临床试验;KN044也已进入向CFDA的临床申请阶段。这两个产品均是通过与东南大学的纳米抗体技术平台合作开发。

和迈生物(NanoMab)也拥有自己的骆驼抗体技术平台:
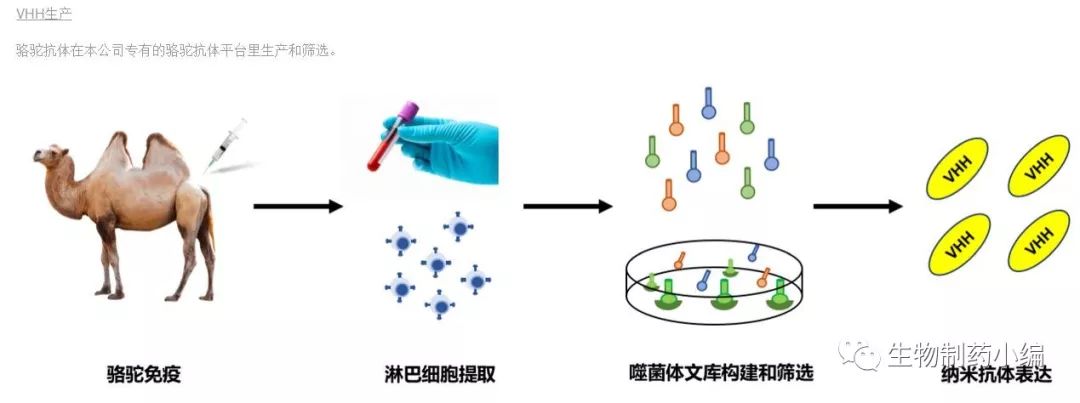
从公司的产品线可以看出,该公司的研发兼顾纳米抗体的治疗和诊断两方面的应用:
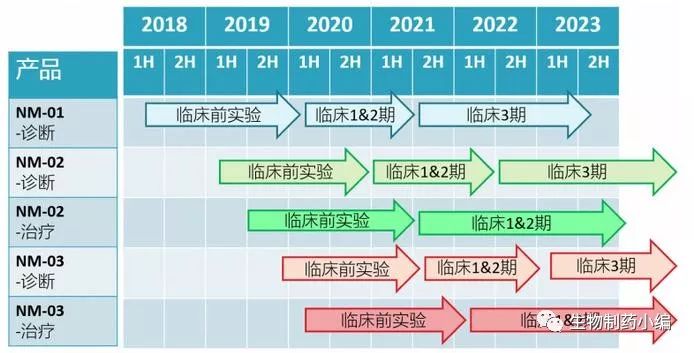
除此之外,还有安必奇生物(Creative Biolabs在中国的唯一代理商)、北京格根生物等生物技术公司,也拥有骆驼抗体技术平台。
而骆驼科动物来源的重链抗体库,算是上述的通过免疫骆驼科动物获取纳米抗体的技术的补充。当抗原是毒素或者其他一些无法引起免疫反应的分子时,通过体外抗体库的筛选获取抗体就十分必要。
建库的策略有三种:通过分离未经免疫或者经免疫的骆驼科动物的淋巴细胞构建天然抗体库,在天然抗体库的基础上引入随机突变构建半合成抗体库,以及以天然的纳米抗体序列为模板,构建全合成的抗体库。Ario de Macro的实验室2009年发表文章,报道了他们分离出未经免疫的羊驼的外周血淋巴细胞并构建体外纳米抗体库的工作[14];而早在2006年,Andrew Hayhurst实验室报道了他们分离未经免疫的羊驼的外周血并构建半合成抗体库的工作[15]。后续的筛选方法较为常规,包括噬菌体展示、细菌展示、酵母展示等。而由于纳米抗体只有一条重链,前期筛选和后期开发的整个流程不涉及结构改造,是一个连贯的过程,因此相比于传统抗体在技术的简洁性方面有明显的优势(传统的全长抗体在展示时会由于表达系统的限制遇到更多的展示效率受损和构象失真的问题,而scFv形式的抗体在后期开发时可能会面临全长改造带来的问题)。
拥有重链抗体库的企业包括Creative Biolabs、Hybrigenics Services、neoclone等,他们都为研究和临床应用所需的纳米抗体的研发提供外包服务。
另一类天然存在的重链抗体就是鲨鱼来源的IgNAR。
1995年,Flajnik等人在《Nature》上发表文章,首报道了在护士鲨体血清中发现了只有一个可变区的免疫球蛋白,并将其命名为“nurse shark antigen receptor”,简称“NAR”[16]。

IgNAR具有一个可变区(VNAR)和5个恒定区。VNAR分子量约13 KD,目前共发现3种类型,结构上略有区别。从整体上来说,这几种VNAR的特点是具有较长的CDR3区域,缺少CDR2区域,以及具有稳定构象的链内二硫键。
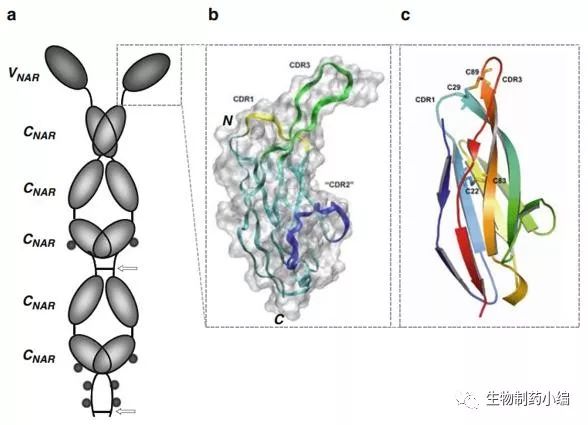
同样,人们很快发展出了一套完整的筛选靶向特定抗原的VNAR的方法,即:免疫鲨鱼,构建VNAR的噬菌体文库,利用噬菌体展示的方法筛选抗体[17]。同样,基于体外文库,人们可以做抗体筛选和抗体的亲和力成熟[18]。另外,人们也发展人源化的方法以期降低VNAR可能存在的免疫原性。
与纳米抗体类似,由于分子量较小,VNAR具有靶点更广谱、组织穿透性更好等优点。
Ossianix在VNAR技术的商业化方面做得较为成功,该公司拥有天然VNAR噬菌体库、半合成VNAR库、基于VNAR的跨血脑屏障技术以及基于VNAR的抗体工程改造技术等。该公司目前已经公开几个在研项目,集中在神经系统疾病和自身免疫病等领域。

Creative Biolabs这些CRO公司也有VNAR文库,可以提供相应的定制服务。
AdAlta公司的i-body技术平台则是VNAR技术的进一步发展,是模拟VNAR结构的一种融合蛋白药物开发平台。公司已公开一个在研项目AD-114,希望用于多个器官纤维化疾病的治疗。
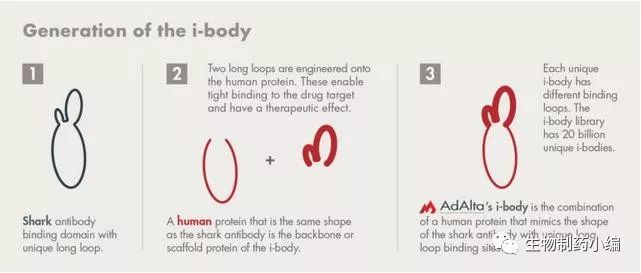
人源重链抗体库可以分为两类:一类是体外抗体库,一类
是人源重链抗体的转基因动物。
1989年发表在《Nature》上的文章中,Greg Winter就提出了人源重链抗体(“single domain antibodies”)的概念[19]。如今,围绕人源重链抗体库的研究也具有了一定的规模。
美国国立癌症研究所(NCI)何苗壮教授实验室的诸多研究,都是基于人源重链抗体库[20,21]。这个库的构建方法发表于2008年[22],据文章所述,研究人员利用天然的人源Fab库通过噬菌体展示技术筛选结合HIV-1表面gp140蛋白的抗体时,发现得到其中的一个binder其轻链DNA序列的起始区域有一个TGA终止密码子。也就是说,这个binder是一个只有重链的抗体。然而,这个抗体能够很好地折叠,具有很好的溶解性且在溶液中为单体,并且可以用原核表达系统大量表达。随后,他们以该抗体为模板,将另外的抗体库中的CDR2和CDR3区域移植到该抗体中,并将CDR1区域的可能与溶剂接触的氨基酸随机突变为A,D,S或Y 这4种氨基酸(以提高抗体的亲水性),得到一个“半天然”的重链抗体库。
另外,也有实验室以人源重链抗体为模板,构建半合成的抗体库,比如多伦多大学Sachdev S. Sidhu教授的实验室。
有体外的人源重链抗体库技术,自然就有利用免疫动物进行人源重链抗体开发的技术,典型的就是和铂医药(Harbour BioMed)的HCAb技术平台(通过收购荷兰的Harbour Antibodies BV公司得到)。
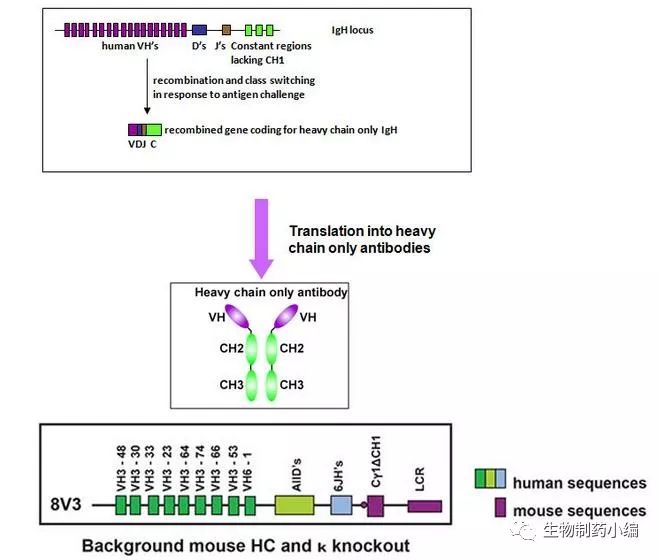
基于该平台,人们可以筛选靶向特定抗原的人源重链抗体,并且可以利用筛选得到的重链抗体开发多种不同结构的抗体药物:
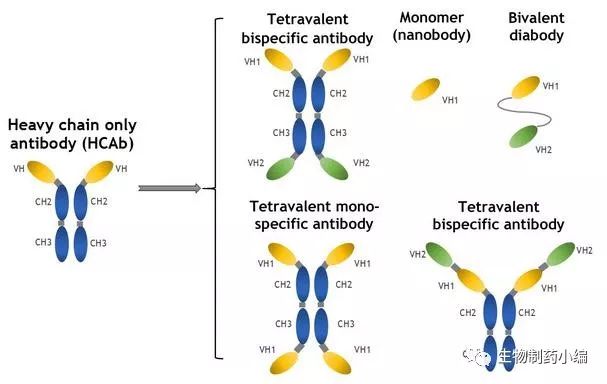
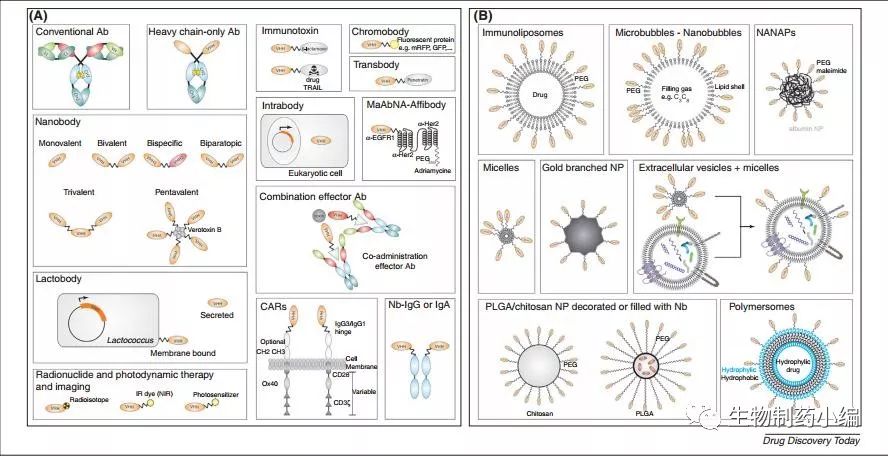
重链抗体,由于其分子量小而具有成药性方面的诸多优势,又由于表达简便而具有生产方面的优势,因此是一种具有吸引力的抗体类型。同时,基于重链抗体结构而设计的融合蛋白药物的开发也取得了进展。
另外,经过这些年的发展,基于重链抗体的技术开发已经层出不穷,包括重链抗体的细胞内筛选、向细胞内递送重链抗体基因的治疗方法的开发、以重链抗体为“弹头”的纳米粒给药系统的开发、重链抗体与双特异性抗体技术的联用等等,这一领域正在吸纳人们几乎无穷无尽的想象力。
但不管如何发展,如何发挥想象力,临床应用是这一领域的最终落脚点,也是我们医药行业永远不变的终极目标。希望我们每位同志,都能兼具一个永恒的信念和一份灵活的思维,将我们的行业不断向前推进。
参考文献
-
Sequence and structure of VH domain from naturally occurring camel heavy chain immunoglobulins lacking light chains.
-
Nanobodies : Natural Single-Domain Antibodies
-
Structure of the Nanobody-Stabilized Active State of the Kappa Opioid Receptor.
-
Single-molecule imaging reveals receptor-G protein interactions at cell surface hot spots.
-
Camel single-domain antibody inhibits enzyme by mimicking carbohydrate substrate.
-
Antibodies targeting G protein-coupled receptors : Recent advances and therapeutic challenges.
-
Nanobodies that block gating ofthe P2X7 ion channel ameliorate inflammation.
-
Efficient Cancer Therapy with a Nanobody-Based Conjugate.
-
Formatted anti–tumor necrosis factor α VHH proteins derived from camelids show superior potency and targeting to inflamed joints in a murine model of collagen-induced arthritis.
-
Experimental therapy of African trypanosomiasis with a nanobody-conjugated human trypanolytic factor.
-
General Strategy to Humanize a Camelid Single-domain Antibody and Identification of a Universal Humanized Nanobody Scaffold.
-
Structure of the Nanobody-Stabilized Active State of the Kappa Opioid Receptor.
-
Single-molecule imaging reveals receptor-G protein interactions at cell surface hot spots.
-
Immunological applications of single-domain llama recombinant antibodies isolated from a naïve library.
-
Facile generation of heat-stable
antiviral and antitoxin single domain antibodies from a semisynthetic llama library.
-
A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks.
-
Selection and characterization of naturally occurring single-domain (IgNAR) antibody fragments from immunized sharks by phage display.
-
Selection and affinity maturation of IgNAR variable domains targeting Plasmodium falciparum AMA1.
-
Binding activities of a repertoire of single immunoglobulin variable domains secreted from Escherichiacoli.
-
Therapeutically targeting glypican-3 via a conformation-specific single-domain antibody in hepatocellular carcinoma.
-
Therapeutically targeting glypican-2 via single-domain antibody-based chimeric antigen receptors and immunotoxins in neuroblastoma.
-
Construction of a Large Phage-Displayed Human Antibody Domain Library with a Scaffold Based On a Newly Identified Highly Soluble, Stable Heavy Chain Variable Domain.
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注
生物制药小编
投稿信箱:[email protected]
小编团队现有18位成员:
Armstrong、医药局外人、Fairy、
Jone、
东胜西牛、Alpharesearcher、MT、百草、Irene、Self Renew
、蛋白工人、At.Zhou、Julia、游方和尚、Grand、夕阳武士、吃瓜群众、Nathan
欢迎有共同兴趣的朋友加入





