八年前,塔瓦佐尼(Tavazoie)家族的三兄弟决定向癌症开战,他们想开发全新的抗癌药物研发平台,以寻找前所未有抗癌新药。
经过数年的努力,2012年,任职于洛克菲勒大学的肿瘤学家索哈伊·塔瓦佐尼(Sohail Tavazoie)在顶级期刊《细胞》上发布了他们的最新抗癌药筛选平台[1]。
这篇文章不仅证实了他们基于RNA层面研发新药的可行性。更重要的是,他们有个意外的发现:
与心血管疾病[2]和阿尔茨海默病[3]有关的载脂蛋白E(ApoE)竟然还是抗癌先锋
。
这个蛋白不仅可以作用于癌细胞,降低癌细胞的侵袭性;还可以作用于血管内皮细胞,阻止新血管的生成
。

索哈伊·塔瓦佐尼
癌细胞转移的主动性被抑制了,转移的通道也没了,这一下子就把癌细胞困在原发灶了。不过,癌细胞不会坐以待毙,它会产生几种小RNA,干扰ApoE的生成,然后顺利脱离原发灶。
机制倒是搞清楚了。但ApoE能抗癌?这可是头一回听说。
为了进一步证实ApoE的抗癌能力。索哈伊团队查询了不少资料。
实际上早在上个世纪九十年代,有三个独立的实验室[4-6]从肝脏里面发现了一个叫
肝X受体
的基因。数年之后,研究人员发现,
这个基因参与到了脂质代谢的调控
。其中,
ApoE
基因的表达,就是受
肝X受体
调控的
[7]。
一直以来被我们视为“好”脂蛋白的高密度脂蛋白的形成就与ApoE有关
。因此,一大波的药企看到了治疗动脉粥样硬化的机会,纷纷开发靶向肝X受体的激动剂,以促进ApoE的生成。2002年加州大学圣迭戈分校的Peter Tontonoz教授与葛兰素史克的科学家率先在小鼠体内证实,
肝X受体激动剂GW3965可以促进
ApoE
基因的表达,抑制动脉粥样硬化的发展
[8]。
既然GW3965可以促进
ApoE
基因的表达,那索哈伊团队接下来要做的事情就简单多了。他们决定直接在癌症模式小鼠身上试试GW3965,看看效果。
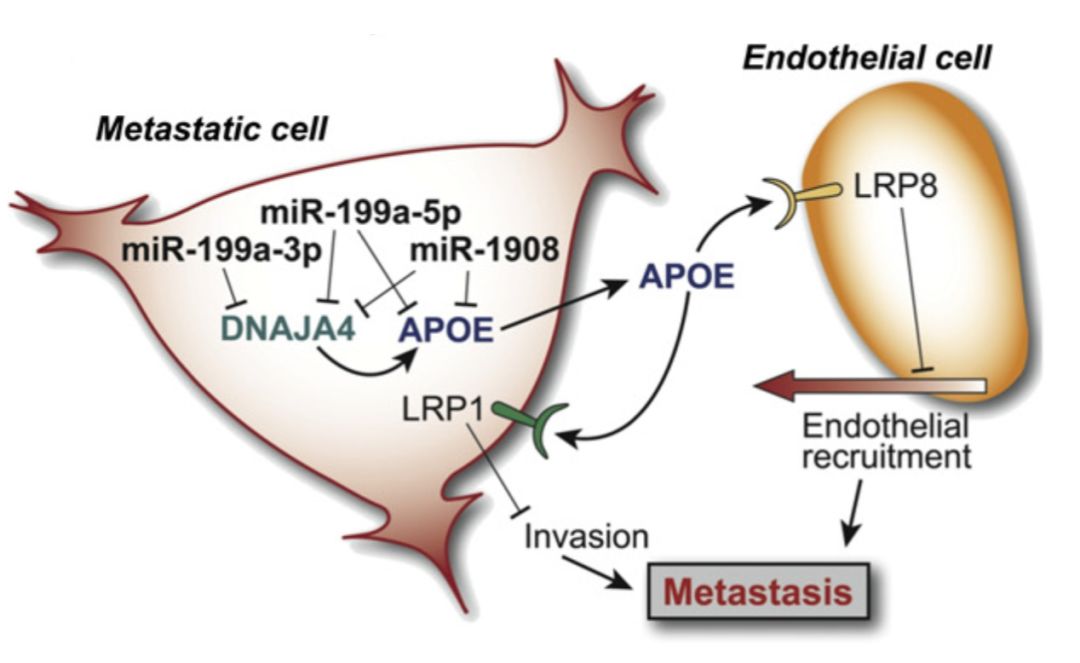
正常细胞合成ApoE蛋白的能力,在癌细胞里面被抑制了。癌细胞表面的LRP1没有见到ApoE就「唆使」癌细胞转移,血管内皮细胞表面的LRP8没有见到
ApoE就开启血管生成模式[1]。
经过2年左右的努力,2014年索哈伊团队再次在《细胞》上发文,
证实
肝X受体
激动剂GW3965可以促进
ApoE
基因的表达,抑制肿瘤的生长和转移,而且他们还发现,将GW3965与免疫检查点抑制剂CTLA-4抗体等抗癌药物联用,可以大幅提高抗癌效果
[9]。
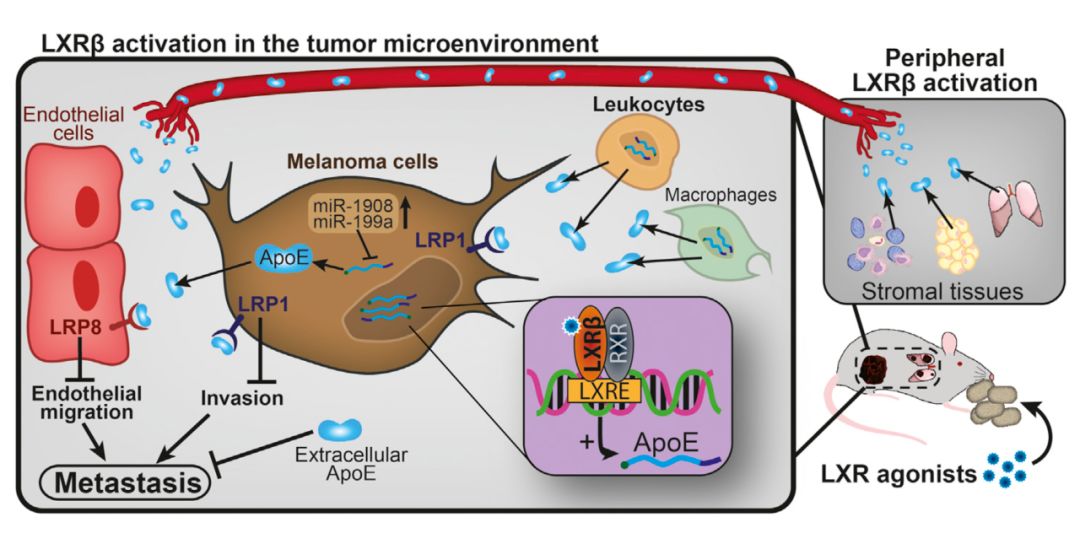
LXR激动剂GW3965可以促进多种组织器官合成ApoE,抑制癌细胞的转移和血管生成[9]
这个研究确定了肝X受体可以作为治疗癌症的新靶点。但是,让他们没想到的是,GW3965给他们准备了一个更大的惊喜。
除了降低癌细胞的侵袭性和抑制血管的生成,
肝X受体激动剂GW3965有可能还具备激活免疫系统的能力
。这让索哈伊很是兴奋,毕竟免疫治疗现在可是炙手可热。
但是当时,他们并不知道背后的具体作用机制是什么。
正是凭借这个研究,索哈伊和他另外两位兄弟,哥伦比亚大学的马苏德(Masoud)和赛义德(Saeed),于2010年联合创办的Rgenix获得了投资人的青睐,顺利拿到融资[10]。

中间三人是塔瓦佐尼家族的三兄弟(左到右
:
索哈伊、
赛义德、
马苏德
)
他们清楚的认识到,如果想想在免疫治疗时代获得更大的成功,他们必须拿下GW3965,并阐明GW3965激活免疫系统背后的机制。
巧的是,葛兰素史克在开发GW3965的过程中,发现GW3965会意外的增加体内甘油三酯的水平,这会增加患者心脏病发作的风险。由于GW3965摆脱不了这个负面因素,整个项目就被束之高阁[10]。
由于索哈伊从GW3965中看到了抗癌效果,
Rgenix理所当然地从葛兰素史克那里获得了GW3965的开发授权,并将其命名为RGX-104
[10]。
那么RGX-104到底能不能激活免疫系统?这是个迫在眉睫的重要问题。
马苏德加入了索哈伊团队,一起攻克这个最关键的难题。
经过4年左右的努力,他们终于揭开了所有的谜团。
2018年年初,马苏德作为一作,索哈伊作为通讯作者的重磅研究又一次发在了《细胞》上[11]。这一次他们证实,
RGX-104除了前面介绍过的功能之外,还可以通过促进ApoE的产生,降低体内免疫抑制细胞“骨髓来源的抑制性细胞(MDSCs)”的水平,解除肿瘤对杀伤性T细胞的免疫抑制
。
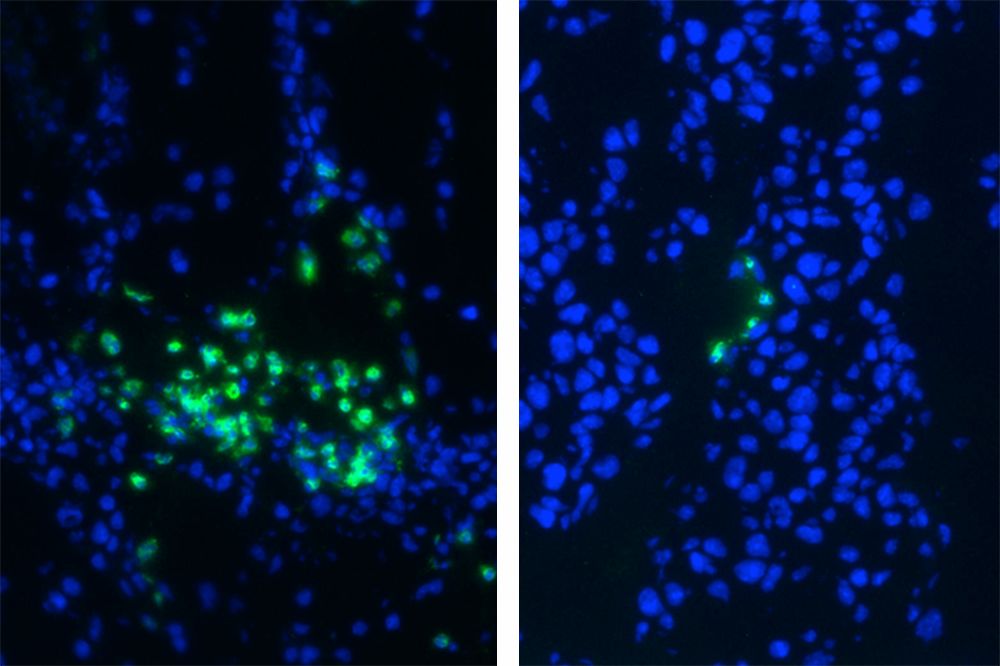
RGX-104处理后,骨髓来源的抑制性细胞(绿色)大量减少
更重要的是,随这篇文章发表的,还有
RGX-104治疗实体瘤和淋巴瘤的I期临床试验的早期数据
[12]。
六名已经接受治疗患者的数据显示,RGX-104确实可以降低癌症患者体内的MDSCs,免疫反应被激活,可能对多种癌症有效
。
至此,肝X受体激动剂RGX-104就具备了三大抗癌功能:
降低癌细胞的转移性,抑制肿瘤血管的形成,以及解除肿瘤对杀伤性T细胞的免疫抑制
。这就厉害了。
对于MDSCs,大部分人可能还比较陌生。不过不要紧,因为要不了多久,你就会发现它占据各大媒体头条。
在癌症免疫治疗的大背景下,属于MDSCs的时代来了
[13]。
大约在2005年左右,有一大批科学家发现,一种骨髓来源的免疫细胞在癌症的发展过程中起到了推波助澜的作用[14-19]。
但是呢,研究虽多,但是对于这类细胞却没有一个统一的名字,导致这个领域的研究比较混乱。
到2007年,Dmitry Gabrilovich等7位免疫学领域专家看不下去了,他们建议把这些细胞称为“骨髓来源的抑制性细胞”
[20],一直沿用至今。
名正,则言顺。后面的研究就顺利多了。
如今我们已经知道,MDSCs与PD-1/PD-L1等免疫检查点一起,是肿瘤对T细胞展开免疫抑制的两大主力军。目前针对PD-1/PD-L1通路的新药,已然改变了癌症的治疗格局。
靶向MDSCs的疗法,目前还没有一款获得FDA的批准
,不过MDSCs的重要性是越来越凸显了。
实际上,
MDSCs是癌症等病理因素诱导产生的,它的最主要的特点就是抑制T细胞的能力,促进疾病的发生和进展
[13]。
而且MDSCs不仅可以直接抑制T细胞的活性,还可以分化成肿瘤相关巨噬细胞和炎性树突细胞
[21,22]。肿瘤相关巨噬细胞可以抑制T细胞的活性,促进肿瘤的生长[23,24],这个我们之前的文章也做了非常详细的阐述。而炎性树突细胞也具有类似的活性[25-27]。
越来越多的研究表明,
外周血MDSCs与结直肠癌,乳腺癌,膀胱癌,甲状腺癌和非小细胞肺癌分期,以及肿瘤负荷呈正相关
[28-33]。
在笔者看来,
RGX-104不仅限制了肿瘤的转移,更重要的是它还打破了肿瘤对T细胞的免疫抑制这个金钟罩
。故而,RGX-104能取得良好的治疗效果也是理所当然的事情。
不过,目前RGX-104也面临着治疗心脏病时遇到的问题,它对甘油三酯的影响究竟有多大,会不会给癌症患者造成不利的影响。待他们的这个临床研究结束,谜底就会揭晓了。


参考资料:
1. Pencheva N, Tran H, Buss C G, et al. Convergent Multi-miRNA Targeting of ApoE Drives LRP1/LRP8-Dependent Melanoma Metastasis and Angiogenesis[J]. Cell, 2012, 151(5): 1068-1082.
2. Eichner J E, Dunn S T, Perveen G, et al. Apolipoprotein E polymorphism and cardiovascular disease: a HuGE review[J]. American journal of epidemiology, 2002, 155(6): 487-495.
3. Liu C C, Kanekiyo T, Xu H, et al. Apolipoprotein E and Alzheimer disease: risk, mechanisms and therapy[J]. Nature Reviews Neurology, 2013, 9(2): 106.
4. Apfel R, Benbrook D M, Lernhardt E, et al. A novel orphan receptor specific for a subset of thyroid hormone-responsive elements and its interaction with the retinoid/thyroid hormone receptor subfamily.[J]. Molecular and Cellular Biology, 1994, 14(10): 7025-7035.
5. Song C, Kokontis J M, Hiipakka R A, et al. Ubiquitous receptor: a receptor that modulates gene activation by retinoic acid and thyroid hormone receptors.[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(23): 10809-10813.
6. Willy P J, Umesono K, Ong E S, et al. LXR, a nuclear receptor that defines a distinct retinoid response pathway.[J]. Genes & Development, 1995, 9(9): 1033-1045.
7. Laffitte B A, Repa J J, Joseph S B, et al. LXRs control lipid-inducible expression of the apolipoprotein E gene in macrophages and adipocytes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(2): 507-512.
8. Joseph S B, Mckilligin E, Pei L, et al. Synthetic LXR ligand inhibits the development of atherosclerosis in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(11): 7604-7609.
9. Gabrilovich D I, Bronte V, Chen S, et al. The Terminology Issue for Myeloid-Derived Suppressor Cells[J]. Cancer Research, 2007, 67(1): 425-425.
10. https://www.xconomy.com/new-york/2015/08/31/in-new-york-rgenix-rises-from-rockefeller-and-takes-aim-at-cancer/?single_page=true
11. Tavazoie M F, Pollack I, Tanqueco R, et al. LXR/ApoE Activation Restricts Innate Immune Suppression in Cancer[J]. Cell, 2018.
12. https://clinicaltrials.gov/ct2/show/NCT02922764?term=NCT02922764&rank=1
13. Veglia F, Perego M, Gabrilovich D. Myeloid-derived suppressor cells coming of age[J]. Nature immunology, 2018: 1.







