
 蛋白在基因表达以后,还要经过不同程度的修饰(例如磷酸化、糖基化、乙酰化、甲基化、泛素化等)才能发挥所需的功能,这种翻译后修饰过程受到一系列修饰酶和去修饰酶的严格控制,使得在某一瞬间细胞中蛋白表现出稳定或动态的特定功能。在真核细胞中存在着超过200种以上的蛋白翻译后修饰过程,其中大约70%目前还无法解释。同时有充足的理由认为,这种经过了特定修饰的蛋白质,更客观地反映了细胞的各种生理以及病理过程。这就催生了一个全新的研究领域—翻译后修饰蛋白质组学。
蛋白在基因表达以后,还要经过不同程度的修饰(例如磷酸化、糖基化、乙酰化、甲基化、泛素化等)才能发挥所需的功能,这种翻译后修饰过程受到一系列修饰酶和去修饰酶的严格控制,使得在某一瞬间细胞中蛋白表现出稳定或动态的特定功能。在真核细胞中存在着超过200种以上的蛋白翻译后修饰过程,其中大约70%目前还无法解释。同时有充足的理由认为,这种经过了特定修饰的蛋白质,更客观地反映了细胞的各种生理以及病理过程。这就催生了一个全新的研究领域—翻译后修饰蛋白质组学。
翻译后修饰过程显著地增加了蛋白质的复杂性和多样性,在众多生命进程中发挥着关键作用。然而,蛋白翻译后修饰种类多样、修饰前后位点差异不显著、在生物样本中的含量很低、微观表达不均一、且极易受到高丰度非修饰肽链的干扰,这些因素严重阻碍了基于质谱技术的蛋白质组学的分析和鉴定工作。因此,在进行质谱鉴定前,必须对目标肽段进行高效的选择性富集和分离。常规的富集材料和方法能够部分满足组学富集的需求,但是对于蛋白多位点磷酸化、糖基化、甲基化、糖链结构精细解析等诸多挑战性的难题却无能为力,急需开发新颖的材料和方法来应对日益复杂的组学分析的要求。
武汉理工大学材料复合新技术国家重点实验室
的
孙涛垒教授、卿光焱研究员
课题组
在利用智能聚合物解决糖肽富集难题方面,开展了一系列的研究工作
(Angew. Chem. Int. Ed., 2014, 53, 930; ACS Applied Materials & Interfaces, 2015, 7, 27223; 2016, 8, 13294; 2016, 8, 22084; Scientific Reports, 2017, 7, 40913; Chem. Commun. 2015, 51, 16111),设计了基于二肽-糖或糖-糖相互作用的新型糖肽识别和富集体系,材料将对糖肽的高选择富集和对糖链结构的精细区分融为一体,代表了新一代富集材料的特征和发展的趋势;同时打破了疏水材料无法应用于亲水性糖肽富集的限制,揭示了主流的亲水材料无法实现高选择富集的原因。
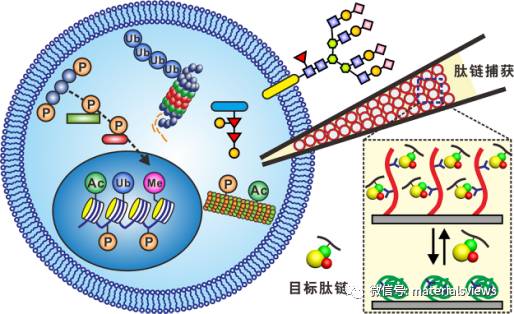
近期,孙涛垒教授等人撰写了一篇研究展望,分析了翻译后修饰蛋白组学富集材料领域面临的难点和挑战,系统总结了面向蛋白磷酸化或糖基化的聚合物基富集材料,重点论述了智能聚合物在这些领域应用的可能性和优越性。
在此基础上,他们创新性地提出了理想的翻译后修饰富集材料应具有的五个特征:1、对目标肽链高的亲和力;2、能够显著地区分翻译后修饰肽链与干扰肽链;3、对目标肽链的结合力高度可调;4、材料应具有优异的可逆性,可望大幅降低使用的成本,提升实验数据的可重复性;5、易扩展的材料设计平台,能够应用于不同类型的翻译后修饰。这五个特征为材料的设计和开发提出了很高的要求,受限于固有的缺陷,传统的富集材料往往难以满足这些要求。而智能聚合物,特别是生物分子响应性聚合物,为解决这些挑战,提供了很好的材料学平台。
孙涛垒教授等人预测智能聚合物将成为蛋白富集材料开发中一个活跃的研究方向,其新颖的设计理念将为解决翻译后修饰肽链的富集和分离难题,提供一条新的途径。同时,由于全新的肽链捕获模式和高度可控的吸附/脱附行为,更多有价值的蛋白翻译后修饰位点将会被鉴定和发现,这将有力地推动后续的生物学和医学研究。此外,翻译后修饰蛋白质组学也将继组织工程、药物控制释放、微流控芯片、生物分离等之后,成为智能聚合物材料一个新的应用领域,孕育着巨大的机遇和挑战。相关研究成果发表于Advanced Materials(DOI: 10.1002/adma.201604670)上。
文献链接:
http://onlinelibrary.wiley.com/doi/10.1002/adma.201604670/abstract

来源:Materialsviews
声明:凡本平台注明“来源:XXX”的文/图等稿件,本平台转载出于传递更多信息及方便产业探讨之目的,并不意味着本平台赞同其观点或证实其内容的真实性,文章内容仅供参考。
我们的微博:
高分子科学前沿
,
欢迎和我们互动
。
在菜单中
回复
“
交流群
”:可加入学术圈,
企业界
及
一系列技术交流群
投稿 荐稿 合作:[email protected]






