

何首乌为蓼科何首乌属植物何首乌
Polygonum
multiflorum
Thunb.
的干燥块根,《中国药典》
2015
年版一部中收录了何首乌和制何首乌。何首乌有解毒、消痛、润肠通便的功效,制何首乌可补肝肾、益精血、乌须发、强筋骨、化浊调脂
[1-3]
,历来为古今医家、饮食家所推崇,临床应用颇广。然而,近年来国内外有关何首乌及其制剂不良反应,尤其是肝脏毒性的报道日渐增多,其安全性问题引起社会各界的广泛关注
[4-7]
。历代医家均强调炮制入药,早在《本草汇言》中已明确提出何首乌“生用有毒,炮制减毒”思想,与现代多数文献认为的炮制方法可影响何首乌安全性或有效性观点一致
[8-14]
。然而,何首乌炮制减毒过程中可能发生了极其复杂的变化,如何揭示这些变化,并与中医临床相关联,是何首乌质量安全性评控的难点和重点问题之一,也是筛选何首乌可能毒性物质的重要手段
[15-16]
。
何首乌化学成分主要包括蒽醌类、二苯乙烯苷类、磷脂类等,其质量以往多以蒽醌衍生物及二苯乙烯苷的量作为评价指标
[1-2]
。近年来,由于中药指纹图谱能较全面地反映药材所含化学成分的相对关系,体现中药成分的复杂性和相关性,已成为国内外广泛接受的一种中药或天然药物的质量评价模
式
[15,17-18]
。但其不能体现化学成分是否代表发挥药效的活性物质,故单纯的指纹图谱在中药质量评价中难以实施。因此,本实验将何首乌炮制前后指纹图谱中的化学成分的变化与其整体毒性评价
[19-22]
相结合,通过研究其相关性,寻找与毒性相关的物质群,为何首乌的质量控制标准及安全性评价提供参考和依据。
1
仪器与材料
ZK-82B
型真空干燥箱,上海市实验仪器总厂,
W12PCS505E
电压力锅,美的集团;
Agilent Technology 1290Infinity UPLC
超高效液相色谱仪,
AgilentTechnology iFunnel 6550 LC-Q-TOF /MS
四级杆串联飞行时间质谱,
G4212A 1290
二极光阵列检测器;
AL204
型微量分析天平,瑞士
MettleToledo
公司;旋转蒸发仪,德国
Heidolph
公司;恒温二氧化碳培养箱,
NAPCO
公司;台式低速离心机,湖南赫西仪器装备有限公司;
SN510C
高压蒸汽灭菌器,重庆雅马拓科技有限公司。
经解放军第三〇二医院肖小河研究员鉴定,生首乌(批号
13101701
,北京绿野药业有限公司,产地湖北)为蓼科何首乌属植物何首乌
Polygonum
multiflorum
Thunb.
的干燥块根,小黑豆(批号
12021507
,购自北京绿野药业有限公司)为豆科植物大豆
Glycine max
(L.) Merr.
的干燥成熟种子;
DMEM
培养基(批号
1552738
)、胎牛血清(批号
505985
)、
0.25%
胰酶(批号
1155756
)、青链霉素(批号
ZC03418
)均购于美国
Gibco
公司;人正常肝细胞系
L02
细胞株购自中国典型培养物保藏中心;
Cell Counting Kit-8
(
CCK-8
,批号
GD619
)购自日本同仁化学研究所;
PBS
(批号
20140918
)购于北京索莱宝科技有限公司;对照品对乙酰氨基酚(批号
100018-200408
,质量分数≥
98.59%
)购自中国食品药品检定研究院,顺式二苯乙烯苷(批号
14091807
,质量分数≥
98%
)、反式二苯乙烯苷(批号
14051503
,质量分数
≥
98%
)、大黄素(批号
14030604
,质量分数
≥
98%
)、大黄素甲醚(批号
13110706
,质量分数
≥
98%
)、大黄素
-8-
O
-β-
D
-
葡萄糖苷(批号
14081501
,质量分数
≥
98%
)、儿茶素(批号
13091702
,质量分数
≥
98%
)、没食子酸(批号
13121803
,质量分数
≥
98%
)均购自成都普菲德生物技术有限公司;乙腈、甲醇,色谱纯,
Sigma
;纯净水,杭州娃哈哈集团有限公司;超纯水,
Millipore Milli-Q water purification system
;无水乙醇,分析纯,北京市化工厂。
2
方法
2.1
何首乌炮制品制备
将所购何首乌饮片(
500 g
)置带盖不锈钢桶中,加入黑豆汁
125 g
(取黑豆
100 g
,加水适量,煮约
4 h
,熬汁约
150 g
,豆渣再加水煮约
3 h
,熬汁约
100 g
,合并得黑豆汁约
250 g
)
[1]
,按液体量
80%
闷润
8 h
至透心,分别高压清蒸
0
、
6
、
12
、
24
、
36
、
48
、
72
、
84
、
96 h
,置于
45
℃烘箱中烘干,备用
[23-25]
。
2.2
基于
UPLC-Q/TOF-MS
技术的何首乌化学指纹图谱的建立
2.2.1
色谱条件
色谱柱为
Agilent300SB-C
18
柱(
100 mm
×
2.1 mm
,
1.8 μm
);流动相为水
-
乙腈,线性梯度洗脱:
0
~
5 min
,
95%
~
68%
水;
5
~
6 min
,
68%
~
45%
水;
6
~
12 min
,
45%
~
12%
水;
12
~
15 min
,
15%
~
10%
水;柱温
30
℃;体积流量
0.3 mL/min
;检测波长
280 nm
;洗脱时间
15 min
;进样量
0.5 μL
。理论板数按反式二苯乙烯苷峰计算不低于
2 000
。
2.2.2
质谱条件
离子源
ESI
;毛细管电压及锥孔电压分别为
4 000 V
和
45 V
;
m
/
z
50
~
1 000
;脱溶剂气温度
225
℃;脱溶剂气流量
11L/min
;雾化器压力
310.275kPa
(
45 psi
);鞘气温度
350
℃;鞘气体积流量
12 L/min
;喷嘴电压
500 V
。
2.2.3
供试品溶液制备
课题组前期研究表明
50%
乙醇冷浸提取何首乌的肝细胞毒性较强,本实验采取
50%
乙醇制备样品
[26]
。取何首乌粗粉(过
40
目筛)适量,精密称定,加入
10
倍量
50%
乙醇,超声提取
30 min
,滤过取滤液,减压蒸馏,真空干燥得何首乌干浸膏,计算得率。精密称取适量的何首乌样品醇提物干浸膏,置于
10 mL
量瓶中,加
50%
乙腈,超声溶解,放冷,补加溶剂至刻度,摇匀,
0.22 μm
滤膜滤过,配制成
4 mg/mL
(以生药量计)的供试品溶液
[27]
。
2.2.4
对照品溶液制备
分别精密称取顺式二苯乙烯苷、反式二苯乙烯苷、大黄素、大黄素甲醚、大黄素
-8-
O
-β-
D
-
葡萄糖苷、儿茶素、没食子酸适量于
10 mL
量瓶中,加入
50%
甲醇,超声溶解,放冷,补加
50%
甲醇溶剂至刻度,摇匀,
0.22 μm
滤膜滤过,配制成质量浓度分别为顺式二苯乙烯苷
50.900 μg/mL
、反式二苯乙烯苷
51.300 μg/mL
、大黄素
49.200 μg/mL
、大黄素甲醚
53.100 μg/mL
、大黄素
- 8-
O
-β-
D
-
葡萄糖苷
48.800 μg/mL
、儿茶素
50.000 μg/mL
、没食子酸
50.100 μg/mL
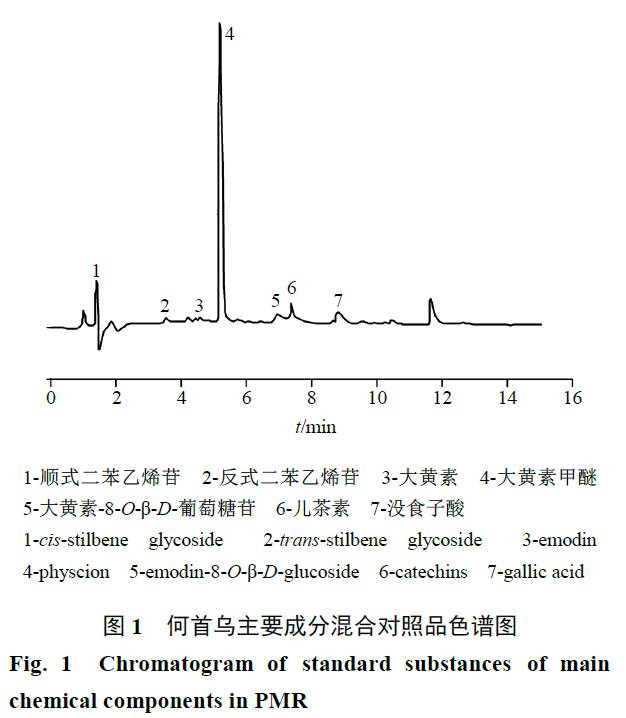
的混合对照品溶液,其色谱图谱见图
1
。
2.3
何首乌肝细胞毒性评价
取适量生首乌和不同炮制时间的制何首乌饮片,分别加
8
倍量
50%
乙醇,置阴凉处密封,冷浸提取。共提取
2
次,每次
48 h
,合并提取液,浓缩至相应质量浓度备用
[23-25]
。将人正常胚肝细胞系
L02
细胞以
3.5
×
10
4
/mL
接种于
96
孔细胞培养板中,每孔
200μL
,在常规条件下培养
24 h
后,吸弃上清,将何首乌醇提物分别以生药量
40 mg/mL
给药,对乙酰氨基酚溶液按
1.7 mg/mL
给药
,
每孔
200 μL
,设
6
复孔。药物孵育
24 h
后,吸弃上清,每孔加入
10%CCK-8
溶液
100 μL
。培养箱内反应
30 min
后,
450 nm
处检测吸光度(
A
)
[26,28]
。
以对乙酰氨基酚对照品溶液为对照组(
s
),不同炮制时间
何首乌醇提物
样品溶液为供试
品组(
t
),分别测定对照品、供试品及空白对照吸光度(
A
s
、
A
t
、
A
ctr
),计算不同炮制时间何首乌醇提物细胞抑制率。
抑制率=
1
-
(
A
t
-
A
ctr
)/(
A
s
-
A
ctr
)
3
结果
3.1
指纹图谱方法学考察
取不同炮制时间炮制品,以
50%
乙醇为溶剂,按供试品溶液制备方法制备样品,分别进行精密度试验、重复性试验、稳定性试验,计算各色谱峰的相对峰面积与相对保留时间。结果显示各共有峰的相对保留时间和相对峰面积的
RSD
均小于
3%
,表明方法进样精密度及重复性良好,且供试品在
24 h
内稳定,符合指纹图谱测定要求。
3.2
何首乌生品及不同炮制品指纹图谱表征及成分量变化
采用“
2.1
”和“
2.2
”项下所述样品制备方法和液相质谱条件表征何首乌生品及不同时间炮制品化学指纹图谱,运用《中药指纹图谱相似度评价系统
2004 A
版》软件,以平均数方法通过自动匹配获得对照指纹图谱(
R
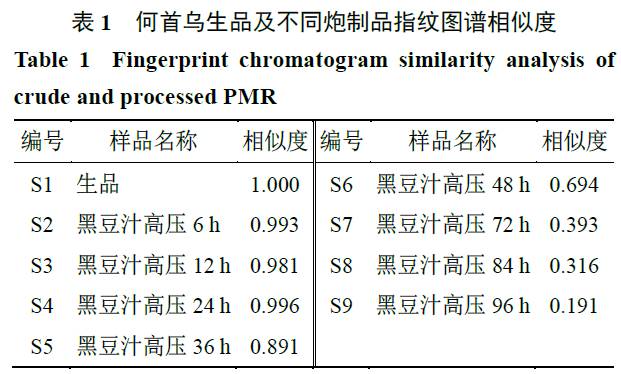
),所得何首乌生品及不同时间炮制品与对照指纹图谱的相似度差异较大(表
1
,图
2
)。通过提取相应物质的离子流色谱图信息、对照品各成分色谱峰信息及相关参考文献,标定
7
个共有指纹峰,初步鉴定为反式二苯乙烯苷、没食子酸、大黄素、大黄素甲醚、大黄素
-8-
O
-β-
D
-
葡萄糖苷、顺式二苯乙烯苷、儿茶素。
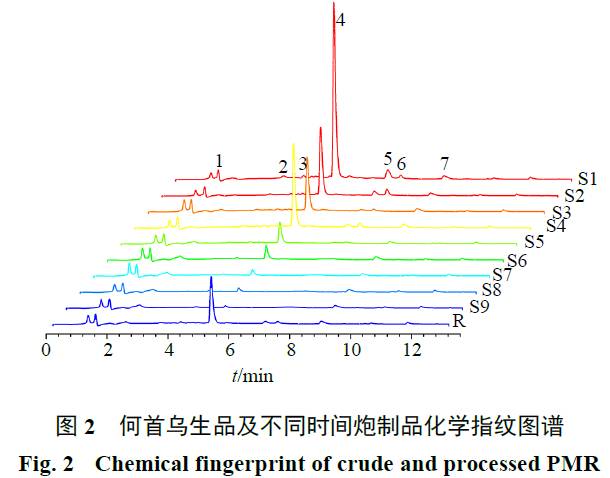
何首乌生品在炮制过程中,随着炮制时间的增加,各成分变化趋势不相同,如图
3
所示,反式二苯乙烯苷、大黄素
-8-
O
-β-
D
-
葡萄糖苷量随炮制时间增加呈现明显下降趋势;大黄素甲醚量炮制前期变化不大,当炮制第
72
小时之后,其量迅速下降;儿茶素量随炮制时间增加而下降,到第
36
小时,儿茶素量降为零;大黄素较稳定,其量无明显变化。说明反式二苯乙烯苷、大黄素
-8-
O
-β-
D
-
葡萄糖苷、大黄素甲醚、儿茶素受炮制时间影响较大。
3.3
何首乌生品及不同炮制品体外肝毒性评价结果
采用
CCK-8
检测方法评价何首乌生品及不同炮制品对人正常胚肝细胞系
L02
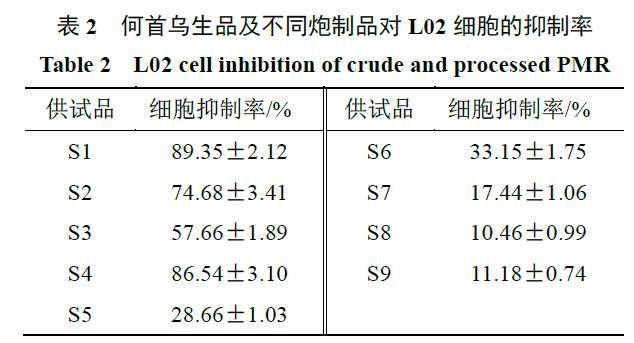
细胞的生长抑制情况。由表
2
可知,何首乌在炮制
36 h
之前抑制率均大于
50%
,尤其生首乌高压黑豆汁蒸至
24 h
细胞抑制率较高,可能这个过程发生化学反应促进毒性物质生成;何首乌炮制
36h
之后,细胞抑制率都较低,在
30%
以下,并且随着炮制时间的增加而进一步降低。由此可知,何首乌炮制
36 h
后才能达到减毒的效果。
3.4
何首乌主要成分与毒性相关分析
实验结果显示何首乌生品及不同炮制品肝细胞毒性差异较大,同时不同何首乌药材中
7
种主要成分的色谱峰峰面积差异也较大,这些差异是否会造成其肝毒性,具体哪些成分在其肝毒性起主要贡献作用,为明确成分与生物效应的关系,首先,采用简单相关分析,进一步将化学成分和细胞毒性进行多元线性回归分析,寻找与其毒性相关的主要化学成分。
3.4.1
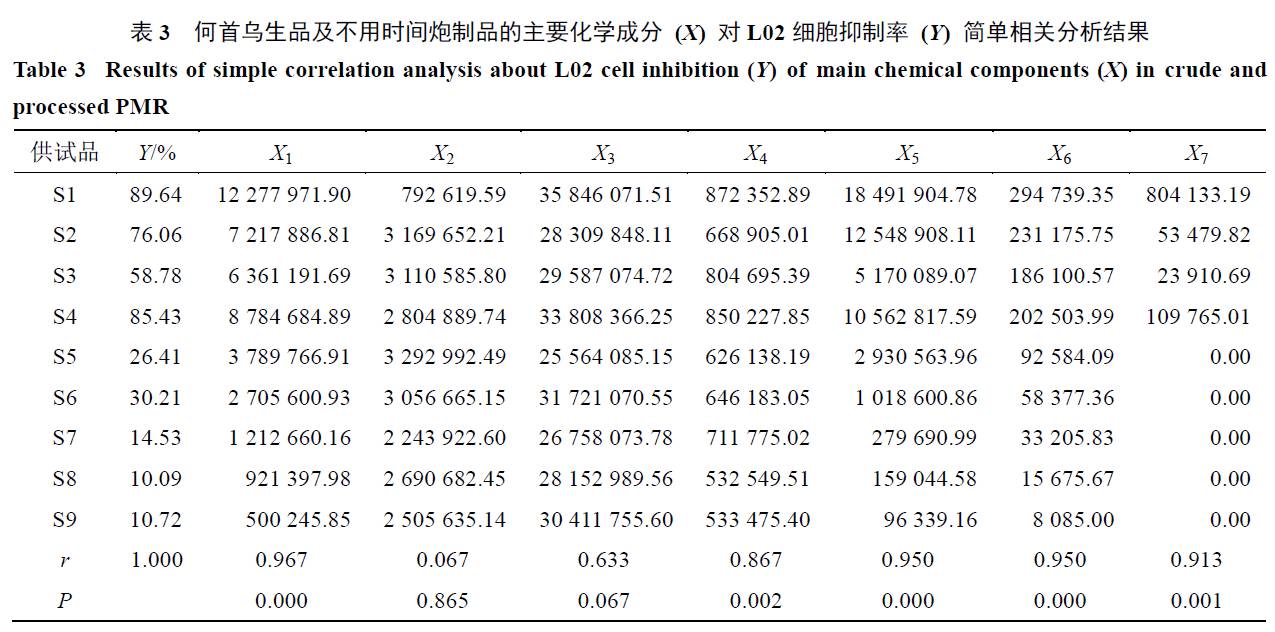
何首乌主要成分与毒性的简单相关分析
本实验以
50%
乙醇提取的何首乌生品及分别炮制
6
、
12
、
24
、
36
、
48
、
72
、
84
、
96 h
共
9
个样品(
S1
~
S9
)为考察对象。为了排除其他成分变量的影响,独立考察各成分与毒性之间的相关性,以何首乌
9
个样品的毒性为因变量(
Y
),何首乌样品中主要的
7
种主要成分反式二苯乙烯苷、没食子酸、大黄素、大黄素甲醚、大黄素
-8-
O
-β-
D
-
葡萄糖苷、顺式二苯乙烯苷、儿茶素的色谱峰面积为自变量(
X
1
~
X
7
),采用
SPSS 13.0
软件单独进行简单相关分析。首先经过正态性检验,检验结果见表
3
,
X
1
~
X
7
偏态性强,均不满足正态分布,因此所有相关分析采用
Spearman
简单相关进行研究。综合变量
X
1
~
X
7
与
Y
的简单相关分析结果(表
3
),以相关系数
r
>
0.80
,
P
<
0.05
为指标,可初步确定反式二苯乙烯
苷、大黄素甲醚、大黄素
-8-
O
-β-
D
-
葡萄糖苷、顺式二苯乙烯苷、儿茶素
5
个成分与何首乌毒性相关性较强。
3.4.2
多元线性相关统计分析方法的选择
本研究采用
SPSS 13.0
进行多元回归的方法进一步探讨何首乌毒性与成分之间的相关性。回归模型中以何首乌生品及不同炮制品毒价为因变量(
Y
),以上述何首乌样品中
7
种主要成分色谱峰面积为自变量
X
1
~
X
7
,回归模型中自变量较多,自变量之间可能存在严重的共线性问题,使自变量与因变量之间的真实相关性被掩盖,因此首先需要进行共线性诊断,以确定采用合适的统计方法。回归模型共线性诊断结果显示多个维度的特征值接近
0
且除
X
3
外其余方差膨胀因子(
VIF
)均大于
30
,说明回归模型存在较严重的共线性,因此本研究采用主成分回归分析探讨何首乌毒性与成分之间的相关性。
3.4.3
主成分回归分析结果及逐步回归分析
本研究采用主成分回归分析探讨何首乌毒性与成分之间的相关性。通过
SPSS 13.0
软件分析,
KMO
(
Kaiser-Meyer-Olkin
)值约为
0.6
,原始数据适宜主成分因子分析模型。依据回归矩阵中各主成分的特征值及贡献率,
7
种成分可提取
2
个主成分
Z
1
、
Z
2
,累积贡献率为
0.891 7
>
0.85
,因此剔除其他主成分。
A
为
SPSS 13.0
分析软件自动标准化的自变量,标准化公式为
A
i
=
(
X
i
-
)/
s
(
s
为样本标准差),
Z
1
~
Z
2
的表达式分别为
Z
1
=
0.305
A
1
+
0.291
A
2
-
0.029
A
3
+
0.275
A
4
+
0.254
A
5
+
0.362
A
6
-
0.071
A
7
;
Z
2
=
−0.107
A
1
-
0.62
A
2
+
0.0296
A
3
-
0.103
A
4
-
0.42
A
5
-
0.203
A
6
+
0.392
A
7
。
Z
1
和
Z
2
2
个变量进入回归模型后,模型很好地拟合了数据(调整后
R
2
=
0.964
,
F
=
107.703
,
P
=
0.000 0
<
0.01
)。将主成分
Z
1
~
Z
2
的表达式代回到回归模型中,得到因变量
Y
对标准化自变量
A
1
~
A
7
的线性回归模型,通过标准化公式将标准化自变量转化为原始自变量,得到因变量
Y
与原始自变量
X
1
~
X
7
的线性回归方程:
Y
=
−54.801 4
+
2.24
×
10
−6
X
1
+
7.3
×
10
−6
X
2
+
2.5
×
10
−7
X
3
+
6.45
×
10
−5
X
4
+
8.42
×
10
−7
X
5
+
9.79
×
10
−5
X
6
+
2.35
×
10
−7
X
7
。
上述主成分回归分析结果表明,拟合的回归模型中
P
=
0.000 0
<
0.01
,有显著统计学意义。由回归模型可知,自变量
X
4
与
X
6
与具有较大的参数值,说明大黄素甲醚与顺式二苯乙烯苷对何首乌毒性有较大的贡献度。综合简单相关分析和多元分析结果,提示大黄素甲醚与顺式二苯乙烯苷
2
个成分可能是何首乌主要毒性成分。
4
讨论
近年来,临床上有关何首乌及其制剂导致肝损伤的报道频发,探究其毒性物质基础成了学术界关注的焦点
[4-7]
。然而,何首乌药物成分与毒性之间的关系尚不明确,无法阐明其毒性物质基础
[29]
。指纹图谱技术凭借其能够表征样品所含化学成分质的特征和量的大小以及中药的整体特征
[15,17-18]
,是当前进行中药等复杂物质体系质量控制及研究的重要手段。本研究通过何首乌醇提物的化学指纹图谱信息与何首乌致肝细胞毒性相结合,探讨何首乌所致肝毒性的物质。实验采用
UPLC-Q-TOF-MS
技术表征何首乌生品和不同时间炮制品的化学信息,通过对照品各成分色谱峰信息、高分辨质谱、相关参考文献数据指认出
7
种主要共有成分分别为反式二苯乙烯苷、没食子酸、大黄素、大黄素甲醚、大黄素
- 8-
O
-β-
D
-
葡萄糖苷、顺式二苯乙烯苷、儿茶素。通过何首乌肝细胞毒性与主要成分的简单相关分析,表明反式二苯乙烯苷、大黄素甲醚、大黄素
-8-
O
-β-
D
-
葡萄糖苷、顺式二苯乙烯苷、儿茶素均与何首乌毒性作用相关,进一步主成分回归分析显示大黄素甲醚与顺式二苯乙烯苷对何首乌肝毒性贡献最大,提示这
2
个成分可能是与何首乌毒性相关的目标化合物。
目前国内何首乌的质量控制方法主要是基于指标性成分的定量测定,且生首乌与制首乌控制指标相似
[1]
。然而,一般认为,何首乌生用有一定的毒性,制何首乌毒性小,不同炮制品何首乌毒性有很大差异
[14]
,如本研究显示何首乌高压黑豆汁蒸至
36 h
后才能达到减毒的效果。因此,这种质控模式既难以有效监控也不能合理评价药材质量,更难以反映其安全性和有效性。倘若物质基础明确,则有利于降低何首乌毒性,从而保证临床用药的安全与有效。本课题基于谱、毒相关,构建成分指纹谱与毒性相对应的表观形式,可以更准确地表征药材整体的肝毒性,为从药材质量层面降低何首乌临床肝损害的发生提供科学支持。但也存在不足之处,如该谱效相关研究目前还无法阐明毒性成分之间是否存在协同作用,突破此项技术难点也是中药现代化的关键所在;选取的药效学指标不能完全代表中药多功效特性,且各指标检测与中药临床效应并不完全吻合等问题。本研究为阐明何首乌毒性物质基础进行了初步研究,后续将应用动物实验对可能的何首乌毒性物质进一步验证,为制定科学的何首乌质量评价标准提供依据。
参考文献(略)
此文摘自:郜 丹,李晓菲,尹 萍,王伽伯,孙洪胜,李 飞,肖小河.基于炮制减毒思想的何首乌肝毒性物质基础初步研究 [J]. 中草药, 2017, 48(10):2044-2050.




