多模态分子成像探针对于生物医学和临床研究是至关重要的。
例如,磁共振成像(MRI)和近红外(NIR)荧光协同组合的双模态成像探针,其中MRI可以产生具有无限组织穿透深度和高空间分辨率的解剖图像,而NIR荧光能够产生高灵敏度的图像。
然而,大多数探针显示“始终在线”信号,可能导致肿瘤-背景比(TBR)较差,还不能有效地满足早期诊断恶性肿瘤的需求。
小分子基可激活探针具有明确的化学结构以及较小的尺寸,使得它们能够渗透并扩散到肿瘤组织中以达到分子靶并被激活。
但是,设计能够与肿瘤细胞相互作用且可以同时切换NIR荧光和MRI信号的小分子探针仍然具有挑战性。
此外,小尺寸探针可导致从靶位快速冲洗进而降低肿瘤累积和TBR,对长期分子成像是不利的。
因此,迫切需要一种新的策略来设计可激活荧光/MR双模态成像探针以提高其肿瘤渗透性和肿瘤积累。
近日,
南京大学叶德举教授课题组
设计并合成了一种小分子基可激活NIR荧光/ MRI双模态探针,并通过酶介导荧光反应和原位自组装将其用于体内成像。
该策略利用酶的催化活性增强了MR特性并增加了靶组织中的探针积累。
使用碱性磷酸酶(ALP)作为模型酶,研究表明,可激活双模态探针能够实现皮下ALP阳性肿瘤的非侵入、高敏感和空间分辨成像以及NIR荧光引导的原位肝脏肿瘤的实时手术切除。
该成果以题为"
Activatable NIR Fluorescence/MRI Bimodal Probes for in Vivo Imaging by Enzyme-Mediated Fluorogenic Reaction and Self-Assembly
"发表在国际著名期刊
J. Am. Chem. Soc.
上。
图1 ALP激活的NIR荧光/MR双模态探针用于体内成像的示意图
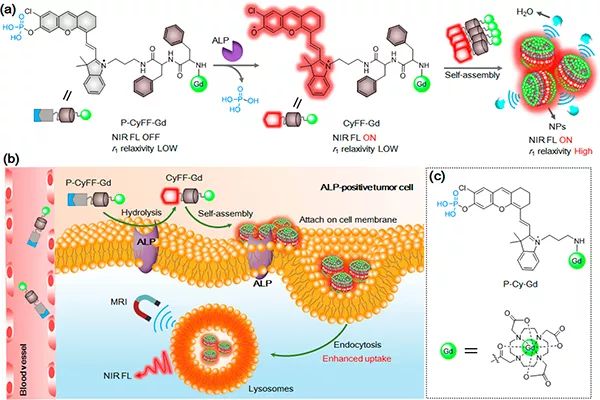
(a) P-CyFF-Gd的化学结构、ALP介导的荧光反应和P-CyFF-Gd原位自组装成NPs的示意图;
(b) 提出的P-CyFF-Gd用于体内ALP阳性肿瘤细胞的NIR荧光/MR双模态成像的机制;
(c) 设计的非组装对照探针P-Cy-Gd的化学结构。

(a) 与ALP(2 U/mL)在37 °C孵化指定时间后,P-CyFF-Gd(200 μM)的HPLC分析;
(b) 与ALP(2 U/mL)在37 °C孵化指定时间后,P-CyFF-Gd(200 μM)的DLS分析;
(c) 将P-CyFF-Gd(200 μM)与ALP(2 U/mL,37 °C)一起孵化30分钟后形成纳米粒子的TEM和AFM图像;
(d) 与ALP(0.1 U/mL,37 °C)孵化0-40分钟,P-CyFF-Gd(5 μM)的紫外-可见吸收光谱;
(e) 与ALP(0.1 U/mL,37 °C)孵化0-40分钟,P-CyFF-Gd(5 μM)的荧光光谱;
(f) 在Tris缓冲液中与ALP(2 U/mL)孵化0-40分钟后,P-CyFF-Gd (200 μM)的
T
1
加权MR图像和
T
1
值(0.5 T);
(g) 用不同浓度的ALP孵化30分钟后P-CyFF-Gd(5 μM)的荧光光谱;
(h) 与胰蛋白酶、BSA、溶菌酶、ACP、ALP或ALP以及P-CyFF-Gd的抑制剂Na
3
VO
4
一起在Tris缓冲液中孵化后,P-CyFF-Gd的荧光光谱;
(i) 与胰蛋白酶、BSA、溶菌酶、ACP、ALP或ALP以及P-CyFF-Gd的抑制剂Na
3
VO
4
一起在Tris缓冲液中孵化后,P-CyFF-Gd的
T
1
加权MR图像















