
传统DNA甲基化由亚硫酸氢盐全基因组测序方法(WGBS)进行,该法检测的DNA片段很短,因而对跨越远基因组距离的DNA协同甲基化的检测能力有限。近日,来自美国Ludwig癌症研究中心的Guoqiang Li等在Nature杂志的方法版块,介绍了一种能同时在单细胞中表征染色体构象和DNA甲基化组的方法(
https://doi.org/10.1038/s41592-019-0502-z
),研究人员将该分子方法命名为Methyl-HiC。该方法揭示了核内空间邻近的远端基因组片段之间的协同甲基化状态,并剖绘了混合类群中染色质结构和DNA甲基体的异质性。
DNA是动态调节的,且因细胞形态各异。相邻的CpG的甲基化状态通常是相关的,这可由DNA甲基化可以在碱基分辨率下进行分析(WGBS)得出。由于DNA在空间上被组织成三维结构,远端基因组区域可能通过染色质折叠而接近。研究人员推断空间上近端的DNA序列也可能表现出协同的DNA甲基化。
染色体构象捕获技术通过限制性消化和近端DNA片段的原位连接来获悉空间邻近性。原则上,染色体构象捕获实验保存了连结的DNA上的胞嘧啶甲基化信息,可以通过亚硫酸氢盐测序方法检测到。
该研究开发的Methyl-HiC法结合了原位Hi-C和WGBS,同时检测染色质构象和DNA甲基化。首先进行的是是一个标准的原位Hi-C程序,然后是一个额外的亚硫酸氢盐转化步骤,该步骤在库构建和成对的末端测序之前进行。最后使用定制软件确定胞嘧啶的甲基化状态和配对的接触频率。
1:同时分析mESC中的远程染色质相互作用和DNA甲基化组
将Methyl-HiC应用于小鼠胚胎干细胞(mESC),观察到一种与原位Hi-C极为相似的接触矩阵(图1a),两种方法获得的的基因组距离——接触概率函数相近,且检测到类似的染色质环(图1b)。并且获得了相当的拓扑相关结构域(TAD,图1c)。在小鼠基因组中,Methyl-HiC获取了1600万个CpG的数据,该方法测得的这些CpG的甲基化状态与WGBS法测定的高度一致(图1d)。综上,在生物样品中,Methyl-HiC可以同时准确地描述染色体结构的一般特征和超过80%的甲基化组。
Methyl-HiC被进一步用于验证下述假设:线性分离但位于空间近端的胞嘧啶也可能具有协同的甲基化状态。隔离的染色质环锚点的CpG的甲基化状态呈现显著相关性(图1e)。进一步测试染色质结构特征是否影响这种协同甲基化时发现,染色质环锚点的CPG在A区比B区的甲基化同步性更高(图1f)。染色体间存在弱但具有明显同步性的相互作用。DNA甲基化同步性的程度取决于潜在的染色质状态。
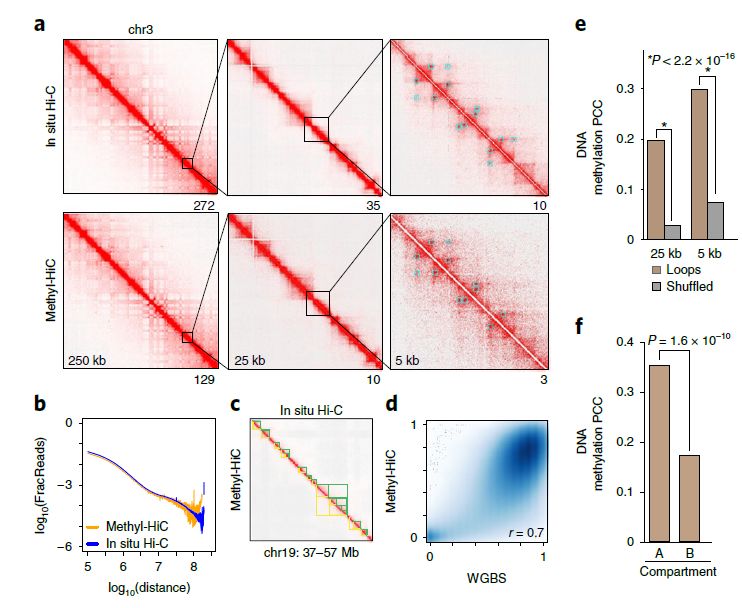
图1 采用Methyl-HiC 同时分析mESC中的远程染色质相互作用和DNA甲基化组
2:单个细胞DNA甲基化组和染色质结构的同步分析
为了进一步证明Methyl-HiC的实用性,研究人员用它来同步分析单个细胞中的染色质构象和DNA甲基化,即采用单细胞Methyl-HiC(scMethyl-HiC)技术。scMethyl-HiC在操作上有所调整,即在近端连接之后,将单个核分入96孔板中,在那里对每个核进行亚硫酸氢盐转化,然后将得到的DNA扩增出来进行测序。
scMethyl-HiC的总接触频率与批量数据(图2a)和先前发布的mESC单细胞Hi-C数据相相当(图2b)。血清ESC和2i mESC中CpG的平均甲基化水平分别为61.9%和23.4%,而CPH的甲基化水平分别为1.3%和0.9%(图2c),这与前人结果一致。与Methyl-HiC批量数据一致,单个细胞中染色质环锚定点的DNA甲基化是协同的(图2d)。上述结果的效力表明,Methyl-HiC可以同时检测单个细胞的DNA甲基化和染色质结构。
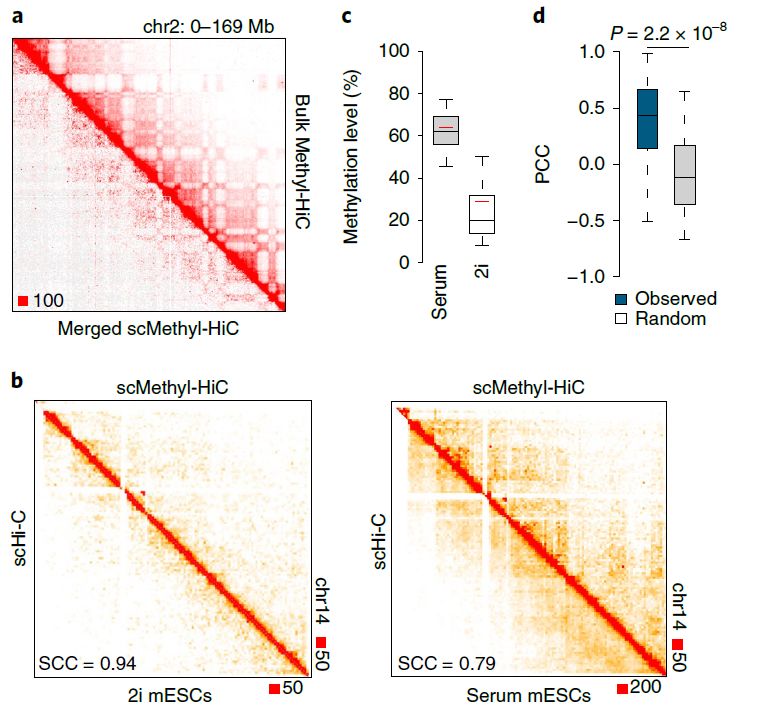
图2 单个细胞DNA甲基化组和染色质结构的scMethyl-HiC同步分析
3:scMethyl-HiC对mESC的异质性分析
为利用scMethyl-HiC数据揭示细胞群的异质性,首先基于每个细胞的DNA甲基组对所有细胞进行了聚类。在血清和2I条件下生长的mESC之间存在明显区分。此外,在血清条件下生长的mESC进一步被分为两个亚群,与前人研究一致(图3a)。每类中的聚集染色质接触矩阵也显示出明显的类特异性染色体构象(图3c)。将这些亚群与来自多个细胞系的DNA甲基化图谱进行了比较,发现第3类显示出潜在的胚胎躯干发育趋势(图3b)。同样的,位于不同基因组分区的、基因本体定义为胚胎躯干发育相关的甲基化差异区域(DMR)和基因出现富集(图3d,e),以
Epha4
为例(图3f)。综上,scMethyl-HiC可用于解决异质细胞群中细胞类型特异性染色体结构的问题。
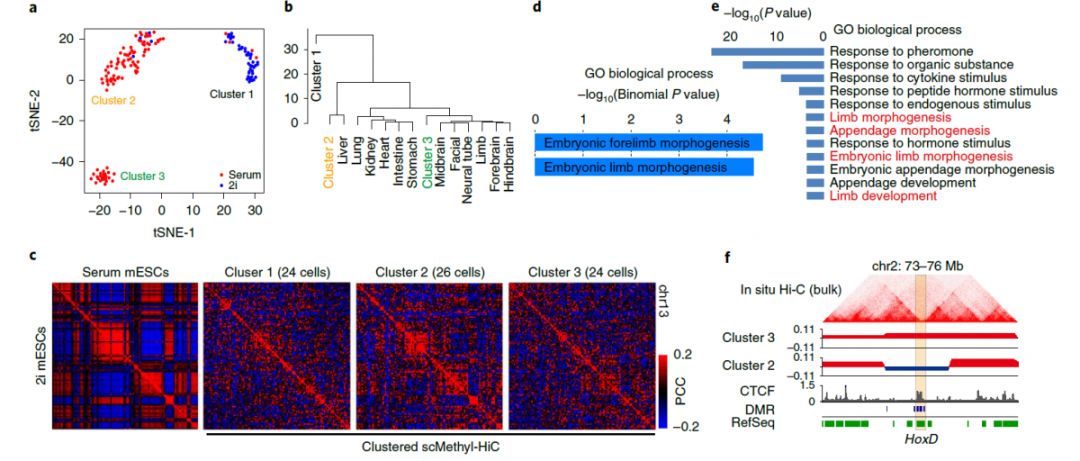
图3 scMethyl-HiC揭示了mESC的异质性
与WGBS相比,Methyl-HiC总体上少分析了约20%的CpG,但开放染色质区域(如启动子和增强子)的CpG相对更多,这可能是由于程序中使用的限制酶减少了对异染色质的获取。染色质环的CpG甲基化状态呈现相关性,这种相关性并不局限于由CTCF介导的染色质环,因为不被CTCF占据的染色质环锚点也显示了DNA甲基化的显著相关性。 scMethyl-HiC证实了Methyl-HiC的实用性。scMethyl-HiC在平均每个核567380 个CpG的DNA甲基化组,与以前的单细胞甲基化组数据集相当。scMethyl-HiC揭示的异质性与细胞群聚类也与前人结果一致。尽管目前的scMethyl-HiC方法仍然受限于数据的稀缺,但该问题在将来可能会通过其它的DNA甲基化检测方法来解决。
该研究介绍了一种新的分子方法Methyl-HiC,通过结合原位Hi-C和WGBS,该法能够同时表征复杂组织中的细胞类型特异性的染色质结构和表观遗传组。该研究验证了Methyl-HiC方法对相距较远的mESC甲基化组的分析、单一细胞分析和异质性分析的工作效力,作者认为scMethyl-HiC可用于研究复杂组织中细胞类型特异性表观遗传组和染色质结构。
23Plus欢迎表观遗传领域的同行们投稿,分享学术成果、学术见解和学术故事。














