很多同仁十分喜爱上海市食品药品检验所谢沐风老师的文章。小编在整理和收集谢老师已发表文章时,注意到“同写意-微信公众号”2016-07-25推送的“溶出一致≈临床疗效一致?解读《日本版橙皮书》”一文。
经与谢老师联系告知,该文撰写缘于很多同仁怀疑他提出的“做好溶出,便可保证生物等效性(BE)试验至少90%成功”的观点,故编译了在日进修时的带教老师、《日本药品品质再评价工程》总设计师青柳神男老师撰写的“日本版橙皮书”一文,旨在推广和倡导溶出度试验技术在我国的正本清源和落地生根。
文章推送后,引起《药品评价杂志》的关注,向谢老师约稿,经老师完善后发表于2017年第4期。此番转载,衷心希望国内同仁切勿仅关注美国,还要“环顾四周”、虚心地借鉴一下别具一格的日本作法。(该文较长,请您留出10分钟时间阅读;或登录电脑,打印出纸制版,静心学习)

摘要
日本版《橙皮书》的制订与美国版有很大不同,采用了特有的体外溶出评价手段,因为日本药监局专家组经大量案例验证得到如下结论:当仿制药体外溶出行为与原研药一致时,不仅两者体内生物利用度一致的概率将极高(即生物等效性试验可轻松通过),且临床上对于各类患者的疗效也将一致。这一认知很值得我国借鉴与效仿,现对该书进行编译,并结合我国口服固体制剂仿制药质量评价进行讨论,以供同仁参考。
国家仿制药质量与疗效一致性评价工作于2016年3月重新开启[1]。随着工作进展,被行业漠视多年的制剂重要性终于被广泛认知[2];且由于该项工作仅针对口服固体制剂,故被荒废许久的体外溶出度研究瞬间成为行业焦点[3];
此上这些、都会令我们联想到1997年日本药监局开展的《药品品质再评价工程(以下简称“工程”)》[4,5],由于两国制药行业发展史极为相似,出现的问题也同出一辙(部分已上市口服固体制剂安全无效[6,7]),故该国作法与经验值得我国效仿和借鉴。
本文是对工程总设计师青柳神男先生(时任国家药品检验所药品部一室主任)于2002年8月发表的“日本版橙皮书”一文[8]进行的编译和解读。旨在介绍日本不同于美国的独特作法,即在口服固体制剂仿制药质量评价方面,日本官方认为:①只要体外溶出行为与原研药一致,两者的临床疗效就几近一致;②因为溶出一致,生物等效性(BE)试验就几乎没有失败的[9],所以BE试验在某种程度上甚至可忽略;③那么判断仿制药品质的评价体系“溶出+BE试验=疗效一致”就变成了“溶出一致≈疗效一致”[10]。
而与之形成鲜明对比的是:美国FDA更看重体内BE试验,对体外溶出不甚重视。(但也许韬光养晦了,呵呵~~)。
笔者2003年8月—2004年2月曾在该部进修,师承青柳老师,系统地学习了工程实施细节,并深切感受到日本官方的工作理念并非追求完美无缺和面面俱到,而是根据本国现状与本土企业实际情况,制订出因地制宜、活学活用的政策要求,从而实现在监管框架下帮助和促进企业发展,且在专业上的运用非常强调实用性和可操作性。以上专业观点和个人感悟还请读者随译文和解读(【内容】)深切体会。谢谢您的阅读!
美国版《橙皮书》收录了具有与原研药体内生物利用度相同的仿制药;而日本版橙皮书则是收录了具有与原研药体外溶出行为一致的仿制药,因日本当局认为:溶出一致可显著防止体内生物利用度和临床疗效与原研药不一致。本文将深入阐述体外溶出、体内BE和临床疗效三者间关系,同时介绍该书的来龙去脉与发展历程。
《日本版橙皮书》收录了经“药品品质再评价工程”确认与原研药具有相同溶出行为的仿制药品,还记载了溶出度试验法、质量标准、再评价进展情况等信息;尤其是给出了参比制剂在各生理pH值的多条溶出曲线,这对于未来的品质监管和预测药物在体内吸收等诸多方面均提供了强有力的技术支持。
橙皮书最早由美国FDA发行。由于封面为橙色,故人们习惯称之为《橙皮书》,其全称为“经官方批准的、临床疗效相同的药品”。由于其中含有大量仿制药,故只能通过不同的商品名来区分,但这些仿制药均与原研药进行了BE试验验证。
该书发行的目的是公布具有与原研药临床疗效相同的仿制药,从而促进仿制药使用,最终为降低患者医疗费用和国家医保支出做出贡献。
与之相似的是、日本版封面也采用了橙色,但名称改为《医疗用药品品质情报集(暨日本药典第三部)》,由厚生省药品管理局审查管理课(相当于我国的注册司)制作、药事日报社发行。
【日本药监局将《橙皮书》作为《日本药典第三部》,可见当局者对溶出度试验的重视程度;且由于该书作为药典的一部分,故为今后市场监管抽查多条溶出曲线奠定了法规依据】

1997年在日本开始的药品品质再评价工程是通过溶出行为一致性的评价手段来验证已上市仿制药(包括已采用人体BE试验验证过的)质量是否等同于原研药。该实验涵盖了人体内消化道pH值全范围(1.2~6.8),为此书中收载了经官方认定的各品种参比制剂多条特征溶出曲线[11],且为了科学准确地建立起这些曲线,采用了分五步制订的流程。
由于日本版是以溶出一致性作为评价指标,虽与美国以BE试验为评价指标不同,但目标是完全一致的,即都是促使仿制药的临床疗效等同于原研药,只不过采用的手段不同罢了。
相信很多人会抱有疑问:溶出一致就能保证临床疗效一致?我们的回答是:虽说无法完全保证,但可显著防止临床疗效不一致,并对此充满自信!同时,溶出度试验相比于BE试验,具有事半功倍、多快好省等诸多优点。至于原因、让我通过介绍日本版橙皮书的发展历程来阐述吧!
【日本学者敢于确立“溶出一致、临床疗效就几近一致”的理念是基于“溶出一致、BE试验就几乎没有失败”的客观事实,所以“溶出+BE试验=疗效一致”就变成了“溶出一致≈疗效一致”。20年前日本官方就已确立的专业认知,我们现在来看都可算是“逆天之举”!】
众所周知、橙皮书产生的原因:①政府鼓励通过使用仿制药降低医疗费用的支出;②随着仿制药生物等效性试验评价法的发展衍生而成。日本政府同美国一样、均清醒地意识到:唯有通过大量廉价的仿制药上市才能控制医疗费用的不断上涨;而达到该目的的根本是仿制药质量要等同原研药;假设劣于原研药,就无法、也不应使用该仿制药。
【笔者认为,在我国,无论是国家层面还是企业层面,均应脚踏实地做好仿制药才是重中之重,绝不应过度沉溺于那些虚无缥缈、水中望月的创新药,因为仿制药研发的实质就是制剂研发,核心是工业药剂学,在未打好仿制药基石的前提下研制创新药可谓是空中楼阁。】
仿制药与原研药在疗效上的差异问题早在1960年,欧美就有地高辛制剂和甲苯磺丁脲制剂临床疗效差异显著的报道。其原因是处方与工艺的不同导致主成分在体内的溶出和吸收不同,最终使得血药浓度不同所致。
由此,人们认知到:为确保仿制药临床疗效等同于原研药,两者的体内生物利用度应首先相同,也就是通常所说的需进行BE试验验证,为此各国药监局均推出了仿制药研发申报必须进行该试验的规定,即采用AUC、Cmax、Tmax等参数来评价两者在体内的吸收速度与程度是否一致。
同时,随着体外溶出度试验技术的发展,人们逐渐认知到:可采用该实验来推断药物在体内的释放特性,并逐渐演变成采用该实验进行药物的品质管理。
橙皮书中写到,虽然没有仿制药与原研药治疗效果出现明显差异的报道,但溶出行为和生物利用度存在差异的研究报告并不少见,甚至有服用后药片未崩解、以原型被排泄出的报告都存在。由此,我们有理由怀疑出现以上情形的仿制药临床疗效会有问题,并有责任立即停止这些安全无效药物的供应。

我们认为仿制药的生物利用度与原研药存在差别,主要是因政府批准时所采用的评价法有问题。1980年前,日本仅要求进行动物实验来验证血药浓度一致性,但这无法保证人体内生物利用度一致。1980年后,虽然要求将动物改为人体,但并未要求企业进行体外溶出行为的全面比较研究,因此可以说品质监管依然不够充分,这主要是因BE试验自身存在不足所致。
【日本专业官员能如此坦诚、令人钦佩。美国Hatch-Waxman法案推出BE试验时有1个核心前提:假设在健康人群中取得的生物等效性研究数据对患者是等同的。日本学者经研究发现:在很多情形下、该假设是不成立的,盖因年轻人体内环境与中老年人相差甚远,但苦于伦理要求又无法采用各年龄段、男女各半方式进行BE试验;且试验费用高昂,企业无法承受,故开创性地采用体外溶出评价手段来弥补BE试验的局限性】
更为核心的是,在日本随着老年化社会的进展,胃酸缺乏人群日益增多(如图1所示)。
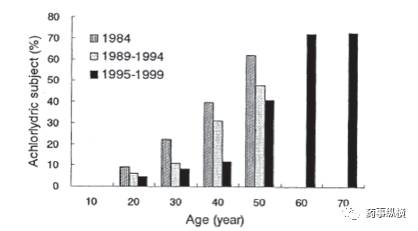
图 1 日本各年龄段胃酸缺乏人群的比例及变化趋势
Fig 1 Change in percentage of achlorhydric subjects ineach age category between 1984-1999
研究表明:pH值的变化将显著影响药物的生物利用度。如图2所示,在pH不同的介质中,两厂家的甲硝唑片的溶出行为显著不同:在胃酸正常人体内(即低pH值介质)生物利用度无异;但在胃酸缺乏人体内(即高pH值介质),仿制药E片的血药浓度明显偏低、为安全无效制剂。这揭示出:我们必须要求企业在进行仿制药研发时进行多介质溶出行为的比较研究、且应一致。

图 2 两个厂家的甲硝唑片在胃酸正常和胃酸缺乏受试者中的溶出度
Fig 2 Dissolution of metronidazole from two tablets (left) and mean serum concentration in normal and achlorhydricsubjects(right)
A为原研药、E为仿制药。右上图:采用胃酸正常受试者抽血验证(一般为年轻人、胃内通常为低pH值)右下图:采用胃酸缺乏受试者抽血验证(一般为中老年人、胃内通常为高pH值。但由于BE试验几乎无法采用此类人群抽血验证,故日本规定:若该介质中仿制药的体外溶出行为与原研药不同、则必须采用胃酸缺乏的年轻人作为BE试验受试者)
根据以上研究结论,1997年厚生省修订了《仿制药生物等效性试验指导原则》,要求仿制药研发时必须进行pH1.0~7.0范围的溶出行为比对研究、并应一致。倘若出现不一致,其后的生物等效性试验必须采用胃酸缺乏人群或该药物适应症人群作为BE实验受试者。通过该修订,日本当局对批准的仿制药便有信心保证其质量与原研药出现临床疗效不一致的可能性就几乎不存在了。
【如仿制“非那雄胺制剂”和“盐酸坦索罗辛缓释制剂”,倘若出现体外溶出行为不一致的某条溶出曲线,日本药监局会要求该仿制药企业必须采用18~24位老年男性作为BE试验受试者,因为该药的适应症仅针对此类人群。如此,日本仿制药企业均极为务实地将各条溶出曲线做到一致后再来申报,此举极大地促进了该国药品制造水平的提升】
《仿制药生物等效性试验指导原则》修订后,衍生出“已批准上市的仿制药按新评价法,若出现体外溶出行为与原研药不一致现象,如何应对”的新课题。为此,厚生省原安全科设立了“重新评估已上市药物质量”的研究课题与国家工程。
经研究,我们发现很多已上市药物的体外溶出行为与原研药不一致,由此我们担心这些药物的体内生物利用度在某类患者体内也会与原研药不一致,从而影响临床疗效。且我们专家组一致认为:如采用人体BE试验对已上市大量药物进行再评价,无论是时间、费用和资源等诸多方面都面临巨大挑战,由此我们想到采用简单易行的溶出度试验来替代BE试验。与后者相比、前者可敏锐地揭示出不同来源制剂间的溶出行为是否一致,且一旦出现不一致,就极有可能出现在某类患者体内生物利用度不一致的情况。
最终,我们专家组一致认为:针对仿制药,通过与原研药比较pH1.0~7.0溶出行为,只要均一致,则出现生物不等效的概率是极低的。同时,我们还确认了“体外溶出一致、体内生物利用度不一致的案例是极少”的客观事实。为此,专家组以该专业理念为立足点开始实施品质再评价工程,并将确认了溶出行为一致性的仿制药品目录收载于《橙皮书》中公开出版。以上就是《日本版橙皮书》的来龙去脉。
【日本学者这种不唯美国马首是瞻,开创性地采用多条溶出曲线评价手段[13],值得我们深思,在此为日本专家组的勇气和担当点赞!】
2002年,随着医保报销制度的修订,仿制药在未来将被大面积地强制使用,为此其质量愈发受到各方强烈关注。随着《橙皮书》的不断出版发行,将那些溶出行为与原研药一致的仿制药收录其中,便可信心满满地使用这些仿制药来替代原研药了,这也正是日当局建立《橙皮书》的使命与职责。
但是,《橙皮书》价值绝非仅限于此。由于其中详尽记录了各品种参比制剂的溶出度试验法、多条特征溶出曲线、溶出度质量标准、品质再评价进展步骤等大量信息,所以其还具备了极高的使用价值。如“揭示并公开参比/原研制剂在pH1.2~6.8范围的多条特征溶出曲线”就属全世界首创!
首先,我们可从这些曲线的形状预测出药物在体内消化道的释放行为,例如各pH值溶出曲线均一致的药物,我们便可认为其在体内的吸收、即产生有效血药浓度不会受人体环境的影响,即在任何人群体内的生物利用度均良好;反之,在6.8介质中释放缓慢的药物,我们便可推测其在胃酸缺乏患者体内释放可能存在问题,从而导致有效性出现问题。
其次,从多条溶出曲线形状和API在各pH值介质中的溶解度,我们还可洞悉制剂优劣。除了缓控释制剂和肠溶制剂外,各pH值介质中的溶出行为应与溶解度正相关,倘若未出现此情形,我们则怀疑制剂质量有问题。
第三,我们可以公开的参比制剂多条特征溶出曲线为基础,监测各仿制药企业的产品是否与其一致;这一做法相比仅规定下限的溶出度质量标准而言要严格得多[13,14],从而促使我们药监部门贯彻实施对仿制药质量的长期有效监管,并最终肩负起“为广大民众提供品质优良、质量均一稳定仿制药”的崇高使命。
以上,本文针对日本版橙皮书的诞生、制作与使用等做了详细介绍。我们非常希望大家能够将该书中的大量情报予以活学活用,在仿制药的研发、生产、质控、监管、临床使用等诸多方面发挥作用,从而为我国仿制药质量的不断提升做出我们应有的贡献。
参考文献
[1] 国务院. 国务院办公厅关于开展仿制药质量和疗效一致性评价的意见(国办发〔2016〕8号). 2016-3-5--l.
[2] 谢沐风. 提高质量标准, 促进品质提升, 带动行业发展——议如何促进国产药品的质量[J]. 中国医药工业杂志, 2007, 38(11): 152-154.
[3] 谢沐风. 我国仿制药症结何在——深度剖析我国仿制药质量与原研药存在差距的根源[n]. 医药经济报 2015, (5).
[4] 谢沐风. 简介日本“药品品质再评价”工程(溶出度研究系列一)[J]. 中国药品标准, 2005, 6(6): 42-46.
[5] 谢沐风. 改进溶出度评价方法, 提高固体药物制剂水平——论如何提高我国口服固体制剂的内在品质(溶出度研究系列二)[J]. 中国药品标准, 2006, 7(1): 43-47.
[6] 国务院. 国务院关于印发国家药品安全“十二五”规划的通知. 2012-2-31.
[7] 谢沐风. 对国务院《关于印发国家药品安全十二五规划通知》的解读与思考[J]. 药品评价, 2012, 9(20): 6-10.
[8] 青柳伸男. 如何为临床提供优良的、性价比高的仿制药[J]. 医疗, 2002,56(8): 457-460.
[9] 谢沐风. BE维新:如何提升试验成功率[n]. 医药经济报, 2015, (7).
[10] 谢沐风. 解读“口服固体制剂仿制药一致性评价技术手段——多条溶出曲线”[J]. 中国医药工业杂志, 2013, 44(4): 411-414.
[11] 谢沐风. 具有区分力的溶出曲线[J]. 中国医药工业杂志, 2014, 45(7): 687-689.
[12] 张启明, 谢沐风. 采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志, 2009, 40(12): 946-955.
[13] 谢沐风. 国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J]. 中国药事, 2008, 22(3): 257-261.
[14] 郭志鑫. 中日美药品上市后质量评价体系的比较[J]. 中国药事, 2009,23(7): 718-720.
关联阅读
1. CDE、别再疑神疑鬼啦,杂质不会漏检的!
2.【终极解密“第2弹”】缓控释制剂关键性溶出曲线——读“印度人做溶出”一文有感
3. 终于明白印度人为何能将仿制药做好了! —— 对“如何开发与验证适度区分力的溶出方法”一文有感
4.【终极解密】难溶性药物制剂关键性溶出曲线
5.【他山之石】日本药审中心为何主动公开每家企业的《研发申报资料概述》
6.【大咖谈】有朝一日、溶出能替代BE?—— 读“美国仿制药生物等效性评价的意义及方法”一文有感
7.【一致性评价】别抠杂质了,抠溶出吧——谢沐风老师对《溶出度试验技术》一书的解读
8.别抠啦,主成分比杂质毒多了!—读“八成新药临床数据涉假?食药总局回应称不符合事实”一文有感
9. 如何把液相做到“打游戏”
10. 溶出一致 ≈ 临床疗效一致?解读《日本版橙皮书》
11.【这个可以有!】仿制药杂质含量比原研药多、只要在限度内
本文摘自《药品评价》 2017年第14卷第4期,经得作者授权后转发,转载本文请注明。

药事纵横是一个开放,由自愿者组成的团体,现有成员13名,分别为 Voyager88(魏利军),雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,占小兵,ISAL,海角边,yhqqqqq,鲁礼炎,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711679















